文章信息
- Mina53与CBX8在肝细胞肝癌中的表达及其与临床病理特征和预后的关系
- Expression of Mina53 and CBX8 in Hepatocellular Carcinoma and Their Correlation with Clinicopathological Features and Prognosis
- 肿瘤防治研究, 2020, 47(6): 451-456
- Cancer Research on Prevention and Treatment, 2020, 47(6): 451-456
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1341
- 收稿日期: 2019-10-28
- 修回日期: 2020-02-25
2. 266003 青岛,青岛大学附属医院病理科;
3. 276000 临沂,临沂市人民医院病理科
2. Department of Pathology, The Affiliated Hospital of Qingdao University, Qingdao 266003, China;
3. Department of Pathology, Linyi City People Hospital, Linyi 276000, China
肝细胞肝癌(HCC)是世界上最常见的消化道恶性肿瘤之一,具有较高的发病率及死亡率,严重威胁人类的生命健康[1]。近年来,尽管在肝细胞肝癌早诊、早治方面已取得巨大进步,但患者总体预后仍较差[2-3]。因此,寻找影响肝细胞肝癌发生发展的有效标志物,对研究肝细胞肝癌的发病机制及靶向治疗具有重要的临床意义。
色素框同源蛋白8(chromobox protein homolog 8, CBX8)是CBX蛋白家族的重要成员之一,通过参与组蛋白甲基化、染色体重构等过程,调节基因的表达[4]。研究表明,CBX8在食管癌、膀胱癌、肝癌、结直肠癌等多种肿瘤组织中异常表达,促进肿瘤的发生发展[5-8]。Mina53是近年来发现的一个与细胞增殖密切相关的新基因,位于染色体3q12.1上,是原癌基因C-myc诱导的下游靶基因之一,主要定位在细胞核内,影响组蛋白的甲基化状态,或参与染色体重构[9-10]。已有研究表明,Mina53蛋白在多种恶性肿瘤中高表达,其高表达促进肿瘤复发转移,并提示患者预后不良[11-15]。本研究联合检测肝细胞肝癌及相应癌旁相对正常组织中Mina53和CBX8的表达,旨在探讨两者的表达与肝细胞肝癌患者临床病理特征及预后的关系,为肝细胞肝癌的诊断和治疗提供新的思路和依据。
1 资料与方法 1.1 临床资料收集青岛大学附属医院病理科2014年2月—2015年1月肝细胞肝癌手术切除标本121例,包括肝细胞肝癌与相应癌旁相对正常组织(距肿瘤边缘 > 5 cm)。其中男109例,女12例,年龄32~83岁,平均年龄57.07±9.07岁。根据国际抗癌联盟及美国肿瘤联合会制定的第七版TNM分期系统进行临床病理分期。依据免疫组织化学方法判断肝癌标本是否血管受侵,CD31标记显示血管,若在血管内发现癌栓,则认为有血管受侵。所有患者临床病理资料完整,术前均未行放、化疗,且定期电话随访,其中85例术后随访已满五年且有完整的随访资料。本实验经青岛大学附属医院伦理委员会批准。
1.2 主要试剂Mina53鼠抗人单克隆抗体(M532)购于美国Thermo Fisher Scientific公司,工作浓度1:50,CBX8兔抗人多克隆抗体(HPA031462)购于美国Sigma公司,工作浓度1:25;羊抗兔抗体(ab6721)购于英国Abcam公司;羊抗鼠抗体(LK2003)购于天津三箭生物技术有限公司;PV-6000购于北京中杉金桥生物技术有限公司。
1.3 实验方法 1.3.1 构建组织芯片石蜡包埋的组织切片,经苏木精-伊红(HE)染色后,由两位病理医师阅片,镜下选取典型区域,用孔径为1.5 mm的细针对蜡块打孔,采集组织芯矩形排列于受体蜡块中,53℃融合,4 μm连续切片。组织芯片经HE染色后,由病理医师复检选取的组织芯片是否符合标准。
1.3.2 免疫组织化学染色采用PV6000法进行免疫组织化学染色,石蜡包埋组织经脱蜡、水化后,微波加热修复抗原,液体沸腾后5 min停止(1 mmol/L EDTA, pH8.0),自然冷却,滴加3%H2O2室温处理10 min,PBS冲洗3次,每次3 min,孵育一抗4℃过夜,PBS冲洗3次,每次3 min,37℃孵育二抗30 min,PBS冲洗3次,每次3 min,DAB显色,苏木精对比染色,中性树胶封片。用已知阳性表达Mina53的结肠癌组织、非肿瘤区的肾小管上皮组织和已知阳性表达CBX8的肺癌组织作为阳性对照,PBS代替一抗作为阴性对照。
1.4 判读标准HE染色后,组织芯片中细胞核呈棕黄色或棕褐色记为Mina53阳性表达,胞核及胞质呈棕黄色或棕褐色记为CBX8阳性表达。判读标准按染色强度和阳性细胞百分比进行评分[16],染色强度评分标准:无着色:0分(-),黄色:1分(+),棕黄色:2分(++),棕褐色:3分(+++);阳性细胞所占百分比评分标准:0分(<5%),1分(5%~25%),2分(> 25%~50%),3分(> 50%~75%),4分(> 75%)。免疫组织化学染色总分=染色强度得分+阳性细胞百分比得分,< 4分为低表达,≥4分为高表达。
1.5 统计学方法所有数据均用SPSS23.0软件进行统计分析。计量资料用均数±标准差(x±s)表示,两组间均数比较采用独立样本t检验;相关性分析采用Spearman法;Kaplan-Meier法、Log rank检验进行生存分析;采用Cox回归模型进行单因素、多因素生存分析。P < 0.05为差异有统计学意义。
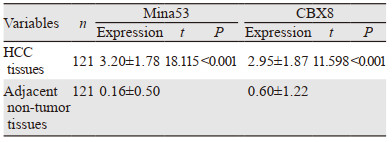
2 结果 2.1 肝细胞肝癌及相应癌旁相对正常组织中Mina53和CBX8的表达免疫组织化学结果显示,Mina53主要在细胞核中表达,121例肝细胞肝癌组织中,53例高表达,68例低表达;而癌旁相对正常组织中均为低表达;CBX8在细胞核及胞质中均有表达,以细胞核为主,121例肝细胞肝癌组织中,63例高表达,58例低表达;而癌旁相对正常组织中均为低表达,见图 1。Mina53和CBX8在肝细胞肝癌中的平均表达量明显高于其相应癌旁相对正常组织,差异均具有统计学意义(均P < 0.001),见表 1。
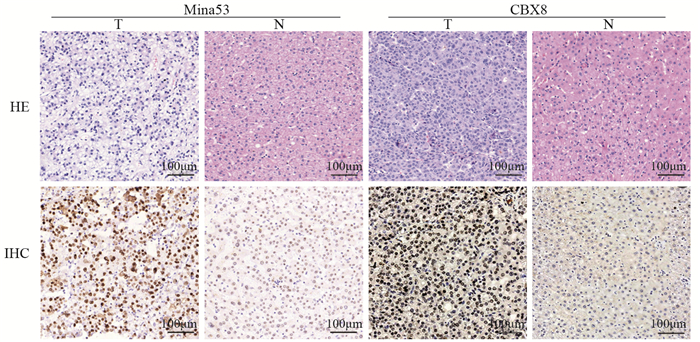
|
| T: hepatocellular carcinoma tissues; N: adjacent non-tumor tissues. 图 1 Mina53、CBX8在肝细胞肝癌及相应癌旁相对正常组织中的表达(×200) Figure 1 Expressions of Mina53 and CBX8 in HCC and adjacent non-tumor tissues (×200) |
|
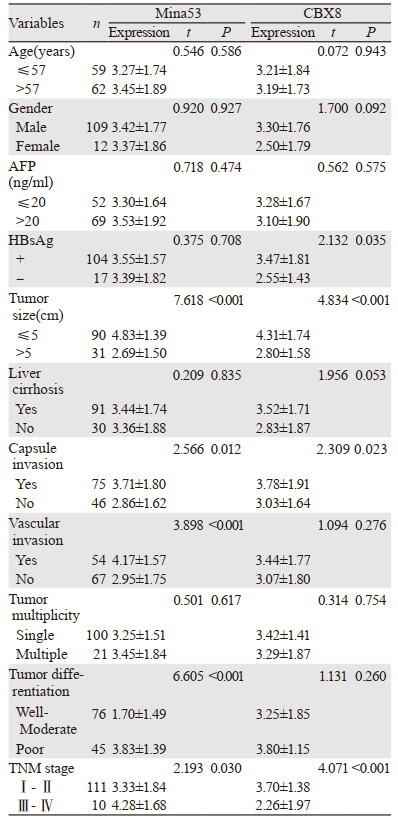
Mina53表达水平与肿瘤大小、被膜侵犯、脉管侵犯、病理分级、TNM分期相关(均P < 0.05),而与年龄、性别、血清AFP水平、乙肝表面抗原(HBsAg)、合并肝硬化、肿瘤多发性无关(均P > 0.05);CBX8表达水平与乙肝表面抗原(HBsAg)、肿瘤大小、被膜侵犯、TNM分期相关(均P < 0.05),而与年龄、性别、血清AFP水平、合并肝硬化、脉管侵犯、肿瘤多发性、病理分级无关(均P > 0.05),见表 2。
|
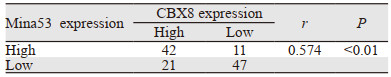
121例肝细胞肝癌中,42例Mina53与CBX8均高表达,47例两者均低表达。在不同Mina53表达状态下,对CBX8的表达情况进一步分析显示:Mina53高表达患者中,CBX8高表达率为79.25%(42/53)明显高于Mina53低表达患者中的CBX8高表达率30.88%(21/68)。肝细胞肝癌组织中Mina53与CBX8的表达呈显著正相关(P < 0.01),见表 3。
|
Kaplan-Meier生存曲线分析结果显示:Mina53与CBX8均低表达者的总生存时间(OS)为59.00±0.57月,Mina53或CBX8高表达者的OS为52.04±2.77月,两者均高表达者的OS为40.71±3.30月,见图 2A;Mina53与CBX8均低表达者的无疾病生存时间(DFS)为56.39±1.24月,Mina53或CBX8高表达者的DFS为44.20±3.51月,两者均高表达者的DFS为31.31±3.61月,见图 2B。Mina53与CBX8均高表达患者的OS和DFS较Mina53或CBX8高表达者及两者均低表达者更短,差异均具有统计学意义(均P < 0.001)。
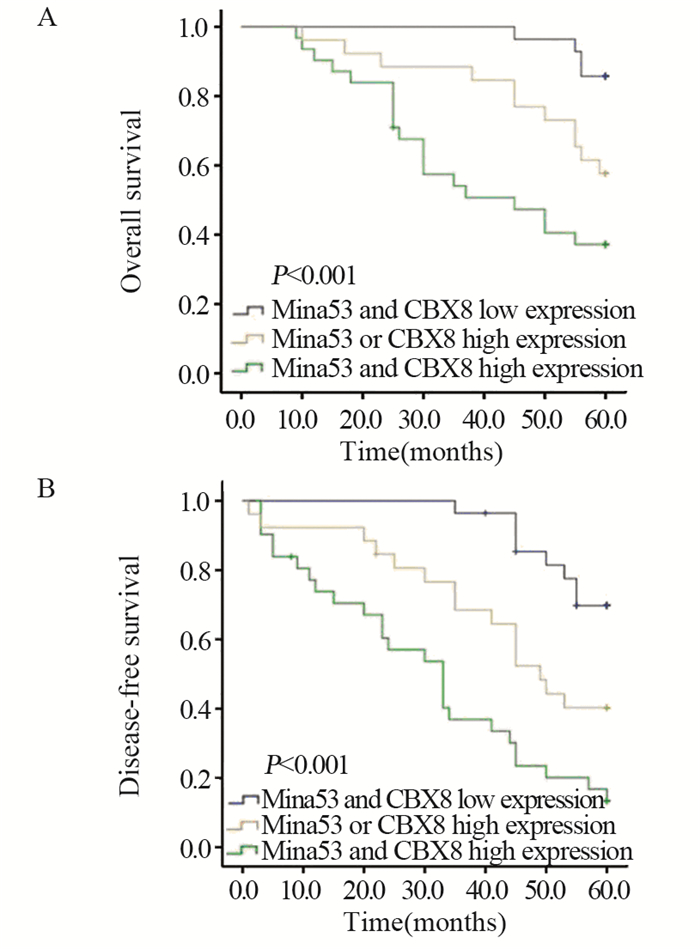
|
| 图 2 Mina53、CBX8表达水平与肝细胞肝癌患者总体生存时间(A)和无疾病生存时间(B)的关系 Figure 2 Correlation of Mina53 and CBX8 expressions with overall survival(A) and disease-free survival(B) of HCC patients |
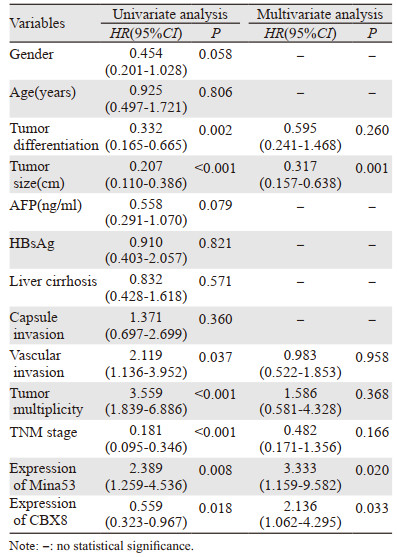
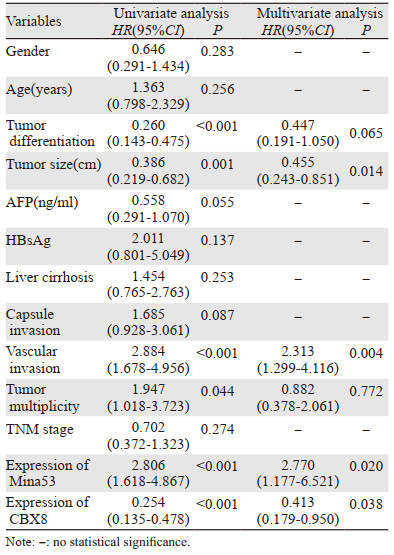
Cox单因素回归模型分析显示:病理分级、肿瘤大小、脉管侵犯、肿瘤多发性、TNM分期、Mina53、CBX8表达水平均为影响肝细胞肝癌患者OS的危险因素(均P < 0.05);病理分级、肿瘤大小、脉管侵犯、肿瘤多发性、Mina53表达水平、CBX8表达水平均为影响肝细胞肝癌患者DFS的危险因素(均P < 0.05)。进一步多因素分析显示:Mina53、CBX8表达水平及肿瘤大小是影响肝细胞癌患者OS的独立预后因素(均P < 0.05),Mina53及CBX8表达水平、肿瘤大小及脉管侵犯是影响肝细胞肝癌患者DFS的独立预后因素(均P < 0.05),见表 4~5。
|
|
肝细胞肝癌恶性程度高、起病隐匿、进展快,多数患者就诊时已处于中晚期,易失去手术机会,且肝细胞肝癌术后易复发转移,导致五年生存率较低,肝细胞肝癌的发生发展是一个多步骤、多阶段渐进演化的病理过程,涉及多种基因的异常表达和表观遗传学的改变,但其发病的确切分子机制尚不清楚。
Mina53是近几年发现的新基因,其编码蛋白的分子量为53 kDa,包含一个高度保守的JmjC结构域,呈β折叠结构,可能参与染色体重构的调节及组蛋白表观遗传学的调节过程[17-18]。近年来已有研究证实,Mina53可以调控肿瘤细胞增殖、凋亡及分化过程,其异常表达与多种肿瘤的发生和进展密切相关。Di Croce等在果蝇中发现PcG基因家族,CBX8作为PcG蛋白家族中的重要成员,具有高度保守性,可与RING1a/b、BMI1等蛋白分子组成多梳蛋白抑制复合体1(polycomb repressive complex1, PRC1),参与组蛋白甲基化、染色体重构等过程[4]。研究显示,CBX8蛋白在肿瘤组织中的异常表达与肿瘤的发生发展、侵袭转移及预后关系密切。
有研究发现Mina53在肾细胞癌、胰腺癌等多种肿瘤组织中表达升高,且其高表达与肿瘤分化、TNM分期和浸润深度有关[12-13]。Ogasawara等通过免疫组织化学检测发现,Mina53在肝细胞肝癌组织中表达升高,且与肿瘤大小、病理分级相关[19]。本研究结果显示,Mina53在肝细胞肝癌组织中的表达水平明显高于其相应癌旁相对正常组织。异常表达的Mina53蛋白主要分布在细胞核中,在肿瘤增殖能力强、分化程度差、有被膜侵犯和脉管侵犯且TNM分期晚的患者中Mina53的表达水平增高;有研究表明CBX8在肝细胞肝癌组织中的表达量明显升高且与肿瘤的大小、分化、分期及转移有关[20-21]。本研究发现CBX8主要表达于细胞核与胞质中,其在肿瘤组织中高表达与患者是否携带HBsAg、肿瘤大小、被膜侵犯、TNM分期相关。以上结果表明,Mina53和CBX8高表达可能促进肿瘤细胞的增殖及其对邻近正常组织的浸润侵袭,促进肿瘤的发生及发展。
Wang等通过免疫共沉淀结合蛋白质组学分析发现肺癌细胞中Mina53蛋白和PRC1复合物的亚基CBX8蛋白存在相互作用,Mina53可能通过CBX8蛋白的调控发挥其功能[22]。我们通过Spearman相关分析也证实肝细胞肝癌中Mina53和CBX8的表达呈正相关,且Mina53高表达的肝细胞肝癌患者中CBX8高表达者的比例更高,提示Mina53与CBX8在肝细胞肝癌进展过程中具有协同作用,共同促进肝肿瘤细胞的增殖及侵袭转移。
有研究表明,CBX8的表达水平与肿瘤患者的术后生存有关,且CBX8高表达往往提示患者预后不良,但结直肠癌中CBX8的高表达与患者预后良好有关[8, 21, 23]。在结肠癌、胰腺癌等多种肿瘤中Mina53高表达患者的术后生存期比低表达者更短[11, 13],而乳腺癌中Mina53高表达的淋巴结转移患者预后良好[14]。由此可见,Mina53与CBX8对不同肿瘤患者预后的影响有所差异。本研究发现,Mina53与CBX8均高表达患者的OS和DFS较Mina53或CBX8高表达者及两者均低表达者更短,提示Mina53与CBX8是影响肝细胞肝癌患者预后的重要因素。此外,Cox回归模型分析发现,Mina53、CBX8表达水平、肿瘤大小是影响患者OS和DFS的独立预后因素。以上结果表明,Mina53和CBX8的表达水平与肝细胞肝癌患者预后密切相关,两者协同高表达提示患者预后不良;Mina53和CBX8的联合应用对评估患者预后有重要意义,可作为预测肝细胞肝癌预后有效的生物标志物。
综上所述,Mina53和CBX8在肝细胞肝癌组织中高表达,两者在肝细胞肝癌中具有协同作用,可能促进肝细胞肝癌的发生发展和浸润转移。联合检测Mina53和CBX8有助于肝细胞肝癌的发生发展和预后判断,有望成为新的肝细胞肝癌分子治疗靶点。
作者贡献
叶冬雪:实验实施,采集、分析数据,起草文章
刘芬:实验实施,分析数据
杨茜:采集数据
付海洋:实验实施
周璇:获取研究经费,设计指导实验
项锋钢:设计实验,指导、修改论文
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7-30. DOI:10.3322/caac.21442 |
| [2] |
Lim C, Dejong CH, Farges O. Improving the quality of liver resection: a systematic review and critical analysis of the available prognostic models[J]. HPB (Oxford), 2015, 17(3): 209-221. DOI:10.1111/hpb.12346 |
| [3] |
Hartke J, Johnson M, Ghabril M. The diagnosis and treatment of hepatocellular carcinoma[J]. Semin Diagn Pathol, 2017, 34(2): 153-159. DOI:10.1053/j.semdp.2016.12.011 |
| [4] |
Di Croce L, Helin K. Transcriptional regulation by Polycomb group proteins[J]. Nat Struct Mol Biol, 2013, 20(10): 1147-1155. DOI:10.1038/nsmb.2669 |
| [5] |
Song X, Tang T, Li C, et al. CBX8 and CD96 Are Important Prognostic Biomarkers of Colorectal Cancer[J]. Med Sci Monit, 2018, 24: 7820-7827. DOI:10.12659/MSM.908656 |
| [6] |
Yuan GJ, Chen X, Lu J, et al. Chromobox homolog 8 is a predictor of muscle invasive bladder cancer and promotes cell proliferation by repressing the p53 pathway[J]. Cancer Sci, 2017, 108(11): 2166-2175. DOI:10.1111/cas.13383 |
| [7] |
Zhang L, Zhou Y, Cheng C, et al. Genomic analyses reveal mutational signatures and frequently altered genes in esophageal squamous cell carcinoma[J]. Am J Hum Genet, 2015, 96(4): 597-611. DOI:10.1016/j.ajhg.2015.02.017 |
| [8] |
Tang B, Tian Y, Liao Y, et al. CBX8 exhibits oncogenic properties and serves as a prognostic factor in hepatocellular carcinoma[J]. Cell Death Dis, 2019, 10(2): 52. DOI:10.1038/s41419-018-1288-0 |
| [9] |
Makoto T, Yoshiro K, Mikiko S, et al. A novel myc target gene, mina53, that is involved in cell proliferation[J]. J Biol Chem, 2002, 277(38): 35450-35459. DOI:10.1074/jbc.M204458200 |
| [10] |
Chitra T, Fei C. Current understanding of mdig/MINA in human cancers[J]. Genes Cancer, 2015, 6(7-8): 288-302. |
| [11] |
Fujino S, Kinugasa T, Sudo T, et al. Mina53 nuclear localization is an important indicator of prognosis in patients with colorectal cancer after adjuvant chemotherapy[J]. Oncol Rep, 2018, 40(1): 101-110. |
| [12] |
Ferreira MJ, Pires-Luís AS, Vieira-Coimbra M, et al. SETDB2 and RIOX2 are differentially expressed among renal cell tumor subtypes, associating with prognosis and metastization[J]. Epigenetics, 2017, 12(12): 1057-1064. DOI:10.1080/15592294.2017.1385685 |
| [13] |
Kumar SA, Thakur C, Li L, et al. Pathological and prognostic role of mdig in pancreatic cancer[J]. Genes Cancer, 2017, 8(7-8): 650-658. |
| [14] |
Thakur C, Lu YJ, Sun JY, et al. Increased expression of mdig predicts poorer survival of the breast cancer patients[J]. Gene, 2014, 535(2): 218-224. DOI:10.1016/j.gene.2013.11.031 |
| [15] |
Zhou LX, Zhang T, Zhu Q, et al. Mina53 regulates the differentiation and proliferation of leukemia cells[J]. Hematol Oncol, 2019, 37(4): 513-515. DOI:10.1002/hon.2621 |
| [16] |
Luo W, Zhu XN, Liu W, et al. MYC associated zinc finger protein promotes the invasion and metastasis of hepatocellular carcinoma by inducing epithelial mesenchymal transition[J]. Oncotarget, 2016, 7(52): 86420-86432. DOI:10.18632/oncotarget.13416 |
| [17] |
Accari SL, Fisher PR. Emerging Roles of JmjC Domain-Containing Proteins[J]. Int Rev Cell Mol Biol, 2015, 319: 165-220. DOI:10.1016/bs.ircmb.2015.07.003 |
| [18] |
Cao PL, Kumagai N, Inoue T, et al. JmjC Domain-Encoding Genes Are Conserved in Highly Regenerative Metazoans and Are Associated with Planarian Whole-Body Regeneration[J]. Genome Biol Evol, 2019, 11(2): 552-564. DOI:10.1093/gbe/evz021 |
| [19] |
Ogasawara S, Komuta M, Nakashima O, et al. Accelerated expression of a Myc target gene Mina53 in aggressive hepatocellular carcinoma[J]. Hepatol Res, 2010, 40(3): 330-336. DOI:10.1111/j.1872-034X.2009.00604.x |
| [20] |
Zhang CZ, Chen SL, Wang CH, et al. CBX8 Exhibits Oncogenic Activity via AKT/beta-Catenin Activation in Hepatocellular Carcinoma[J]. Cancer Res, 2018, 78(1): 51-63. |
| [21] |
Xiao LS, Zhou ZX, Li WW, et al. Chromobox homolog 8 (CBX8) Interacts with Y-Box binding protein 1 (YBX1) to promote cellular proliferation in hepatocellular carcinoma cells[J]. Aging (Albany NY), 2019, 11(17): 7123-7149. |
| [22] |
Wang W, Lu Y, Stemmer PM, et al. The proteomic investigation reveals interaction of mdig protein with the machinery of DNA double-strand break repair[J]. Oncotarget, 2015, 6(29): 28269-28281. DOI:10.18632/oncotarget.4961 |
| [23] |
Yang SB, Liu WH, Li MY, et al. Insulin-Like Growth Factor-1 Modulates Polycomb Cbx8 Expression and Inhibits Colon Cancer Cell Apoptosis[J]. Cell Biochem Biophys, 2015, 71(3): 1503-1507. DOI:10.1007/s12013-014-0373-y |
 2020, Vol. 47
2020, Vol. 47


