文章信息
- ZEB1-AS1在子宫内膜癌中的表达及其与临床病理特征的关系
- Expression of ZEB1-AS1 Expression in Endometrial Carcinoma and Its Correlation with Clinicopathological Features
- 肿瘤防治研究, 2020, 47(6): 457-461
- Cancer Research on Prevention and Treatment, 2020, 47(6): 457-461
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1336
- 收稿日期: 2019-10-28
- 修回日期: 2020-02-06
2. 450000 郑州,郑州市第一人民医院妇科
2. Department of Gynecology, Zhengzhou First People's Hospital, Zhengzhou 450000, China
子宫内膜癌(endometrial cancer, EC)是常见的妇科恶性肿瘤之一,发病率呈逐年递增趋势[1]。EC主要通过手术治疗,辅以放疗和化疗,但是越来越多的EC患者出现化疗耐药情况[2]。长链非编码RNA(long non-coding RNAs, lncRNAs)在肿瘤发生和发展过程中起到重要作用,如lncRNA HOTAIR高表达能够促进EC侵袭和转移[3]。ZEB1-AS1与结直肠癌、胃癌和黑色素瘤等多种肿瘤的发生发展有关[4-6],但是既往鲜有其在EC中的报道,本研究旨在分析EC中ZEB1-AS1的表达及其与临床病理特征的关系,以期揭示其在EC发生和发展中所起的作用。
1 资料与方法 1.1 临床组织标本收集2010年1月—2016年12月郑州大学第三附属医院医院病理科的195对子宫内膜癌-癌旁正常组织标本。所有患者手术前均未接受放疗或化疗,平均年龄56.7±11.6岁,课题组每6月进行一次电话随访,随访截至2019年1月,最长随访95月,最短1月,中位随访时间为32月。患者相互之间无亲缘关系。
1.2 实时荧光定量PCR使用ABI 7900HT型PCR仪,Master Mix为美国ABI公司配套试剂, 并严格按照说明书配置相关反应体系,2-ΔΔCt法分析qRT-PCR结果;GAPDH作为内参;肿瘤组织相对表达量大于等于中位数(中位数=0.007)为高表达,反之为低表达。
1.3 细胞与试剂EC细胞系Ishikawa购自中国科学院上海细胞库。使用含10%FBS的DMEM培养基(深圳市百恩维生物科技有限公司),37℃、5%CO2饱和湿度条件下进行培养。细胞裂解液TRIzol购自美国Invitrogen公司,反转录试剂盒购自日本TaKaRa公司。胎牛血清购自上海逍鹏生物科技有限公司;ZEB1-AS1过表达质粒购自上海吉凯基因科技有限公司,转染试剂Lipofectamine 3000购自美国Life Technologies公司;引物于生工生物工程(上海)股份有限公司合成。
1.4 稳转细胞系筛选选取过表达ZEB1-AS1的EC细胞。转染试剂为Lipofectamine 3000(Invitrogen),操作步骤严格按照说明书进行。
1.5 MTT实验消化重悬对数生长期细胞,按200个细胞/孔浓度接种于96孔板中,每组设置5个平行实验孔,同时接种5个相同的96孔板用于不同时间点检测(0、12、24、36和48 h)。按试剂说明书配置溶液,加入DMSO 2 h后于450 nm波长下检测其吸光度值(OD)。
1.6 Transwell实验采用Transwell迁移和侵袭实验检测ZEB1-AS1过表达后对EC细胞迁移和侵袭能力的影响。细胞融合度达到70%~80%时接种于8 μm孔径的小室中,每孔3×104个细胞,每组设置4个复孔。待接种48 h后使用甲醛固定、0.1%结晶紫染液染色,使用倒置相差显微镜随机选取5个视野拍照、计数。
侵袭实验操作步骤同迁移实验,但小室为预先铺设基质胶。
1.7 统计学方法使用SPSS20.0软件对数据进行统计分析,采用配对t检验分析癌组织和对应癌旁正常组织中ZEB1-AS1表达水平的差异,采用χ2检验和独立样本t检验分析不同EC患者临床特征及疾病进展中ZEB1-AS1表达水平的差异,采用K-M法绘制生存曲线,Log rank检验不同组患者生存时间的差异。独立t检验分析细胞迁移和侵袭能力差异;采用重复测量的方差分析方法分析MTT实验中细胞增殖能力的差异。所有检验均为双侧检验,α=0.05,P < 0.05为差异有统计学意义。
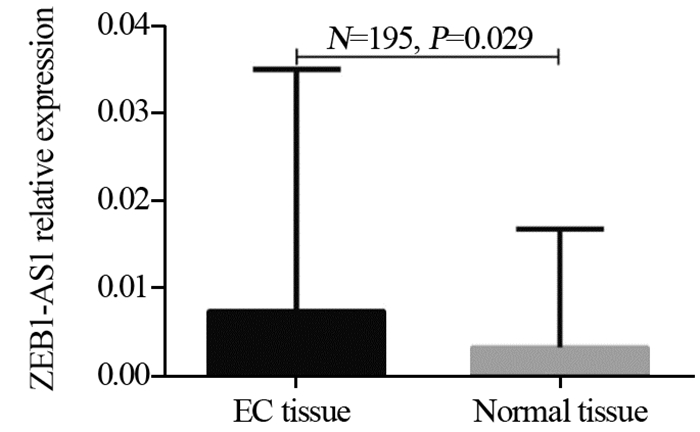
2 结果 2.1 ZEB1-AS1在EC组织中的表达ZEB1-AS1在EC组织中的表达量显著高于癌旁正常组织(0.0074±0.0276 vs. 0.0033±0.0135, P=0.029),见图 1。
|
| EC: endometrial cancer 图 1 子宫内膜癌和癌旁正常组织中ZEB1-AS的表达 Figure 1 Expression of ZEB1-AS in endometrial cancer and adjacent normal tissues |
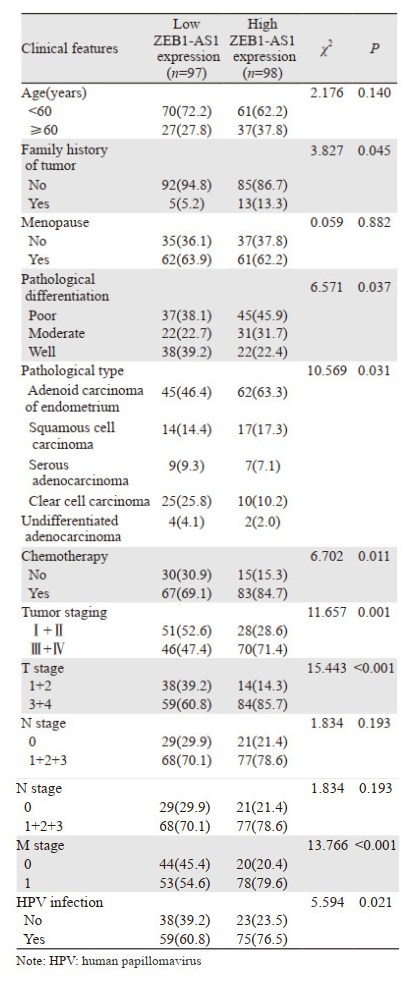
ZEB1-AS1表达水平(将肿瘤组织中ZEB1-AS1相对表达量中位数及以上的分为高表达组,反之为低表达组)与EC患者家族肿瘤史、病理分级、病理分型、化疗、肿瘤分期、T分期、M分期和HPV感染相关(均P < 0.05),见表 1。
|
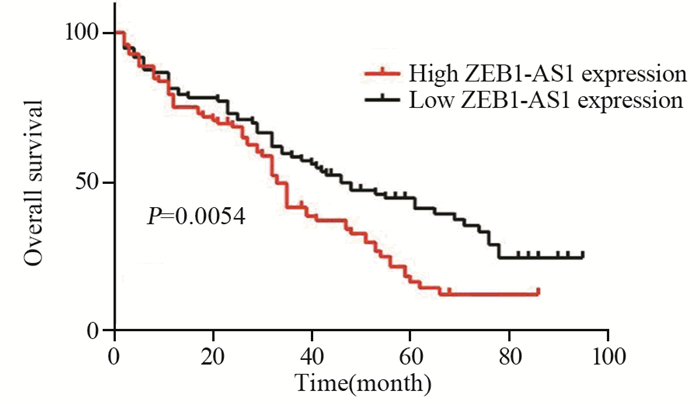
ZEB1-AS1低表达组中位生存时间为46月,高表达组中位生存时间为33月,ZEB1-AS1高表达组OS明显低于ZEB1-AS1低表达组(χ2=7.736, P=0.0054),见图 2。
|
| 图 2 ZEB1-AS1的表达与EC患者生存期的关系 Figure 2 Relation between ZEB1-AS1 expression and survival of EC patients |
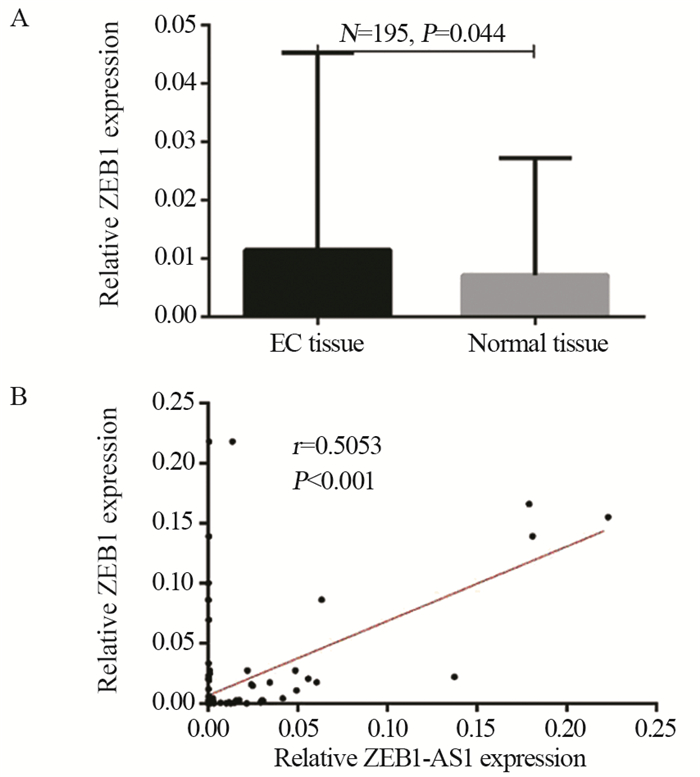
ZEB1在EC组织中的表达量显著高于癌旁正常组织(0.0115±0.0338 vs. 0.0071±0.0200, P=0.044),见图 3A。EC组织中ZEB1-AS1相对表达量与ZEB1相对表达量呈正相关(r=0.505, P < 0.001),见图 3B。
|
| 图 3 ZEB1在EC组织中的表达(A)及其与ZEB1-AS1表达的关系(B) Figure 3 ZEB1 expression in EC tissues(A) and its correlation with ZEB1-AS1 expression(B) |
将肿瘤组织中ZEB1相对表达量中位数及以上的分为高表达组,反之为低表达组。ZEB1表达水平与EC患者家族肿瘤史、病理分级、肿瘤分期、T分期、N分期和M分期相关(P < 0.05),见表 2。
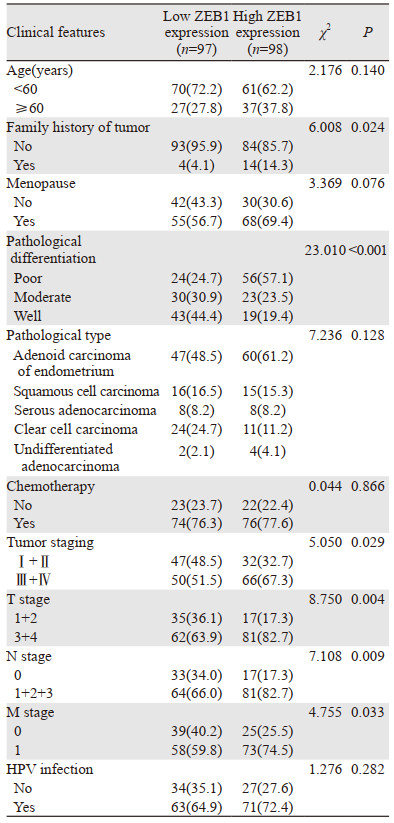
|
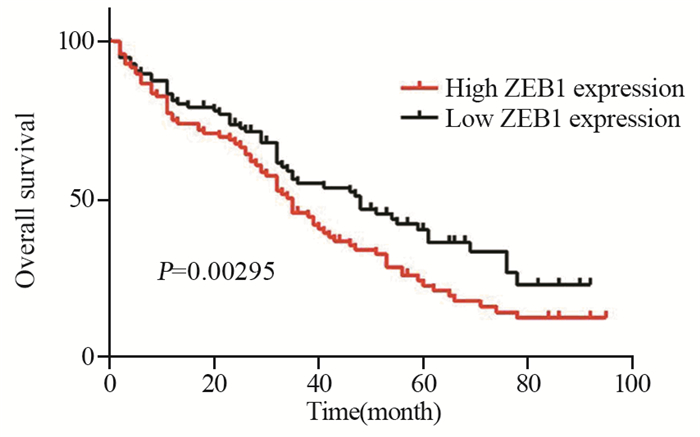
ZEB1低表达组中位生存时间为48月,高表达组中位生存时间为35月,ZEB1高表达组OS明显低于ZEB1低表达组(χ2=4.736, P=0.00295),见图 4。
|
| 图 4 ZEB1的表达与EC患者生存期的关系 Figure 4 Relation between ZEB1 expression and survival of EC patients |
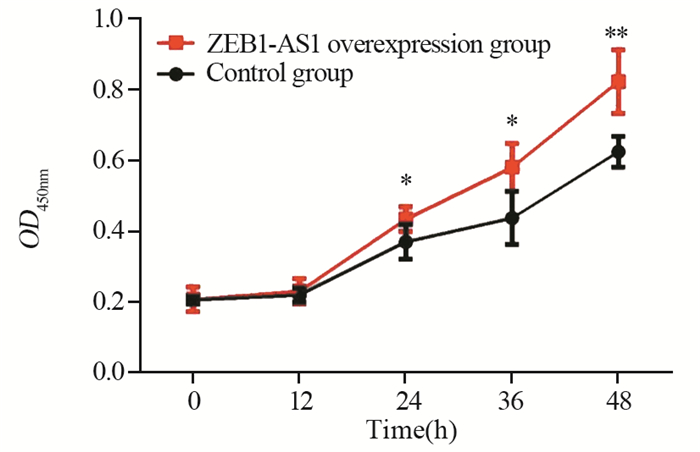
当细胞增殖24 h以后,过表达细胞系增殖能力明显较对照细胞系强。转染24、36和48 h时表达组OD值分别为0.435±0.035、0.581±0.068、0.824±0.090,均高于对照组0.370±0.049、0.438±0.075、0.625±0.043(P=0.044、0.013、0.002),见图 5。结果表明ZEB1-AS1能够明显促进EC细胞的增殖。
|
| *: P < 0.05, **: P < 0.01, ZEB1-AS1 overexpression group vs. control group 图 5 ZEB1-AS1的表达对EC细胞增殖的影响 Figure 5 Effect of ZEB1-AS1 expression on proliferation of EC cells |
过表达组EC细胞迁移能力明显较对照细胞强(74.2±6.4 vs. 52.1±11.6, P < 0.001),见图 6。

|
| 图 6 ZEB1-AS1的表达对EC细胞迁移能力的影响(×200)) Figure 6 Effect of ZEB1-AS1 expression on migration of EC cells (×200) |
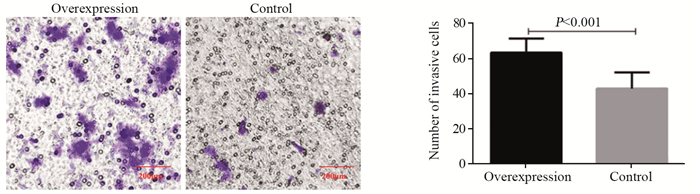
过表达组EC细胞侵袭能力明显较对照细胞强(61.4±8.2 vs. 45.1±8. 1, P < 0.001),见图 7。
|
| 图 7 ZEB1-AS1的表达对EC细胞侵袭能力的影响(×200) Figure 7 Effect of ZEB1-AS1 expression on invasion of EC cells (×200) |
雌激素水平、月经初潮时间、绝经时间等是EC的危险因素[7]。EC的治疗以手术为主,放疗和化疗为辅,但治疗效果和患者预后不尽如人意[8]。已有研究表明,lncRNAs在肺癌、肝癌、乳腺癌、结直肠癌、胃癌等多种肿瘤的发生和发展中发挥抑癌基因或者促癌基因的作用[9]。Wang等[10]研究发现ZEB1-AS1在黑色素瘤中高表达,且与不良预后相关;Ma等[11]报道ZEB1-AS1通过与miRNA形成ceRNA网络使胃癌不良预后。ZEB1-AS1在结直肠癌、胃癌和黑色素瘤等多种肿瘤中发挥促癌作用[4-6],但是既往鲜有其在EC中所起作用的报道。
本研究发现,ZEB1-AS1在EC组织中的表达量显著高于对应癌旁正常组织,且ZEB1-AS1高表达与EC患者家族肿瘤史、病理分级、肿瘤分期、化疗、TNM分期相关,ZEB1-AS1高表达使EC患者生存期缩短,提示ZEB1-AS1在EC发生和发展过程中发挥促癌基因的作用。李晓丽等[12]也发现ZEB1-AS1的表达与HPV感染和化疗相关。本研究进一步通过慢病毒稳转细胞系检测过表达ZEB1-AS1对EC细胞系增殖、迁移和侵袭能力的影响,发现ZEB1-AS1高表达能够促进EC细胞系增殖、迁移和侵袭,提示ZEB1-AS1能够促进EC细胞生长、转移和侵袭。目前对于lncRNA的研究多集中于其与对应天然翻译转录基因的调控作用。Li等[13]研究发现ZEB1-AS1在肝癌中通过与其靶基因ZEB1相互作用促进肝癌恶化,并预示肝癌患者不良预后。本研究发现ZEB1在EC中表达上调,且其相对表达量与ZEB1-AS1相对表达量成正相关,提示在EC中ZEB1-AS1可对ZEB1产生调控作用。但是本研究并未对ZEB1-AS1调控ZEB1的机制进行深入探讨,这是本研究的局限性之一。
张春云等[14]研究发现ZEB1在子宫内膜异位症患者中表达上调。Peng等[15]研究发现抑制ZEB1能够让KRAS突变的癌症对MEK抑制剂更加敏感。通过分析ZEB1相对表达量与EC患者临床特征的关系发现家族肿瘤史、病理分级、肿瘤分期、T分期、N分期和M分期相关,且ZEB1高表达也使EC患者生存期缩短,提示ZEB1在EC发生和发展过程中亦发挥促癌基因的作用,这与既往研究结果相似。
本研究发现ZEB1-AS1通过调控ZEB1在EC中的表达,对EC的发生和发展产生调控作用,但尚未能进一步解释其调控的分子机制,是本研究的不足之处。但仍可证实ZEB1-AS1和ZEB1可作为EC治疗潜在的生物靶标。
作者贡献
宋娇:设计并完成实验及文章的撰写
王利:统计学分析、文章的撰写及修改
| [1] |
马新, 谢虹, 黄海伟. 子宫内膜癌及癌前病变的流行病学调查及其危险因素分析[J]. 中国妇幼保健, 2016, 31(17): 3572-3574. [Ma X, Xie H, Huang HW. Epidemiological investigation and risk factors analysis of endometrial cancer and precancerous lesions[J]. Zhongguo Fu You Bao Jian, 2016, 31(17): 3572-3574.] |
| [2] |
余昌, 岳成山, 王会霞, 等. Ⅲ期子宫内膜癌患者调强放疗联合化疗治疗的疗效及不良反应分析[J]. 实用癌症杂志, 2019, 34(1): 145-147. [Xu C, Yu CS, Wang HX, et al. Clinical Efficacy and Adverse Reactions of Patients with Stage Ⅲ Endometrial Cancer with TP Chemotherapy Combined with Intensity Modulated Radiation Therapy[J]. Shi Yong Ai Zheng Za Zhi, 2019, 34(1): 145-147.] |
| [3] |
Zhou YX, Wang C, Mao LW, et al. Long noncoding RNA HOTAIR mediates the estrogen-induced metastasis of endometrial cancer cells via the miR-646/NPM1 axis[J]. Am J Cell Physiol, 2018, 314(6): C690-C701. |
| [4] |
Li Y, Wen X, Wang L, et al. LncRNA ZEB1-AS1 predicts unfavorable prognosis in gastric cancer[J]. Surg Oncol, 2017, 26(4): 527-534. |
| [5] |
Xiong WC, Han N, Wu N, et al. Interplay between long noncoding RNA ZEB1-AS1 and miR-101/ZEB1 axis regulates proliferation and migration of colorectal cancer cells[J]. Am J Transl Res, 2018, 10(2): 605-617. |
| [6] |
Siena ÁDD, Plaça JR, Araújo LF, et al. Whole transcriptome analysis reveals correlation of long noncoding RNA ZEB1-AS1 with invasive profile in melanoma[J]. Sci Rep, 2019, 9(1): 11350. |
| [7] |
Taoussi N, Alghamdi A, Futyma K, et al. Biological markers with potential clinical value in endometrial cancer - Review of the literature[J]. Ginekol Pol, 2017, 88(6): 331-336. |
| [8] |
邢永新. 化疗干预子宫内膜癌患者血清肿瘤标志物及癌组织中hmga2的表达及意义[J]. 中国老年学杂志, 2019, 39(2): 289-291. [Xing YX. The expression and significance of HMGA 2 in serum tumor markers and cancer tissues of patients with endometrial cancer treated by chemotherapy[J]. Zhongguo Lao Nian Xue Za Zhi, 2019, 39(2): 289-291.] |
| [9] |
Schmitt AM, Chang HY. Long noncoding rnas in cancer pathways[J]. Cancer Cell, 2016, 29(4): 452-463. |
| [10] |
Wang Q, Zhang R, Liu D. Long non-coding rna zeb1-as1 indicates poor prognosis and promotes melanoma progression through targeting mir-1224-5p[J]. Exp Ther Med, 2019, 17(1): 857-862. |
| [11] |
Ma MH, An JX, Zhang C, et al. Zeb1-as1 initiates a mirna-mediated cerna network to facilitate gastric cancer progression[J]. Cancer Cell Int, 2019, 19: 27. |
| [12] |
李晓丽, 胡陇娟. 子宫内膜癌组织中长链非编码RNA ZEB1-AS1的表达与临床特征及对化疗药物耐药性研究[J]. 现代检验医学杂志, 2019, 34(4): 35-39. [Li XL, Hu LJ. Research on Expression and Clinical Characteristics of Long-Chain Non-Coding RNA ZEB1-AS1 in Endometrial Carcinoma and Resistance to Chemotherapy Drugs[J]. Xian Dai Jian Yan Yi Xue Za Zhi, 2019, 34(4): 35-39.] |
| [13] |
Li T, Xie J, Shen C, et al. Upregulation of long noncoding rna zeb1-as1 promotes tumor metastasis and predicts poor prognosis in hepatocellular carcinoma[J]. Oncogene, 2016, 35(12): 1575-1584. |
| [14] |
张春云, 张永鹏. 子宫内膜异位症患者病变部位zeb1和zeb2表达水平[J]. 热带医学杂志, 2019, 19(1): 43-45. [Zhang CY, Zhang YP. Expression and clinical significance of ZEB1 and ZEB2 in lesions of endometriosis[J]. Re Dai Yi Xue Za Zhi, 2019, 19(1): 43-45.] |
| [15] |
Peng DH, Kundu ST, Fradette JJ, et al. Zeb1 suppression sensitizes kras mutant cancers to mek inhibition by an il17rd-dependent mechanism[J]. Sci Transl Med, 2019, 11(483). |
 2020, Vol. 47
2020, Vol. 47
