文章信息
- 3D打印模型辅助肩胛骨软骨肉瘤的地图形外科切除
- Partial Geographic Scapulectomy for Chondrosarcoma in Scapula with Assistance of 3D- printed Model
- 肿瘤防治研究, 2020, 47(5): 376-380
- Cancer Research on Prevention and Treatment, 2020, 47(5): 376-380
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1334
- 收稿日期: 2019-10-23
- 修回日期: 2020-03-21
肩胛骨部位的原发恶性肿瘤以软骨肉瘤较为常见[1],但由于原发于肩胛骨部位的恶性肿瘤本身非常罕见,文献中对于其外科治疗的报道并不多,全肩胛骨切除是一种比较常见的外科治疗方法[2],为了维持正常的肩关节功能,需要保留部分肩胛骨,这就需要进行肩胛骨部分切除手术。不是所有病例都适合行肩胛骨部分切除,因为肿瘤的完整切除是第一位的。如果为了保留肩关节功能而切除肿瘤不彻底,可能引起肿瘤复发,甚至出现远处转移。理想的情况是,不仅对肿瘤进行完整的切除,同时也保留了正常的肩胛骨,从而最大可能地保留了肩关节的功能,这就需要对肩胛骨肿瘤进行精确切除。
由于肩胛骨的三维结构,很难根据影像学检查做到精确的徒手外科切除。近些年,计算机导航辅助技术在骨肿瘤的精确切除中发挥越来越多的作用[3-6],但由于肩胛骨所处肩部解剖位置,受技术本身的限制,采用计算机导航辅助技术进行精确切除很难实现。本研究借助于近年来兴起的3D打印技术,结合计算机导航的术前计划技术,提供了一种术前计划和术中实施方案完成肩胛骨软骨肉瘤的地图形外科切除,获得了良好的效果。本研究旨在通过一组病例,对3D打印模型辅助肩胛骨软骨肉瘤的地图形外科切除技术进行描述,评估其精确性,并报告术后肿瘤学和功能的预后情况。
1 资料与方法 1.1 纳入与排除标准纳入标准:(1)2013年1月—2017年12月,于北京积水潭医院骨肿瘤科就诊的原发肩胛骨软骨肉瘤患者;(2)影像学符合软骨肉瘤诊断;(3)活检病理证实为原发软骨肉瘤,Broad 1~2级;(4)病灶位于肩胛体,未累及肩胛颈或肩盂。
排除标准:(1)到我院初诊时为复发患者;(2)术前穿刺病理为软骨肉瘤Broad 3~4级,或者其他肿瘤;(3)病灶位于肩胛颈或肩盂,或虽位于肩胛体但累及肩胛颈。
1.2 一般资料本研究共纳入6例患者,其中男3例、女3例,年龄18~49岁,平均38.5岁。发病时主要症状:疼痛4例,活动时不适2例。术前均接受穿刺活检,病理诊断为软骨肉瘤1~2级。
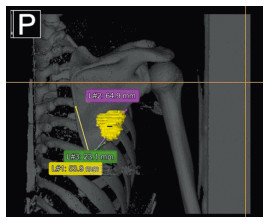
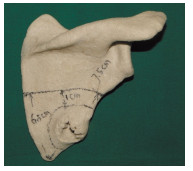
1.3 术前计划和术中实施穿刺活检前,6例患者均接受了增强CT检查(西门子Definition AS64排,扫描层厚0.625 mm),将CT原始数据导入计算机导航系统(Stryker导航系统,Freiburg, Germany; CT spine, version 1.6)。在计算机导航系统术前设计模块内,采用轴位断层二维图像,对肿瘤进行标记,通过计算机导航系统重建获得三维立体图像,见图 1。将含有标记肿瘤(不同颜色)的CT数据导入3D打印设备,打印出真实比例的肩胛骨(含肿瘤)模型。术前设计截骨边缘据肿瘤边缘1~2 cm,如果残留的肩胛骨内侧缘或外侧缘不足1 cm,则给予切除,据此勾画截骨线,见图 2。以肩胛骨下角、内侧缘和外侧缘作为解剖标记,标记截骨线距离解剖标记的距离。
|
| A 17-year-old female patient was diagnosed with gradeⅡchondrosarcoma of the right scapula. The three distances from the tumor to the subscapular angle were measured before operation. 图 1 计算机导航系统显示的三维肿瘤图像 Figure 1 Three-dimensional tumor image displayed by computer navigation system |
|
| On the 3D-printed model, the edge of the tumor was first delineated, the surgical margin was 1 cm. And finally the point of osteotomy was identified, which was 6.5 cm from the lower angle of the scapula at the inner scapular column and 7.5 cm from the lower angle of the scapular at the lower column of the scapular. 图 2 肿瘤3D打印模型 Figure 2 A 3D-printed model of the tumor |
术中以肩胛骨下角、内侧缘和外侧缘作为解剖标记,按照标记的距离解剖,用尺子徒手确定截骨线,并用磨钻完成截骨。
1.4 评价指标徒手切除的精确性评估:对每个病例的手术切缘进行评估,测量术前计划的切缘和实际手术获得的切缘,对两者进行比较。对于每个病例,在不同方向上共取3对切缘。
肿瘤学评估:术后即刻进行外科边界评估,在随访期内,记录肿瘤局部复发和远处转移,作为肿瘤学评价指标。
功能学评估:对肢体功能采用Neer肩关节功能评分[7]和MSTS上肢功能评分[8]进行评估。
1.5 统计学方法采用SPSS22.0软件进行统计分析,符合正态分布的以均数±标准差表示。术前计划和徒手截骨线的比较,采用配对样本t检验,检验水准为a=0.05。
2 结果 2.1 手术结果所有患者均按照计划完成术前计划后实施手术,所有患者术后疼痛和不适均消失。在计算机导航设备上进行术前计划时间20~60 min,平均31.7 min。手术时间70~150 min,平均125 min。术中出血量100~200 ml,平均121.7 ml。所有患者均未出现切口感染和其他需要再次手术干预的并发症。
2.2 切除精确性术前计划切缘21.0±8.1mm,实际手术获得切缘22.0±6.6 mm,两者匹配差值为1.0±5.3 mm,95%CI为-1.7~3.7 mm,差异无统计学意义(t=-0.795, P=0.437)。
2.3 肿瘤学评估所有患者的外科切缘经病理学评估均为广泛,见图 3。所有患者均获得随访,随访时间19~79月,平均51.6月。每次随访项目包括:X线片和增强CT(三维重建,见图 4)、局部B型超声和胸部CT。至最后一次随访,未发现局部复发和远处转移病例。

|
| Post-operative axial and sagital sections of the specimens suggested wide margin was achieved in this case. 图 3 术后肿瘤标本剖面 Figure 3 Section of postoperative tumor specimen |

|
| In one case, the 3D-reconstruction CT after surgery could clearly show the extent of resection. The inner part of the scapular column and the relevant muscle attachments were preserved to ensure the stability of the scapular. 图 4 术后复查三维重建CT Figure 4 Three-dimensional reconstruction CT during postoperative follow-up |
所有患者在随访时未出现肩胛骨外形异常(如翼状肩胛)。Neer肩关节功能评分96~100分,平均98.2分。所有患者在疼痛、功能和解剖这3个分项上均获得满分,运动范围(满分25分)评分为21~25分,平均23.2分。MSTS功能评分97%~100%,平均99%。
3 讨论软骨肉瘤是第二常见的原发性恶性骨肿瘤,约占所有原发性恶性骨肿瘤的10%~20%[9-10]。软骨肉瘤通常发生在骨盆和股骨。据报道,起源于肩胛骨的软骨肉瘤约占所有软骨肉瘤病例的6%~8%[10]。软骨肉瘤的发生率男性高于女性,少见于儿童患者,常见于40~70岁的患者。
基于肿瘤学的要求,对于肩胛骨的软骨肉瘤,一般要求达到广泛切缘。对于低度恶性软骨肉瘤,手术治疗几乎是唯一有效的治疗方式,放疗和化疗都证实对预后没有提高,即使是病理级别高的软骨肉瘤,也未能证实患者可以从化疗中获益。但退分化软骨肉瘤和间叶性软骨肉瘤需要考虑辅助和(或)新辅助化疗。
Enneking等[11]对肩胛骨解剖部位进行了分区,将肩胛骨分为S1和S2。S1包含肩胛切迹沿肩胛颈向下以内的靠近脊柱的部分,是肩胛骨的主体部分,而S2包含肩胛切迹沿肩胛颈向下远离脊柱的部分,包括了肩胛盂、喙突和肩峰。Enneking系统将肩胛骨划分为区域对于计划切除和重建是有帮助的,但到目前为止,还没有证据证实两个分区部位的治疗预后有差异。本研究的手术方法选择了仅累及S1部分的肿瘤病例,原因是如果肿瘤涉及到S2,不能通过简易的距离测定来设计外科切缘,而是要通过三维设计来完成肿瘤的彻底切除。而且笔者认为,肿瘤累及S1范围较大,需要行S1全部切除才能获取安全外科边界的情况并不适合行肩胛骨部分切除,建议行肩胛骨全部切除,原因是缺乏包括斜方肌、肩胛提肌、大小菱形肌、前锯肌和上后锯肌的肩胛骨并不稳定,肩关节的运动可能会导致翼状肩胛或者肩关节不稳定。本研究中,所有病例都保留了部分S1,这就保证了肩胛骨的正常解剖位置,进而为肩关节良好的功能提供解剖基础。因此,建议“3D打印模型辅助肩胛骨软骨肉瘤的地图形外科切除”的手术适应证包括:(1)病理检验结果证实为低度恶性肿瘤,或高度恶性化疗效果好的;(2)肿瘤位于肩胛骨S1区;(3)手术设计完整切除肿瘤后仍然能够保留部分S1的。
迄今为止,最大的肩胛骨软骨肉瘤病例分析来自于Mayo[12], 报道了47例,其解剖部位包括S1和S2及两者都累及,其中仅S2累及的为11例,占23%;仅S1累及的为26例,占55%;19例(73%)行部分肩胛骨切除术,7例(27%)行全肩胛骨切除术。而该组病例总的局部复发率高达40.4%。Schneiderbauer等[12]分析肿瘤的局部复发主要是由于切除外科边界不足,一方面,肩胛骨三维解剖结构复杂,临近重要的上肢血管和神经,另一方面,外科医生本身存在侥幸心理,希望通过保留更多的肩胛骨来保留肩关节功能。本研究采用计算机导航辅助外科计划,设计外科边界至少1 cm,最终未见复发病例。因此,手术的注意事项包括:(1)明确肿瘤范围,可通过CT和MRI两种检查相互验证;(2)做好术前计划,设计充分的外科切除边界;(3)手术应严格执行术前计划,保证充分的骨外科边界;(4)术中应同时注意给予充分的软组织边界。目前我们采用该手术方式的均为肩胛骨低度恶性肿瘤,未来可以选择高度恶性肿瘤但化疗效果好的病例。文献中尚无采用该方法治疗肩胛骨肿瘤的报道。
在临床上,尽管医生术前设计了安全的外科边界,但由于术中操作及误差问题,可能并不能达到安全的外科边界,即所谓的骨肿瘤外科切除精确度问题。Cartiaux进行一个实验研究[13],研究由4个有经验的骨肿瘤外科医生在3D打印的骨盆上进行肿瘤切除术,该模拟手术设定外科边界为1 cm,最终研究发现所有切除边缘在5 mm误差范围内的比例只有52%(95%CI: 37%~67%),而且宿主移植重建的匹配程度证实很差。该研究认为:即使是非常有经验的外科医生,并在非常理想的工作条件下,由于骨盆的三维结构比较复杂,进行肿瘤的理想外科切除和重建仍然非常困难。最终为了达到安全的外科边界,可以增大外科边界设定(如增加到3~5 cm)或者采用计算机导航辅助。
本研究中,并未采用计算机导航辅助下肩胛骨肿瘤切除,原因主要是在肩胛骨部位进行计算机导航注册有一定的困难。故采用在计算机导航系统工作站上设计,获得数据后徒手操作,最终误差在可接受范围内(95%CI: -1.7~3.7 mm),这与术中利用好解剖标记点和与术前设计一致的截骨线有关。但对于比较复杂的部位,徒手操作范围误差也可能很大,有报道半侧干骺端的切除匹配误差问题[13],由医生在尸体骨骼上进行操作,发现徒手的平均误差为9 mm,而采用计算机设计的一个模具进行截骨,平均误差仅2 mm。
对于肩胛骨软骨肉瘤的预后,文献报道存在争议。大多数文献报道的病例数比较多,但没有特别评估肩胛骨部位的预后。Schneiderbauer等[12]报道47例肩胛骨软骨肉瘤的转移率为21.3%,因此认为比其他部位特别是肢体的软骨肉瘤预后要差。但Pant等[14]报道29例肩胛骨软骨肉瘤患者,5年局部复发率为14%,生存率为83%,与其他部位软骨肉瘤并没有显著差异。
肩胛骨软骨肉瘤患者远期生存率与肿瘤分级有关,一般认为病理分级为3级的预后比1级或2级的患者差。Lee等[15]报告227例软骨肉瘤患者的预后,显示病理分级为1~2级的患者与3级肿瘤患者死亡率有显著差异(17% vs. 26%),研究还显示手术切缘不足、局部复发和转移与最后死亡都存在明显的相关关系。在临床上,肩胛骨低度恶性软骨肉瘤的恶性潜能可能会被低估,文献报道有些病例是采取囊内刮除,复发率较高,而局部复发往往伴随病理级别升高,增加远处转移风险。因此,为了提高肩胛骨软骨肉瘤患者的长期生存率,广泛的外科边界是降低复发率的关键。在本研究中,随访平均51.6月,没有出现局部复发,这是最终患者都获得无瘤存活的关键。
总之,软骨肉瘤仍然以外科治疗为主,而外科治疗的关键是外科边界,本研究提供了一种可以更精确切除肩胛骨部位恶性肿瘤的方法,也可以为其他骨肿瘤的精确切除提供参考,但由于病例数量有限,还需要更多病例的随访资料获得数据支持。至于肩胛骨高级别软骨肉瘤是否也适用于该方法,值得进一步研究证实。
作者贡献
徐海荣:采集临床数据、图像及撰写文章
李远:临床数据分析、修改文章
单华超:随访患者、修改文章
牛晓辉:文章总体构思及修改文章
| [1] |
Priemel MH, Erler JME, Zustin J, et al. Histological, epidemiological and anatomical analysis of 193 bone tumours of the scapula[J]. J Bone Oncol, 2019, 18: 100258. DOI:10.1016/j.jbo.2019.100258 |
| [2] |
Mayil Vahanan N, Mohanlal P, Bose JC, et al. The functional and oncological results after scapulectomy for scapular tumours: 2-16-year results[J]. Int Orthop, 2007, 31(6): 831-836. DOI:10.1007/s00264-006-0261-1 |
| [3] |
Yang YK, Chan CM, Zhang Q, et al. Computer Navigation-aided Resection of Sacral Chordomas[J]. Chin Med J (Engl), 2016, 129(2): 162-168. DOI:10.4103/0366-6999.173465 |
| [4] |
Laitinen M, Parry MC, Albergo JI, et al. Is computer navigation when used in the surgery of iliosacral pelvic bone tumours safer for the patient?[J]. Bone Joint J, 2017, 99-B(2): 261-266. DOI:10.1302/0301-620X.99B2.BJJ-2016-0149.R2 |
| [5] |
Mori K, Neo M, Takemoto M, et al. Navigated Pin-Point Approach to Osteoid Osteoma Adjacent to the Facet Joint of Spine[J]. Asian Spine J, 2016, 10(1): 158-163. DOI:10.4184/asj.2016.10.1.158 |
| [6] |
Bosma SE, Wong KC, Paul L, et al. A Cadaveric Comparative Study on the Surgical Accuracy of Freehand, Computer Navigation, and Patient-Specific Instruments in Joint-Preserving Bone Tumor Resections[J]. Sarcoma, 2018, 2018: 4065846. |
| [7] |
Neer CS. THE CLASSIC Displaced Proximal Humeral Fractures[J]. Clin Orthop Related Res, 2006, 442: 77-82. DOI:10.1097/01.blo.0000198718.91223.ca |
| [8] |
Enneking W, Spanier SS, Goodman MA. A system for the surgical staging of musculoskeletal sarcoma.1980[J]. Clin Orthop Relat Res, 2003, 415153: 4-18. |
| [9] |
Fromm J, Klein A, Baur-Melnyk A, et al. Survival and prognostic factors in conventional G1 chondrosarcoma[J]. World J Surg Oncol, 2019, 17(1): 155. DOI:10.1186/s12957-019-1695-4 |
| [10] |
Niu X, Xu H, Inwards CY, et al. Primary Bone Tumors: Epidemiologic Comparison of 9200 Patients Treated at Beijing Ji Shui Tan Hospital, Beijing, China, With 10 165 Patients at Mayo Clinic, Rochester, Minnesota[J]. Arch Pathol Lab Med, 2015, 139(9): 1149-1155. DOI:10.5858/arpa.2014-0432-OA |
| [11] |
Enneking W, Dunham W, Gebhardt M, et al. A system for the classification of skeletal resections[J]. Chir Organi Mov, 1990, 75(1 Suppl): 217-240. |
| [12] |
Schneiderbauer MM, Blanchard C, Gullerud R, et al. Scapular Chondrosarcomas Have High Rates of Local Recurrence and Metastasis[J]. Clin Orthop Relat Res, 2004, 426: 232-238. DOI:10.1097/01.blo.0000136905.44818.65 |
| [13] |
Khan F, Pearle A, Lightcap C, et al. Haptic Robot-assisted Surgery Improves Accuracy of Wide Resection of Bone Tumors: A Pilot Study[J]. Clin Orthop Relat Res, 2013, 471(3): 851-859. DOI:10.1007/s11999-012-2529-7 |
| [14] |
Pant R, Yasko AW, Lewis VO, et al. Chondrosarcoma of the scapula[J]. Cancer, 2005, 104(1): 149-158. |
| [15] |
Lee FY, Mankin HJ, Fondren G, et al. Chondrosarcoma of bone: an assessment of outcome[J]. J Bone Joint Surg Am, 1999, 81(3): 326-338. DOI:10.2106/00004623-199903000-00004 |
 2020, Vol. 47
2020, Vol. 47


