文章信息
- 阿帕替尼治疗晚期难治性乳腺癌的临床疗效观察
- Clinical Observation of Apatinib in Treatment of Refractory Advanced Breast Cancer
- 肿瘤防治研究, 2020, 47(11): 861-865
- Cancer Research on Prevention and Treatment, 2020, 47(11): 861-865
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1305
- 收稿日期: 2020-04-20
- 修回日期: 2020-08-17
2. 063000 唐山,唐山市人民医院(肿瘤医院)乳外科
2. Department of Breast Surgery, Tangshan People's Hospital, Tangshan 063000, China
乳腺癌是常见的恶性肿瘤,约4%~6%乳腺癌患者初诊时即已转移,转移性乳腺癌(metastatic breast cancer, MBC)5年生存率约20%[1]。肿瘤新生血管网络提供的营养是肿瘤恶性生长的关键环节之一[2-3]。抗血管生成靶向治疗成为治疗肿瘤的突破点。血管内皮生长因子(VEGF)及其受体VEGFR2在病理性血管生成中发挥中心作用,使其成为抗血管生成药物开发的关键靶点[4]。Ⅰ期临床研究结果显示,阿帕替尼具有广谱抗肿瘤活性,包括胃癌、结肠直肠癌和乳腺癌等[5]。阿帕替尼作为中国研制的抗VEGFR-2的小分子酪氨酸激酶抑制剂的新型靶向药物,已被CFDA批准用于晚期胃癌的治疗。虽然目前阿帕替尼在乳腺癌应用的大型临床研究较少,但是临床真实世界应用阿帕替尼治疗复发难治性乳腺癌的病例并不罕见。本文通过回顾性分析2017年1月至2018年12月在唐山市人民医院接受阿帕替尼治疗的29例晚期难治性乳腺癌患者的临床资料,为该类患者的治疗提供参考。
1 资料与方法 1.1 临床资料收集2017年1月—2018年12月我院收治的经阿帕替尼治疗晚期难治性乳腺癌患者29例。纳入标准:组织病理学证实为浸润性导管癌并有明确分子分型;既往均按照诊疗规范接受三线或三线以上治疗;根据美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分1~3分;预计生存期≥3月;临床分期为Ⅳ期;根据RECIST实体瘤的疗效评定标准有可测量的靶病灶;口服阿帕替尼治疗达4周以上。排除标准:(1)男性乳腺癌;(2)合并其他恶性肿瘤;(3)临床病理或随访资料不完整者。本试验经唐山市人民医院伦理委员会批准。
1.2 治疗方法患者均接受阿帕替尼(甲磺酸阿帕替尼片,商品名:艾坦,江苏恒瑞医药股份有限公司,国药准字20140105:规格:250 mg×10片/盒):500 mg,每日1次,餐后半小时口服,每4周为1周期,直至病情进展或出现不可耐受的不良反应。当出现与阿帕替尼相关的Ⅲ级或以上不良反应时,给予患者对症治疗及护理,仍不缓解时暂停用药,待不良反应恢复到≤Ⅰ级,再次应用阿帕替尼并降低剂量为250 mg,1片/天。由于该组患者为多线治疗以上或者年老体弱者,联合化疗均为单药口服化疗药物,其中6例联合卡培他滨,2例联合长春瑞滨,5例联合依托铂苷治疗,另单纯口服阿帕替尼治疗16例,无阿帕替尼联合内分泌及抗HER2治疗病例。
1.3 疗效观察开始服用阿帕替尼后每4周按照RECIST标准评价疗效1次,直至肿瘤进展或死亡。不良反应评价按照世界卫生组织抗肿瘤药物不良反应评分标准进行评价,共分为0~4级。随访截至2019年3月31日。
1.4 统计学方法用SPSS22.0统计软件包,率的比较应用卡方检验,Kaplan-Meier法进行生存分析,Log rank进行单因素分析,单因素分析P < 0.1为差异有统计学意义,并进入Cox回归多因素分析,P < 0.05为差异有统计学意义。
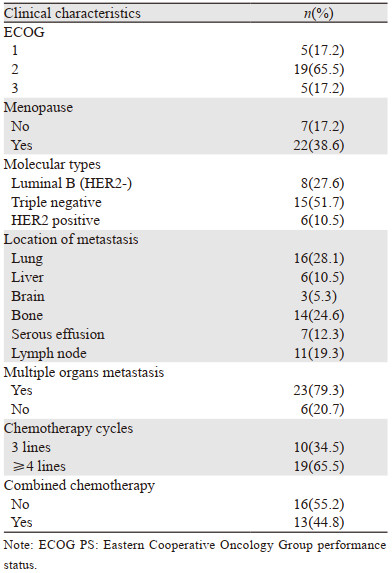
2 结果 2.1 一般资料29例患者,均为女性,年龄29~78岁,中位年龄52岁,一般资料见表 1。
截至随访,3例患者死亡,无失访病例,随访时间32~552天,中位随访时间236天,随访率100%。
2.3 近期疗效按照RECIST1.1标准行近期疗效评价,疾病进展(PD)5例(17.2%),稳定(SD)13例(44.8%),部分缓解(PR)11例(37.9%),完全缓解(CR)患者0例,疾病控制率(82.8%)。
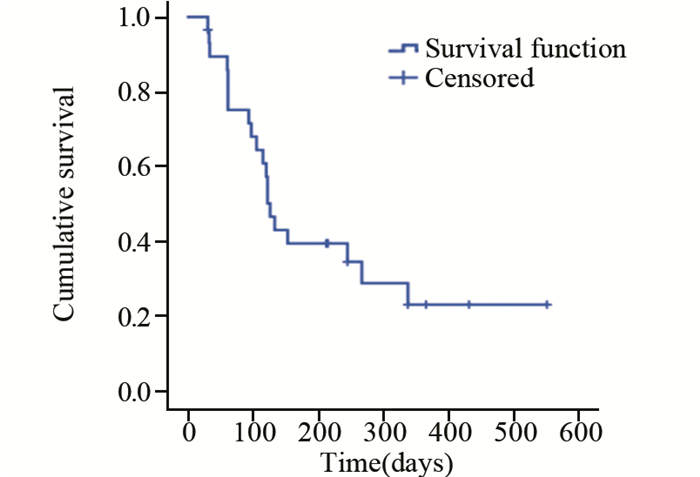
2.4 无进展生存期采用Kaplan-Meier生存曲线进行无进展生存期分析,并绘制生存曲线,中位无进展生存时间为126天,见图 1。
|
| 图 1 29例晚期乳腺癌患者服用阿帕替尼后无进展生存率 Figure 1 Progression-free survival(PFS) of 29 ABC patients treated with apatinib |
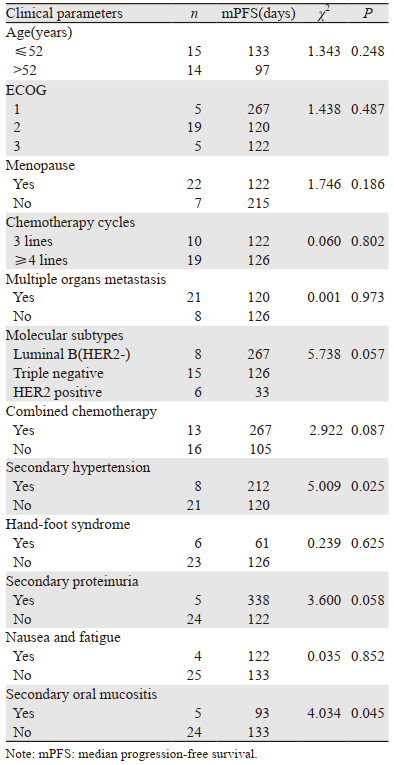
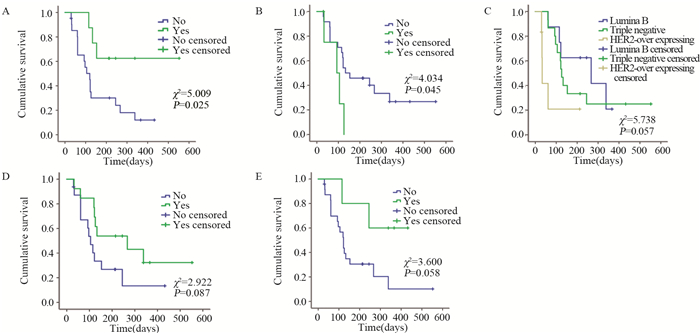
将可能影响该组患者无进展生存期的因素进行单因素分析,见表 2,以中位年龄52岁为界分为≤52岁组和 > 52岁组,结果显示继发性高血压、继发性口腔黏膜炎、分子分型、是否联合化疗、继发性蛋白尿与患者无进展生存期有关(P=0.025, 0.045,0.057, 0.087, 0.058),见图 2。
|
|
| A: secondary hypertension; B: Secondary oral mucositis; C: molecular subtypes; D: combination chemotherapy; E: secondary proteinuria 图 2 临床参数与无进展生存期的关系 Figure 2 Relation between clinical parameters and progression-free survival |
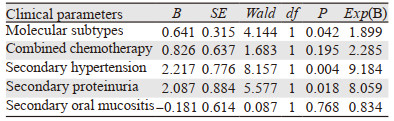
Cox模型向前逐步法(似然比统计量)分析显示:分子分型、继发性高血压、继发性蛋白尿是阿帕替尼治疗晚期乳腺癌无进展生存期的独立影响因素(P=0.042, 0.004, 0.018),见表 3。
|
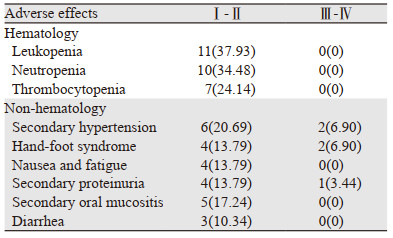
截止末次随访,患者均未出现明显血液学不良反应,无不良反应导致死亡事件的发生。不良反应主要为继发性高血压(27.59%)、手足综合征(20.69%)、继发性蛋白尿(17.24%)、恶心乏力(13.79%)、继发性口腔黏膜炎(17.24%)及腹泻(10.34%),有1例患者出现鼻腔出血,未见消化道出血发生,见表 4。该组病例中大部分能耐受不良反应,部分患者通过药物减量后症状得到较好控制,未影响阿帕替尼使用。
乳腺癌是女性最常见的恶性肿瘤之一,病死率居女性各类恶性肿瘤的首位[6]。目前针对基于分子分型的晚期及复发转移性乳腺癌患者,主要治疗方法有化疗、靶向药物治疗及内分泌治疗,但仍为不可治愈,需进一步探索药物的选择。肿瘤生长离不开血管[7]。一项荟萃分析显示,贝伐珠单抗联合化疗治疗HER2阴性MBC可改善患者的无进展生存期和客观缓解率[8]。一线应用贝伐单抗进展的HER2阴性乳腺癌患者继续应用贝伐单抗,仍可获益[9]。对于HER2阳性晚期乳腺癌,曲妥珠单抗联合贝伐单抗显示出一定的疗效[10]。对于内分泌治疗敏感MBC患者,在内分泌治疗基础上加入贝伐单抗可以延长PFS但是未改善OS[11]。体外实验显示阿帕替尼可能通过抑制乳腺癌MDA-MB-231细胞的有氧糖酵解效应,进而诱导其凋亡[12],还可通过VEGFR2阻断增强卡铂对三阴性乳腺癌(triple-negative breast cancer, TNBC)的敏感度[13]。Hu等[14]开展了阿帕替尼治疗转移性TNBC的Ⅱ期研究,方案为阿帕替尼500 mg,口服,每日1次,与安慰剂组进行比较,共纳入56例患者,中位PFS为3.3月。同时也研究了阿帕替尼对晚期非TNBC患者多线治疗的疗效,共纳入38例患者(其中36例可进行疗效分析),中位PFS为4.0月,其中1例达到完全缓解,5例达到部分缓解,ORR为16.7%(6/36),中位OS为10.3月[15]。Lin等[16]研究发现阿帕替尼治疗转移性乳腺癌安全有效,即使既往曾应用过贝伐单抗治疗的患者仍能从阿帕替尼治疗获益。本组回顾性病例共纳入29例经多线治疗后进展的难治性乳腺癌患者,其中三阴性患者15例,Luminal B(HER2-)型8例,HER2阳性患者6例,均原发或继发曲妥珠单抗耐药。经Log rank单因素分析显示:阿帕替尼治疗经多线治疗耐药的Luminal B(HER2-)型及三阴性晚期乳腺癌,较HER2阳性乳腺癌患者有更好的PFS,分别为267、126、33 d。阿帕替尼可能更适合于Luminal B型及三阴性晚期乳腺癌患者。由于本研究为小样本回顾性研究,主要终点为无进展生存时间(PFS),另外本研究为非随机对照观察性研究,且随访时间较短,对于病情进展后更换治疗方案对总生存(overall survival, OS)影响无法评估,故需增大样本量,延长随访时间评价阿帕替尼对OS的影响。
至于阿帕替尼是否联合化疗及联合哪种化疗药物更能获益,Zhu等[17]回顾性分析了阿帕替尼联合化疗治疗转移性或局部晚期乳腺癌患者85例,其中植物源性化疗药物(长春瑞滨、依托泊苷和紫杉醇)56例,非植物源性化疗药物(吉西他滨、环磷酰胺、卡培他滨和铂)29例,结果显示:两组PFS及OS无显著差异。Li等[18]通过回顾性分析显示:阿帕替尼联合卡培他滨较单独卡培他滨治疗TNBC显示出更好的PFS及ORR。本组病例中有13例接受阿帕替尼联合化疗药物(卡培他滨6例、依托铂苷胶囊2例及长春瑞滨胶囊5例)治疗,16例单独应用阿帕替尼,单因素分析示两者中位无进展生存期(mPFS)接近统计学差异(267 d vs. 105 d, P=0.087)。但本研究为回顾性研究,患者均为多线治疗后晚期患者,联合化疗方案均选择口服化疗药物,至于阿帕替尼联合哪种化疗药物能有更好的临床获益,还需进一步的前瞻性研究。
阿帕替尼最常见的不良反应有手足综合征、高血压、出血、蛋白尿,而声音嘶哑、皮疹、疼痛、疲乏、肝功损害、腹泻、黏膜溃疡、呼吸困难、感染、呕吐、声音嘶哑、白化病、厌食等较少见[19]。其中最常见的3~4级不良反应为高血压、手足综合征及继发性蛋白尿,但发生率并未随阿帕替尼的剂量增加而增加[20]。Zhu等[17]分析发现继发性蛋白尿是PFS(HR=0.398, P=0.030)及OS(HR=0.160, P=0.029)的独立预后因素。Fan等[21]研究发现继发性高血压(HR=0.58, P=0.038)为PFS的独立预测因子,或许能从中筛选出抗血管生成疗法的敏感人群。本组病例不良反应主要为继发性高血压(27.59%)、手足综合征(20.69%)、继发性蛋白尿(17.24%)、恶心、乏力(13.79%)、继发性口腔黏膜炎(17.24%)及腹泻(10.34%),部分患者通过暂停用药、降低剂量、对症处理、加强护理等方式,症状基本可以短期得到控制。经Cox回归分析示继发高血压及蛋白尿的患者有更好的PFS(P=0.004, P=0.018),继发性高血压及蛋白尿与阿帕替尼疗效相关。
综上所述,阿帕替尼是一种有潜力的口服小分子抗肿瘤药物,在经多线治疗耐药的Luminal B及三阴性乳腺癌中可获得一定疗效,且安全性较好,不良反应可控。至于阿帕替尼的最佳剂量以及阿帕替尼联合何种化疗药物能得到更好的疗效、更低的不良反应,需要更多的多中心、前瞻性临床研究,期待阿帕替尼更多地应用于临床治疗新进展,为难治性乳腺癌患者的治疗带来希望。
作者贡献
王静:病例资料收集,数据整理及分析、论文撰写及修改
贾敬好:课题构思指导,论文指导及修改
刘晶晶:临床资料整理及随访
崔志超:临床病例资料收集
熊伟、王晓红:课题构思指导
| [1] |
Cardoso F, Harbeck N, Fallowfield L, et al. Locally recurrent or metastatic breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2012, 23 suppl 7: vii 11-19.
|
| [2] |
Carmeliet P, Jain RK. Molecular mechanisms and clinical applications of angiogenesis[J]. Nature, 2011, 473(7347): 298-307. DOI:10.1038/nature10144 |
| [3] |
Huang L, Wei Y, Shen S, et al. Therapeutic effect of apatinib on overall survival is mediated by prolonged progression-free survival in advanced gastric cancer patients[J]. Oncotarget, 2017, 8(17): 29346-20354. DOI:10.18632/oncotarget.12897 |
| [4] |
Jain RK. Antiangiogenesis strategies revisited: from starving tumors to alleviating hypoxia[J]. Cancer Cell, 2014, 26(5): 605-622. DOI:10.1016/j.ccell.2014.10.006 |
| [5] |
Li J, Zhao X, Chen L, et al. Safety and pharmacokinetics of novel selective vascular endothelial growth factor receptor-2 inhibitor YN968D1 in patients with advanced malignancies[J]. BMC Cancer, 2010, 10: 529. DOI:10.1186/1471-2407-10-529 |
| [6] |
Anderson BO, Shyyan R, Eniu A, et al. Breast cancer in limited-resource countries: an overview of the breast health global initiative 2005 guidelines[J]. Breast J, 2006, 12 Suppl 1: S3-S15. |
| [7] |
Verheul HMW, Voest EE, Schlingemann RO. Are tumours angiogenesis-dependent?[J]. J Pathol, 2004, 202(1): 5-13. DOI:10.1002/path.1473 |
| [8] |
Rossari JR, Metzger-Filho O, Paesmans M, et al. Bevacizumab and Breast Cancer: A Meta-Analysis of First-Line Phase Ⅲ Studies and a Critical Reappraisal of Available Evidence[J]. J Oncol, 2012, 2012: 417673. |
| [9] |
Vrdoljak E, Marschner N, Zielinski C, et al. Final results of the TANIA randomised phase Ⅲ trial of bevacizumab after progression on first-line bevacizumab therapy for HER2-negative locally recurrent/metastatic breast cancer[J]. Ann Oncol, 2016, 27(11): 2046-2052. DOI:10.1093/annonc/mdw316 |
| [10] |
Drooger JC, van Tinteren H, de Groot SM, et al. A randomized phase 2 study exploring the role of bevacizumab and a chemotherapy-free approach in HER2-positive metastatic breast cancer: The HAT study (BOOG 2008-2003), a Dutch Breast Cancer Research Group trial[J]. Cancer, 2016, 122(19): 2961-2970. DOI:10.1002/cncr.30141 |
| [11] |
Martín M, Loibl S, Hyslop T, et al. Evaluating the addition of bevacizumab to endocrine therapy as first-line treatment for hormone receptor-positive metastatic breast cancer: a pooled analysis from the LEA (GEICAM/2006-11_GBG51) and CALGB 40503 (Alliance) trials[J]. Eur J Cancer, 2019, 117: 91-98. DOI:10.1016/j.ejca.2019.06.002 |
| [12] |
张化芝, 李晓双, 郭晓烨, 等. 阿帕替尼通过抑制糖酵解途径对乳腺癌MDA-MB-231细胞增殖抑制及凋亡的作用[J]. 肿瘤防治研究, 2019, 46(5): 401-405. [Zhang HZ, Li XS, Guo XY, et al. Apatinib Suppresses Proliferation and Induced Apoptosis of Human Breast Cancer Cell Line MDA-MB-231 Through Glycolytic Inhibition[J]. Zhong Liu Fang Zhi Yan Jiu, 2019, 46(5): 401-405.] |
| [13] |
Gao Z, Shi M, Wang Y, et al. Apatinib enhanced anti-tumor activity of cisplatin on triple-negative breast cancer through inhibition of VEGFR-2[J]. Pathol Res Pract, 2019, 215(7): 152422. DOI:10.1016/j.prp.2019.04.014 |
| [14] |
Hu X, Zhang J, Xu B, et al. Multicenter phase Ⅱ study of apatinib, a novel VEGFR inhibitor in heavily pretreated patients with metastatic triple-negative breast cancer[J]. Int J Cancer, 2014, 135(8): 1961-1969. DOI:10.1002/ijc.28829 |
| [15] |
Hu X, Cao J, Hu W, et al. Multicenter phase Ⅱ study of apatinib in non-triple-negative metastatic breast cancer[J]. BMC Cancer, 2014, 14: 820. DOI:10.1186/1471-2407-14-820 |
| [16] |
Lin Y, Wu Z, Zhang J, et al. Apatinib for metastatic breast cancer in non-clinical trial setting: Satisfying efficacy regardless of previous anti-angiogenic treatment[J]. Tumour Biol, 2017, 39(6): 1010428317711033. |
| [17] |
Zhu A, Yuan P, Wang J, et al. Apatinib combined with chemotherapy in patients with previously treated advanced breast cancer: An observational study[J]. Oncol Lett, 2019, 17(6): 4768-4778. |
| [18] |
Li Y, Zhou Y, Wang Y, et al. Comparison of apatinib and capecitabine (Xeloda) with capecitabine (Xeloda) in advanced triple negative breast cancer as third-line therapy A retrospective study[J]. Medicine (Baltimore), 2018, 97(36): e12222. DOI:10.1097/MD.0000000000012222 |
| [19] |
秦叔逵, 李进. 阿帕替尼治疗胃癌的临床应用专家共识[J]. 临床肿瘤学杂志, 2015, 20(9): 841-847. [Qin SQ, Li J. Expert consensus on the clinical application of apatinib for gastric cancer[J]. Lin Chuang Zhong Liu Xue Za Zhi, 2015, 20(9): 841-847.] |
| [20] |
Sun D, Hou H, Zhang C, et al. The efficacy and safety of apatinib for refractory malignancies: a review and meta-analysis[J]. Onco Targets Ther, 2018, 11: 6539-6554. DOI:10.2147/OTT.S176429 |
| [21] |
Fan M, Zhang J, Wang Z, et al. Phosphorylated VEGFR2 and hypertension: potential biomarkers to indicate VEGFdependency of advanced breast cancer in anti-angiogenic therapy[J]. Breast Cancer Res Treat, 2014, 143(1): 141-151. DOI:10.1007/s10549-013-2793-6 |
 2020, Vol. 47
2020, Vol. 47