文章信息
- GPNMB、ERK、MMP3和MMP9在肾癌原发灶和骨转移灶中的表达及相关性分析
- Expression of GPNMB, ERK, MMP3 and MMP9 in Primary Lesion and Bone Metastasis of Renal Cell Carcinoma and Their Correlation
- 肿瘤防治研究, 2020, 47(5): 367-371
- Cancer Research on Prevention and Treatment, 2020, 47(5): 367-371
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1273
- 收稿日期: 2019-10-14
- 修回日期: 2020-03-03
转移性肾癌中骨转移的发生率约为24%~32%。骨转移为肾癌第二大常见转移部位[1]。非转移性黑色素瘤糖蛋白B(glycoprotein non-metastatic melanoma protein B, GPNMB)是近期发现的和多种恶性肿瘤骨转移相关的一个蛋白[2-4],其是由GPNMB基因编码的蛋白,该基因位于7q15,编码Ⅰ型跨膜蛋白。GPNMB与肾癌骨转移发生的时间、骨转移的范围、骨转移的数目、肾癌原发灶和骨转移灶病理分级之间的关系是本研究的目的,并探讨了GPNMB骨转移的发生机制。
1 资料与方法 1.1 一般资料收集2009年—2018年北京积水潭医院泌尿外科、骨肿瘤科、脊柱外科收治的初诊为肾癌骨转移的患者临床病理资料23例。纳入标准:(1)初诊为肾癌骨转移患者; (2)全身骨扫描或PET-CT明确诊断为骨转移者; (3)肾癌原发灶和骨转移灶均行手术治疗,且有明确病理标本者。排除标准:(1)非透明细胞癌者; (2)骨转移灶行放疗者; (3)已行靶向药物治疗者。分析指标包括:患者的性别、年龄、骨转移发生的时间、骨转移的部位、骨转移的数目、有无合并内脏转移以及肾癌原发灶和骨转移灶的病理分级。肾癌原发灶和骨转移灶分别切取病理切片作免疫组织化学分析。
1.2 主要试剂及来源GPNMB抗体、ERK抗体、MMP3抗体和MMP9抗体均购自美国Abcam公司。即用型二抗试剂及酶底物显色剂DAB等试剂购自中杉金桥生物有限公司。GPNMB、ERK、MMP3和MMP9的工作浓度分别是1:500、1:300、1:300和1:1 000,用磷酸盐缓冲液(PBS)代替一抗作为阴性对照。
1.3 免疫组织化学分析及结果判定组织切片脱蜡、水化后,0.01 mol/L枸橼酸缓冲液(pH 6.0)抗原修复,3%过氧化氢阻断内源性过氧化物酶,正常山羊血清封闭30 min。滴加一抗后4℃湿盒中孵育过夜。加酶标二抗室温20 min,DAB显色3 min,Harris苏木精对比染色、脱水、封片。用奥林巴斯BX53型生物显微镜观察,细胞质或细胞核中出现棕黄色为阳性细胞。由两名经验丰富的病理科医师采用双盲法判断结果。结果均采用双评分半定量法进行评分,依据阳性细胞比例评分:细胞阳性率 < 5%为1分,5%~50%为2分,≥50%为3分; 依据染色强度评分:不着色为1分,淡黄色为2分,黄色为3分,棕黄色为4分。最终得分为阳性细胞比例和染色强度评分之积。
1.4 统计学方法采用SPSS20.0统计软件处理数据。计数资料以数量及百分比表示,组间比较采用χ2检验或Fisher精确检验。计量资料以平均值±标准差表示,原发灶与骨转移灶蛋白表达量差异的组间比较采用配对样本t检验。其余两组间比较采用独立样本t检验,相关性分析采用Spearman秩相关分析。P < 0.05为差异有统计学意义。
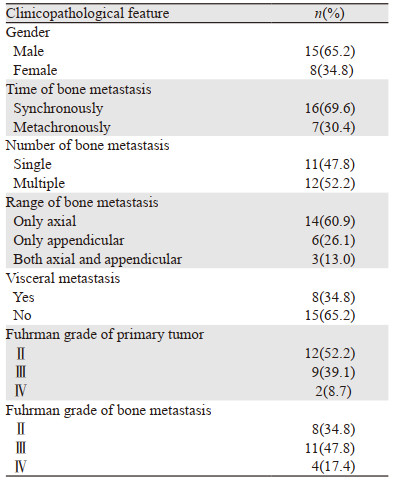
2 结果 2.1 患者临床病理资料收集到初诊为肾癌骨转移的患者23例,见表 1。其中男女患者的比例是1.87:1。患者中年龄最小的为38岁,年龄最大的为75岁,平均年龄58.6±9.5岁。12例患者原发灶Fuhrman分级为Ⅱ级者,其骨转移灶Ⅱ级8例、Ⅲ级4例; 9例患者原发灶Fuhrman分级为Ⅲ级者,其骨转移灶Ⅲ级7例、Ⅳ级2例; 2例患者原发灶和骨转移灶均为Ⅳ级。在内脏转移中,最常见的脏器转移为肺转移有5例,其次为肾上腺转移有2例,另有腹膜后淋巴结转移和肝脏转移者各有1例。
|
GPNMB在肾癌原发灶和骨转移灶中的表达量分别是3.65±1.87和5.91±3.68,两组之间差异有统计学意义(P=0.001); ERK表达量分别是3.96±1.36和5.52±3.15,两组之间差异有统计学意义(P=0.016); MMP3的表达量分别是3.13±1.74和4.78±2.29,两组之间差异有统计学意义(P=0.036); MMP9的表达量分别是3.91±1.76和5.26±2.98,两组之间差异有统计学意义(P=0.023)。
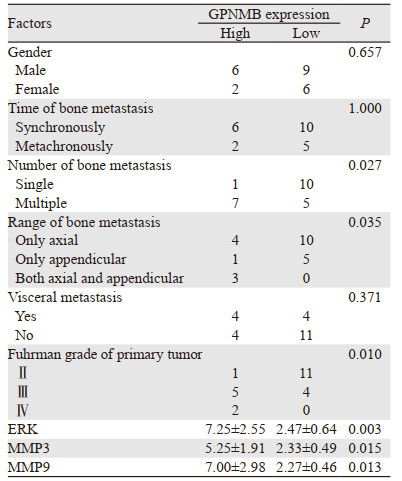
2.3 肾癌原发灶和骨转移灶GPNMB的表达与临床病理特征的关系依据肾癌原发灶中GPNMB表达情况分为GPNMB高表达组(8例)和GPNMB低表达组(15例)。患者的性别、骨转移时间和内脏转移在两组之间比较,差异无统计学意义。GPNMB高表达组中,7例患者的骨转移灶≥2处; 而GPNMB低表达组患者中,只有5例患者骨转移灶≥2处; 两组之间差异有统计学意义(P=0.027)。GPNMB高表达组与低表达组患者中发生中轴骨转移、四肢骨转移、中轴骨和四肢骨均转移的例数组间比较差异有统计学意义(P=0.035)。Fuhrman分级为Ⅱ级、Ⅲ级和Ⅳ级的患者在GPNMB高表达组和低表达组中例数比较,差异有统计学意义(P=0.01)。ERK、MMP3和MMP9在GPNMB高表达组和低表达组中的表达量组间比较,差异均有统计学意义(均P < 0.05),见图 1、表 2。
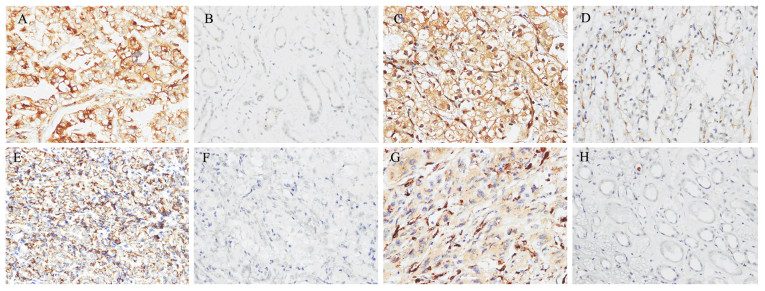
|
| A-B: high and low GPNMB expression; C-D: high and low ERK expression; E-F: high and low MMP3 expression; G-H: high and low MMP9 expression. 图 1 GPNMB、ERK、MMP3和MMP9高表达与低表达 Figure 1 High and low expression of GPNMB, ERK, MMP3 and MMP9 |
|
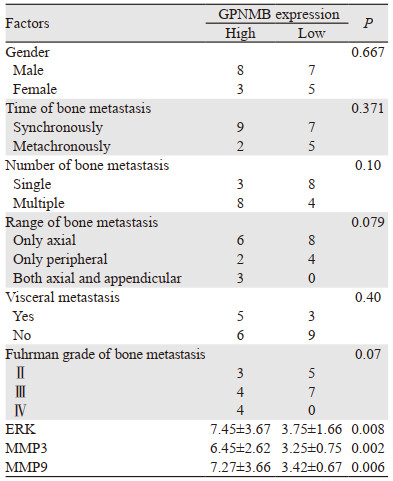
依据骨转移灶中GPNMB的表达分为:GPNMB高表达组(11例)和GPNMB低表达组(12例),见表 3。患者的性别、骨转移时间、骨转移数目、骨转移范围、内脏转移和Fuhrman分级在两组之间的差异无统计学意义。ERK、MMP3和MMP9在GPNMB高表达组和低表达组中的表达量组间比较,差异均有统计学意义(均P < 0.05)。
|
多项研究发现GPNMB可以促进各种肿瘤的发生、发展和转移,其中包括黑色素瘤、乳腺癌、前列腺癌和肾癌等[5-7]。肿瘤原发灶中的GPNMB表达与疾病的预后相关。Rose的研究发现GPNMB是乳腺癌预后不良的因素,GPNMB高表达的乳腺癌患者疾病复发时间短,患者总体生存率低[8]。赫崇军等研究了GPNMB在肾癌原发灶和骨转移灶中表达及其意义,发现GPNMB在肾癌原发灶中的表达水平低于转移灶,并且GPNMB高表达是患者预后不良的指标[9]。Qin也研究了GPNMB与肾癌患者的预后,发现GPNMB高表达和低表达肾癌患者的中位总生存期分别是53.5月和69.月(P=0.002)[10]。本研究发现,GPNMB高表达组患者更容易发生中轴骨和四肢骨的全身转移(P=0.035)。既往研究多探讨GPNMB与疾病预后之间的关系,而本研究则侧重其与患者骨转移的数目,骨转移范围等骨转移临床指标的关系,并且发现肾癌原发灶中GPNMB高表达与肾癌骨转移的临床参数相关。因此肾癌原发灶中GPNMB的表达,可在一定程度上预测肾癌骨转移的范围。
骨转移灶中GPNMB的表达较肾癌原发灶明显提高。本研究骨转移灶中GPNMB高表达与骨转移的数目和范围、内脏转移等无相关性,提示肾癌原发灶中表达GPNMB的肿瘤细胞容易发生转移,而骨转移灶中癌细胞不同于原发灶,其中GPNMB等相关蛋白在骨转移灶中的表达普遍升高从而降低了其预测骨转移范围和程度的价值。
GPNMB促进肿瘤骨转移的确切机制尚不明确。Ren探讨了胃癌中GPNMB的致病机制,发现GPNMB被敲除后胃癌细胞的增殖和转移能力降低,另外GPNMB通过PI3K/AKT/CCL4信号通路,募集免疫抑制细胞和增加免疫细胞的衰竭,从而增强胃癌细胞的免疫抑制能力[11]。另有研究发现GPNMB能激活细胞内的MAPK-ERK信号通路[12-14]。ERK信号转导途径被激活后可以促进多种MMP的产生[15-17],其中也包括MMP3和MMP9蛋白。MMP蛋白则可以增强肿瘤细胞的浸润和转移能力,尤其是增强肿瘤细胞骨转移的发生[18-19]。Fiorentini在前列腺癌的研究中发现,GPNMB通过提高细胞内MMP2和MMP9的活性,促进了人前列腺癌细胞系DU145和PC3的肿瘤浸润性[7]。在肾癌骨转移患者中,GPNMB是否也可能通过ERK信号通路的激活来促进肾癌细胞骨转移的发生,也是本研究探讨的目的。本研究发现,肾癌原发灶和骨转移灶中GPNMB的高表达与ERK、MMP3和MMP9高表达相关,提示GPNMB可能通过激活ERK信号通路上调MMP3和MMP9促进肾癌骨转移的发生,当然这需要细胞分子生物学的实验来进一步验证。
本研究明确了本中心肾癌骨转移患者的基本情况,并对肾癌原发灶和骨转移灶中GPNMB、ERK、MMP3和MMP9蛋白的表达与骨转移的时间、范围、数目等指标进行了相关性分析,得出了初步的结论,但是该研究也存在一定局限性。由于该研究只调查了笔者所在医疗机构的患者,因此研究存在一定的选择偏倚。研究结论尚需要进行更大规模的前瞻、随机、多中心的研究来证实,且GPNMB导致骨转移的分子机制也需要进行分子生物学的实验来进一步探讨。
作者贡献
翟建坡:实验数据分析、全文统筹及文章撰写
刘宁、王海:实验数据分析、全文统筹
王海东:审核临床病理诊断准确性
满立波:整体把握实验设计的合理性及文章修改
| [1] |
Bianchi M, Sun M, Jeldres C, et al. Distribution of metastatic sites in renal cell carcinoma: a population-based analysis[J]. Ann Oncol, 2012, 23(4): 973-980. DOI:10.1093/annonc/mdr362 |
| [2] |
Chen C, Okita Y, Watanabe Y, et al. Glycoprotein nmb Is Exposed on the Surface of Dormant Breast Cancer Cells and Induces Stem Cell-like Properties[J]. Cancer Res, 2018, 78(22): 6424-6435. |
| [3] |
Tanaka M, Homme M, Yamazaki Y, et al. Modeling Alveolar Soft Part Sarcoma Unveils Novel Mechanisms of Metastasis[J]. Cancer Res, 2017, 77(4): 897-907. DOI:10.1158/0008-5472.CAN-16-2486 |
| [4] |
Furuya M, Hong SB, Tanaka R, et al. Distinctive expression patterns of glycoprotein non-metastatic B and folliculin in renal tumors in patients with Birt-Hogg-Dube syndrome[J]. Cancer Sci, 2015, 106(3): 315-323. DOI:10.1111/cas.12601 |
| [5] |
Truong DD, Kratz A, Park JG, et al. A Human Organotypic Microfluidic Tumor Model Permits Investigation of the Interplay between Patient-Derived Fibroblasts and Breast Cancer Cells[J]. Cancer Res, 2019, 79(12): 3139-3151. DOI:10.1158/0008-5472.CAN-18-2293 |
| [6] |
Awolaran O, Brooks SA, Lavender V. Breast cancer osteomimicry and its role in bone specific metastasis; an integrative, systematic review of preclinical evidence[J]. Breast, 2016, 30: 156-171. DOI:10.1016/j.breast.2016.09.017 |
| [7] |
Fiorentini C, Bodei S, Bedussi F, et al. GPNMB/OA protein increases the invasiveness of human metastatic prostate cancer cell lines DU145 and PC3 through MMP-2 and MMP-9 activity[J]. Exp Cell Res, 2014, 323(1): 100-111. DOI:10.1016/j.yexcr.2014.02.025 |
| [8] |
Rose AA, Grosset AA, Dong Z, et al. Glycoprotein nonmetastatic B is an independent prognostic indicator of recurrence and a novel therapeutic target in breast cancer[J]. Clin Cancer Res, 2010, 16(7): 2147-2156. DOI:10.1158/1078-0432.CCR-09-1611 |
| [9] |
赫崇军, 秦彩朋, 徐涛, 等. 肾透明细胞癌中非转移性黑色素瘤糖蛋白B的表达及临床价值[J]. 中华医学杂志, 2015, 95(30): 2455-2458. [He CJ, Qin CP, Xu T, et al. Expression of glycoprotein non-metastatic melanoma protein B in clear-cell renal cell carcinoma and clinical implication thereof[J]. Zhonghua Yi Xue Za Zhi, 2015, 95(30): 2455-2458. DOI:10.3760/cma.j.issn.0376-2491.2015.30.011] |
| [10] |
Qin C, Liu Z, Yuan Y, et al. Glycoprotein non-metastatic melanoma protein B as a predictive prognostic factor in clear-cell renal cell carcinoma following radical nephrectomy[J]. Mol Med Rep, 2014, 9(3): 851-856. DOI:10.3892/mmr.2014.1896 |
| [11] |
Ren F, Zhao Q, Liu B, et al. Transcriptome analysis reveals GPNMB as a potential therapeutic target for gastric cancer[J]. J Cell Phys, 2020, 235(3): 2738-2752. DOI:10.1002/jcp.29177 |
| [12] |
Ono Y, Chiba S, Yano H, et al. Glycoprotein nonmetastatic melanoma protein B (GPNMB) promotes the progression of brain glioblastoma via Na+/K+-ATPase[J]. Biochem Biophys Res Commun, 2016, 481(1-2): 7-12. DOI:10.1016/j.bbrc.2016.11.034 |
| [13] |
Sondag GR, Mbimba TS, Moussa FM, et al. Osteoactivin inhibition of osteoclastogenesis is mediated through CD44-ERK signaling[J]. Exp Mol Med, 2016, 48(9): e257. DOI:10.1038/emm.2016.78 |
| [14] |
Yu B, Sondag GR, Malcuit C, et al. Macrophage-Associated Osteoactivin/GPNMB Mediates Mesenchymal Stem Cell Survival, Proliferation, and Migration Via a CD44-Dependent Mechanism[J]. J Cell Biochem, 2016, 117(7): 1511-1521. DOI:10.1002/jcb.25394 |
| [15] |
Maxwell T, Chun SY, Lee KS, et al. The anti-metastatic effects of the phytoestrogen arctigenin on human breast cancer cell lines regardless of the status of ER expression[J]. Int J Oncol, 2017, 50(2): 727-735. |
| [16] |
Szabo E, Schneider H, Seystahl K, et al. Autocrine VEGFR1 and VEGFR2 signaling promotes survival in human glioblastoma models in vitro and in vivo[J]. Neuro Oncol, 2016, 18(9): 1242-1252. DOI:10.1093/neuonc/now043 |
| [17] |
Weiss MB, Abel EV, Mayberry MM, et al. TWIST1 is an ERK1/2 effector that promotes invasion and regulates MMP-1 expression in human melanoma cells[J]. Cancer Res, 2012, 72(24): 6382-6392. DOI:10.1158/0008-5472.CAN-12-1033 |
| [18] |
Nannuru KC, Futakuchi M, Varney ML, et al. Matrix Metalloproteinase (MMP)-13 Regulates Mammary Tumor–Induced Osteolysis by Activating MMP9 and Transforming Growth Factor-β Signaling at the Tumor-Bone Interface[J]. Cancer Res, 2010, 70(9): 3494-3504. DOI:10.1158/0008-5472.CAN-09-3251 |
| [19] |
Sabbota AL, Kim HR, Zhe X, et al. Shedding of RANKL by tumor-associated MT1-MMP activates Src-dependent prostate cancer cell migration[J]. Cancer Res, 2010, 70(13): 5558-5566. DOI:10.1158/0008-5472.CAN-09-4416 |
 2020, Vol. 47
2020, Vol. 47


