文章信息
- 磁共振IVIM成像指导局部晚期NSCLC同步放化疗靶区勾画及剂量提升的疗效
- Efficacy of Magnetic Resonance IVIM Imaging in Guiding Target Delineation and Dose Escalation of Concurrent Radiochemotherapy on Locally Advanced NSCLC
- 肿瘤防治研究, 2020, 47(5): 381-386
- Cancer Research on Prevention and Treatment, 2020, 47(5): 381-386
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1256
- 收稿日期: 2019-10-12
- 修回日期: 2020-03-22
2. 330006 南昌,江西省肿瘤临床转化重点实验室
2. Jiangxi Key Laboratory of Clinical Translational Cancer Research, Nanchang 330006, China
肺癌是全世界危害人类健康最常见的恶性肿瘤。大约85%的肺癌为非小细胞肺癌(non-small cell lung cancer, NSCLC)。约1/3的NSCLC患者初步就诊时即为局部晚期,不适合行手术切除,其标准治疗方法为同步放化疗[1]。然而治疗效果不佳,主要原因是因为周围正常器官的毒性限制了放疗靶区的剂量[2]。研究表明,高的生物学剂量和短的治疗时间和疗效及生存成正比[3],如何利用现有的技术条件在提高靶区剂量的同时不延长总的治疗时间并且不增加正常器官的放射性毒性反应是当今研究的热点。
目前关于如何提高局部晚期NSCLC患者根治性同步放化疗疗效的研究方向包括功能影像指导放疗靶区勾画,即生物靶区(bilogical target volume, BTV)。功能影像能够在放疗过程中先于肿瘤体积的变化而更早地反映肿瘤微观结构的改变,进而有利于早期疗效评判及指导剂量提升放疗。功能影像以PET/CT及功能磁共振(functional magnetic resonance imaging, fMRI)为代表。体素内不相干运动(intravoxel incoherent motion, IVIM)指活体生物组织中水分子多种运动形式。IVIM包括细胞内、外自由扩散运动、跨细胞膜运动统称为慢速扩散运动,微循环血管灌注的相关运动统称为快速扩散运动。应用于一系列从小到大的b值并对其DWI信号强度衰减进行拟合,可以得到慢速扩散运动系数(D),是指细胞间水分子运动,代表弥散;快速扩散运动系数(D*),是指血管内的水分子流动产生的假扩散效果,代表灌注;微循环灌注分数(f),反映血容量,即血管中水质子的体积,代表快速扩散运动的体积分数。另外,由于肺部是运动弧度比较大的器官,利用四维计算机断层摄影(four dimensional computed tomography, 4DCT)图像分析在呼吸过程中靶区及正常器官位置和体积的变化规律,有助于依据每个患者独特的运动特征设计个体化放疗计划,减少靶区照射范围,降低正常组织的不良反应并尽量提高靶区受照剂量。本课题采用4DCT结合IVIM成像指导局部晚期NSCLC靶区勾画及剂量提升,探索其疗效及安全性。
1 资料与方法 1.1 一般资料纳入南昌大学第二附属医院2014年9月—2018年3月间经确诊为无法手术、局部晚期NSCLC患者60例。采用随机数字表法按1:1比例将所有患者随机分为实验组(n=30)和对照组(n=30)。实验组患者男26例、女4例;年龄44~74岁,平均年龄62.60±8.463岁;PS评分0分者11例、1分者19例;病理类型:鳞癌20例、腺癌10例;临床分期:ⅢA期15例、ⅢB期15例。对照组患者男28例、女2例;年龄47~73岁,平均年龄60.80±5.921岁;PS评分0分者10例、1分者20例;病理类型:鳞癌22例、腺癌8例;临床分期:ⅢA期16例、ⅢB期14例。两组患者年龄、病程、病理分型和临床分期等一般资料组间比较差异无统计学意义(P > 0.05),具有可比性。
1.2 入组标准(1)组织学证实为非小细胞肺癌;(2)分期为ⅢA/ⅢB期(AJCC2007版);(3)经多学科综合判断为无法手术治疗;(4)年龄≥18岁;(5)PS评分为0~1分;(6)以根治性放化疗为目的;(7)放疗前未接受过放疗或手术;(8)既往无恶性肿瘤病史,无严重内科疾病;(9)一秒用力呼气容积(forced expiratory volume in one second, FEV1)≥1.2升/秒或≥50%预测值;(10)实验室检查:白细胞计数≥4×109/L,中性粒细胞计数≥2.0×109/L,血小板计数≥100×109/L,血红蛋白≥10 g/dl,肝肾功能及心电图正常;(11)入组前3天内妊娠实验阴性,并且同意在试验期间使用医学上有效的避孕措施;(12)签署知情同意书。
1.3 剔除标准(1)病理学证实为小细胞肺癌;(2)有胸膜及心包转移的证据;(3)有远处转移的证据;(4)之前患过其他恶性肿瘤(PFS≥3年,或可治愈的非恶黑的皮肤癌除外);(5)之前采用过系统化疗;(6)入组前采用过放疗可能导致放疗野重叠;(7)有其他潜在的严重疾病者(充血性心力衰竭,透壁性心肌梗死,入院时伴有严重急性细菌或真菌感染,会影响治疗的COPD或其他呼吸系统疾病等),考虑到该研究可能加剧或无法控制其疾病;(8)严重免疫抑制性疾病,如AIDS;(9)孕妇、哺乳期妇女或不同意试验中采用有效避孕措施的育龄妇女;(10)影像学证实导致大血管严重破坏和狭窄的T4患者;(11)患者不能进行MRI检查。
1.4 放疗计划的执行实验组:采用医科达Versa HD医用直线加速器,4DCT模拟机定位扫描,扫描范围上界为环状软骨,下界为腰2锥体。扫描层厚为5 mm,肿瘤区域层厚为2.5 mm。使用GE 3.0T超导型磁共振扫描仪(美国GE公司,GE Signa HDxt 3.0T MR),16通道腹部相控阵线圈,GE AW4.6工作站。MRI扫描序列包括横断位T2WI压脂、冠状位T2WI压脂序列及IVIM。采用20、100、150、200、250、300、350、400、500、600、800、1000 s/mm2共12个b值行多b值扩散加权成像序列(IVIM-DWI)扫描。结合横断位和冠状位T2WI压脂图像,选取肿瘤信号最高或强化最明显处作为分析层面,在病灶截面积最大及上、下相邻层面手动绘制感兴趣区。重复测量3次,取均值,ROI面积 < 50 mm2。将IVIM-DWI的原始数据导入GE AW4.6工作站,手动校正和降噪,采用Functool软件包的MADC图像后处理软件获得慢扩散系数D(slow ADC)、快扩散系数D*(fast ADC)及快扩散所占的容积分数f(fraction of fast ADC)三种参数化图像;常规DWI经后处理得到扩散系数ADC图像。
综合考虑患者胸部CT扫描及磁共振普通扫描及功能成像的结果,勾画肺内肿瘤组织为GTV-T,转移淋巴结为GTV-N,根据MRI功能成像找到ADC值最低及血供最丰富的肿块区域,勾画并标记为GTV-a。临床靶区(CTV)对于原发肿瘤在GTV的基础上均匀外放0.6~0.8 cm(鳞癌0.6 cm,腺癌0.8 cm)。对于阳性淋巴结则外扩0.5 cm,并且CTV应包括阳性淋巴结所在相应的淋巴引流区域。计划靶区(PTV)分别在GTV和CTV基础上,根据本单位的摆位误差(约0.5 cm)进行均匀外扩。PTV(GTV-T、GTV-N)剂量66 Gy/30 F/6 W,PTV(CTV)剂量60 Gy/30 F/6 W。放疗4周后使用同样的扫描及后处理方法对其进行放疗后复查,根据治疗后影像重新勾画GTV-T、GTV-N、CTV,观察肿瘤大小的改变及各参数的改变,并根据治疗前后的MRI功能影像显示另外勾画出肿瘤治疗抵抗区并命名为GTV-r,并验证是否与放疗前肿瘤活性较强区域(GTV-a)相符合。根据个体差异,在不增加周围正常器官剂量及总治疗时间的前提下采用大分割方式对治疗后GTV-r进行剂量提升。对照组:不行IVIM成像及缩野剂量提升,其余与实验组一致。
1.5 同步化疗方案采用每周方案同步化疗,方案为:多西紫杉醇20 mg/m2+顺铂20 mg/m2或紫杉醇45~50 mg/m2+卡铂AUC 2。当出现Ⅲ度以上化疗毒性时推迟化疗(非血液毒性缓解至Ⅰ度,中性粒细胞恢复至2×109/L,血小板恢复至100×109/L方可继续化疗),若化疗推迟超过2周则停止化疗。
1.6 随访患者治疗结束后1月进行随访评估,第一年每3月随访一次,第二年每6月随访一次,接下来每年随访一次。每次随访时,辅助检查包括:血常规,生化,胸腹部CT,颅脑MRI,全身骨显像及胸部MRI平扫及功能成像(IVIM)。
1.7 统计学方法采用SPSS22.0统计软件进行分析,数据统计从放疗第一天开始到患者疾病进展或死亡为末次随访时间。两样本率的比较采用χ2检验或精确检验;参数间相关性关系采用Pearson或Spearman相关性分析;两组独立样本参数值之间差异比较采用t检验或秩和检验;多组独立样本参数值之间差异比较采用单因素方差分析或秩和检验;生存观察终点差异的比较采用Log rank检验。P < 0.05为差异有统计学意义。
2 结果 2.1 IVIM指导NSCLC根治性同步放化疗靶区勾画及剂量提升的可行性实验组30例(功能MRI结合4DCT勾画靶区及放疗剂量达45~50 Gy时进行缩野并行剂量提升,Elekta Versa HD医用直线加速器及Monacco物理计划系统)在周围正常器官耐受前提下,靶区剂量覆盖可,适形性好,剂量分布均匀。实验组患者最高物理剂量达44 Gy/20 F+24 Gy/10 F(生物学剂量达53.7 Gy+29.8 Gy=83.5 Gy)。实验组平均放疗剂量为66.8±0.497 Gy,对照组平均放疗剂量为66±0.000 Gy,两组之间差异有统计学意义(P < 0.001, t=9.182)。
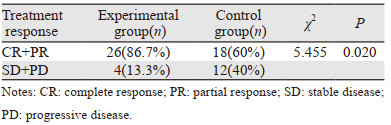
2.2 IVIM指导NSCLC根治性同步放化疗靶区勾画及剂量提升的疗效 2.2.1 总有效率在放疗结束后1月根据患者随访复查胸腹部CT,颅脑MRI,全身骨显像,胸部MRI平扫及MRI功能成像(IVIM),按RECIST1.1标准评价分析近期疗效。疗效评价分为完全缓解(CR),部分缓解(PR),疾病稳定(SD)和疾病进展(PD)。CR+PR视为治疗有效,SD+PD视为治疗无效。对照组和实验组近期疗效结果见表 1。卡方检验显示对照组和治疗组近期疗效差异有统计学意义(χ2=5.455, P=0.020)。
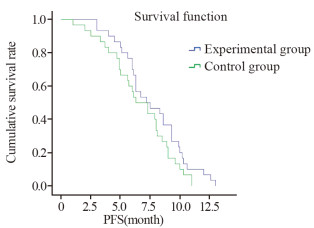
通过Log rank生存分析比较实验组和对照组PFS的差异,实验组中位PFS为7.2月,对照组中位PFS为6.3月,两组PFS差异无统计学意义(P=0.131),见图 1。
|
| 图 1 实验组与对照组PFS的比较 Figure 1 Comparison of PFS between experimental group and control group |
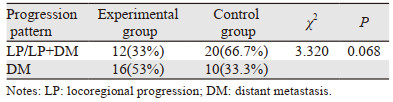
进展模式分为局部和区域肿瘤进展(locoregional progression, LP)、远处转移(distant metastasis, DM)以及同时出现LP和DM。实验组有1例患者随访3月后出现心脏猝死,不计入统计。通过卡方检验比较实验组和对照组治疗后局部区域进展发生的概率,结果显示两组患者局部进展发生率差异无统计学意义(χ2=3.320, P=0.068),见表 2。
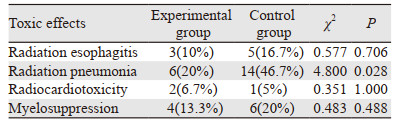
治疗及随访过程中观察患者放化疗的毒性反应,见表 3。通过卡方检验分析毒性反应发生率差异,结果显示实验组患者3/4级放射性肺炎的发生率显著降低(χ2=4.800, P=0.028),两组患者3/4级放射性食管炎(χ2=0.577, P=0.706)、放射性心脏毒性(χ2=0.351, P=1.000)、骨髓抑制(χ2=0.483, P=0.488)的发生率差异无统计学意义。
|
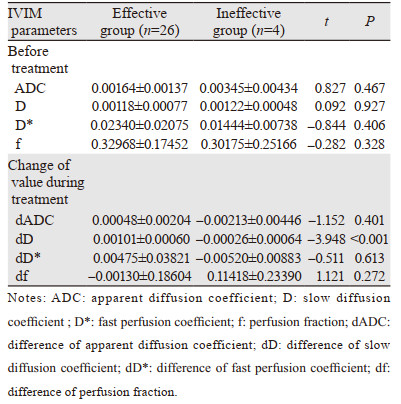
首先用单样本正态性检验对各参数作正态性检验,服从正态分布采用两组独立样本t检验,不服从采用校正t检验,比较治疗有效及治疗无效组组间肿瘤治疗前平均ADC、D、D*、f值及完成生物学剂量45~50 Gy放疗时ADC、D、D*、f值与治疗前差值dADC、dD、dD*、df的差异。结果显示有效组和无效组患者仅仅在dD值上差异有统计学意义(P < 0.001),提示dD值越大疗效越好,其余参数值差异均无统计学意义,见表 4。
|
通过Pearson相关性分析检验治疗前平均ADC、D、D*、f值及完成生物学剂量45~50 Gy放疗时ADC、D、D*、f值与治疗前差值dADC、dD、dD*、df与患者PFS之间的相关性。结果显示,只有dD值与PFS成正相关,dD值越大,PFS越长(P=0.006),其他参数值与PFS无相关性,见表 5。
同步放化疗仍是不能手术局部晚期NSCLC的标准治疗方法,然而目前利用这种治疗方法的局控率小于50%,5年生存率仅达10%~15%左右[2]。这种治疗效果不佳的原因主要为局部失败,而局部失败的主要原因是靶区设计不合理。在靶区定位方面,功能影像可以弥补普通CT的不足,研究报道,NSCLC患者基于PET/CT勾画根治性同步放化疗靶区较普通CT体积小,便于剂量提升(66.6~73.8 Gy),且野外复发率低[4]。Yang等[5]研究显示,DWI可以作为PET/CT外的另一个选择用于靶区精准定位。Tang等报道,DCE-MRI区别NSCLC T3及T4分期上优于64-MDCT[6]。Schaarschmidt等[7]报道,MRI-DWI在NSCLC淋巴结转移的判别上具有较高的特异性(> 90%),ADC值与PET/CT的SUV值成负相关,两者均可用于NSCLC淋巴结转移的鉴别。另有研究证实了功能MRI用于前列腺癌、宫颈癌、脑胶质瘤及直肠癌等精准靶区勾画及剂量提升的有效性及安全性[8-12]。
调强放射治疗的同步增量放疗(simultaneous integrated radiation boost, SIB)可以在亚临床病灶CTV采用常规分割剂量适形放疗的同步增加原发肿瘤GTV的单次分割剂量,缩短了总的治疗时间。目前研究发现SIB-IMRT应用于多种肿瘤可提高局部控制率并进一步提高生存,并且不良反应可以耐受[13-16]。最新研究表明,SIB-IMRT技术用于局部晚期NSCLC放疗较普通IMRT有效率提高,不良反应可耐受[17-18]。
同时,国内外的研究者也探讨在放疗过程中监测肿瘤体积的改变,从而在放疗过程中期通过缩野放疗来实现提高靶区剂量的同时降低周围正常器官的剂量,即自适应放疗。功能影像能早于解剖影像更好地反映肿瘤微观结构的变化。Mahasittiwat等[19]报道,NSCLC放疗至2/3根治剂量时肿瘤代谢体积(MTV)的缩小显著大于普通CT的变化,这说明通过功能影像指导放疗过程中缩野有利于靶区剂量提升。Kong等提出在照射剂量达到45 Gy时肿瘤的大小及SUV值会有一个显著的改变,在照射45 Gy的时候给予缩野增量放疗可以在提高肿瘤放疗抵抗区域剂量的同时降低或者不增加正常组织的照射剂量[20]。目前正在进行的RTOG1106研究利用了这一理念,在放疗过程中根据PET-CT调整靶区从而使得肿瘤的剂量增加到80.4 Gy[20]。Bainbridge等[21]报道功能磁共振显像在指导肺癌放疗中有着巨大的潜在应用价值,它不仅可以精确放疗前的靶区,并且能够早期预测肺癌放疗疗效及正常器官毒性。Ohno等[22]报道,治疗前的ADC值及SUVmax值均可预测Ⅲ期非小细胞肺癌的同步放化疗疗效及预后,治疗前低的ADC值或高的SUVmax值放化疗疗效好,生存期长,并且ADC值的预测价值似乎优于SUVmax。Iizuka等[23]研究了ADC值及SUVmax值对于Ⅰ期非小细胞肺癌行SBRT治疗的疗效预测价值,结果显示治疗前低的ADC值或高的SUVmax值疾病进展时间短,预后差,ADC值及SUVmax值两者结合对于Ⅰ期非小细胞肺癌SBRT治疗疗效的预测价值更大。Seki等[24]报道,CT动态灌注分数、MRI灌注参数与PET/CT SUV值均能早期预测非小细胞肺癌放化疗疗效。然而目前探索功能MRI成像用于指导NSCLC放疗过程中缩野及剂量提升的研究尚未见报道。
本研究采用MRI功能影像IVIM结合4DCT指导无法手术的局部晚期NSCLC同步放化疗靶区勾画,可以更精确的勾画靶区。在放疗剂量达45 Gy左右进行缩野剂量提升。研究结果显示,所有患者在周围正常器官耐受的前提下可以使靶区剂量至少达到66 Gy,患者总有效率显著提高,但PFS及疾病进展模式无统计学差异。实验组较对照组3/4级放射性肺炎的发生率显著下降。同时,本研究探索IVIM参数值对局部晚期NSCLC同步放化疗疗效的预测价值,结果显示治疗过程中D值的变化与患者的疗效有关,D值增加越多PFS越长。D值反应弥散,治疗过程中弥散能力越强说明肿瘤细胞密度降低,治疗效果好,放疗过程中D值的变化可能作为NSCLC放疗疗效预测指标。之后本研究将扩大样本量继续深入探讨,同时探索能使得IVIM-DWI达到最大临床指导意义的最佳b值。
作者贡献
蔡婧:文献查阅、病例搜集、数据统计分析及论文撰写
熊强:临床放疗计划设计
魏建平:病例搜集及数据录入
刘安文:研究方案制定、临床试验实施及指导论文撰写
| [1] |
Ishihara M, Igawa S, Sasaki J, et al. Evaluation of concurrent chemoradiotherapy for locally advanced NSCLC according to EGFR mutation status[J]. Oncol Lett, 2017, 14(1): 885-890. DOI:10.3892/ol.2017.6231 |
| [2] |
Brown T, Pilkington G, Boland A, et al. Clinical effectiveness of first-line chemoradiation for adult patients with locally advanced non-small cell lung cancer: a systematic review[J]. Health Technol Assess, 2013, 17(6): 1-99. DOI:10.3310/hta17060 |
| [3] |
Machtay M, Bae K, Movsas B, et al. Higher biologically effective dose of radiotherapy is associated with improved outcomes for locally advanced non-small cell lung carcinoma treated with chemoradiation: an analysis of the Radiation Therapy Oncology Group[J]. Int J Radiat Oncol Biol Phys, 2012, 82(1): 425-434. DOI:10.1016/j.ijrobp.2010.09.004 |
| [4] |
Zheng Y, Sun X, Wang J, et al. FDG-PET/CT imaging for tumor staging and definition of tumor volumes in radiation treatment planning in non-small cell lung cancer[J]. Oncol Lett, 2014, 7(4): 1015-1020. DOI:10.3892/ol.2014.1874 |
| [5] |
Yang RM, Li L, Wei XH, et al. Differentiation of central lung cancer from atelectasis: comparison of diffusion-weighted MRI with PET/CT[J]. PLoS One, 2013, 8(4): e60279. DOI:10.1371/journal.pone.0060279 |
| [6] |
Tang W, Wu N, OuYang H, et al. The presurgical T staging of non-small cell lung cancer: efficacy comparison of 64-MDCT and 3.0 T MRI[J]. Cancer Imaging, 2015, 15(1): 14. DOI:10.1186/s40644-015-0050-4 |
| [7] |
Schaarschmidt BM, Buchbender C, Nensa F, et al. correlation of the apparent diffusion coefficient (ADC) with the Standardized Uptake Value (SUV) in lymph node metastases of non-small cell lung cancer (NSCLC) patients using hybrid 18F-FDG PET/MRI[J]. PLoS One, 2015, 10(1): e0116277. DOI:10.1371/journal.pone.0116277 |
| [8] |
Dinh CV, Steenbergen P, Ghobadi G, et al. Multicenter validation of prostate tumor localization using multiparametric MRI and prior knowledge[J]. Med Phys, 2017, 44(3): 949-961. DOI:10.1002/mp.12086 |
| [9] |
Exner M, Kühn A, Stumpp P, et al. Value of diffusion-weighted MRI in diagnosis of uterine cervical cancer: a prospective study evaluating the benefits of DWI compared to conventional MR sequences in a 3T environment[J]. Acta Radiol, 2016, 57(7): 869-877. DOI:10.1177/0284185115602146 |
| [10] |
Prins FM, van der Velden JM, Gerlich AS, et al. Superior target delineation for stereotactic body radiotherapy of bone metastases from renal cell carcinoma on MRI compared to CT[J]. Ann Palliat Med, 2017, 6(Suppl 2): S147-S154. |
| [11] |
Pedrosa de Barros N, Meier R, Pletscher M, et al. On the relation between MR spectroscopy features and the distance to MRI-visible solid tumor in GBM patients[J]. Magn Reson Med, 2018, 80(6): 2339-2355. DOI:10.1002/mrm.27359 |
| [12] |
Rosa C, Caravatta L, Delli pizzi A, et al. Reproducibility of rectal tumor volume delineation using diffusion-weighted MRI: Agreement on volumes between observers[J]. Cancer Radiother, 2019, 23(3): 216-221. DOI:10.1016/j.canrad.2018.10.004 |
| [13] |
Schiller K, Geier M, Duma MN, et al. Definitive, intensity modulated tomotherapy with a simultaneous integrated boost for prostate cancer patients-Long term data on toxicity and biochemical control[J]. Rep Pract Oncol Radiother, 2019, 24(4): 315-321. DOI:10.1016/j.rpor.2019.05.004 |
| [14] |
Oh ES, Kim TH, Woo SM, et al. Effectiveness and feasibility of concurrent chemoradiotherapy using simultaneous integrated boost-intensity modulated radiotherapy with and without induction chemotherapy for locally advanced pancreatic cancer[J]. Radiat Oncol J, 2018, 36(3): 200-209. DOI:10.3857/roj.2018.00073 |
| [15] |
Tandon S, Gairola M, Ahlawat P, et al. Randomized controlled study comparing simultaneous modulated accelerated radiotherapy versus simultaneous integrated boost intensity modulated radiotherapy in the treatment of locally advanced head and neck cancer[J]. J Egypt Natl Canc Inst, 2018, 30(3): 107-115. DOI:10.1016/j.jnci.2018.06.001 |
| [16] |
Bae BK, Kang MK, Kim JC, et al. Simultaneous integrated boost intensity-modulated radiotherapy versus 3-dimensional conformal radiotherapy in preoperative concurrent chemoradiotherapy for locally advanced rectal cancer[J]. Radiat Oncol J, 2017, 35(3): 208-216. DOI:10.3857/roj.2017.00353 |
| [17] |
尤静, 杨丹, 李东明, 等. 同步推量调强放疗在局部晚期非小细胞肺癌中的应用[J]. 中国肺癌杂志, 2019, 22(11): 696-701. [You J, Yang D, Li DM, et al. Application of Simultaneous Integrated Boost Intensity Modulated Radiotherapy in Locally Advanced Non-small Cell Lung Cancer[J]. Zhongguo Fei Ai Za Zhi, 2019, 22(11): 696-701. DOI:10.3779/j.issn.1009-3419.2019.11.03] |
| [18] |
Wang D, Bi N, Zhang T, et al. Comparison of efficacy and safety between simultaneous integrated boost intensity-modulated radiotherapy and conventional intensity-modulated radiotherapy in locally advanced non-small-cell lung cancer: a retrospective study[J]. Radiat Oncol, 2019, 14(1): 106. |
| [19] |
Mahasittiwat P, Yuan S, Xie C, et al. Metabolic Tumor Volume on PET Reduced More than Gross Tumor Volume on CT during Radiotherapy in Patients with Non-Small Cell Lung Cancer Treated with 3DCRT or SBRT[J]. J Radiat Oncol, 2013, 2(2): 191-202. DOI:10.1007/s13566-013-0091-x |
| [20] |
Kong FM, Zhao J, Wang J, et al. Radiation dose effect in locally advanced non-small cell lung cancer[J]. J Thorac Dis, 2014, 6(4): 336-347. |
| [21] |
Bainbridge H, Salem A, Tijssen RHN, et al. Magnetic resonance imaging in precision radiation therapy for lung cancer[J]. Transl Lung Cancer Res, 2017, 6(6): 689-707. DOI:10.21037/tlcr.2017.09.02 |
| [22] |
Ohno Y, Koyama H, Yoshikawa T, et al. Diffusion-weighted MRI versus 18F-FDG PET/CT: performance as predictors of tumor treatment response and patient survival in patients with non-small cell lung cancer receiving chemoradiotherapy[J]. AJR Am J Roentgenol, 2012, 198(1): 75-82. DOI:10.2214/AJR.11.6525 |
| [23] |
Iizuka Y, Matsuo Y, Umeoka S, et al. Prediction of clinical outcome after stereotactic body radiotherapy for non-small cell lung cancer using diffusion-weighted MRI and (18)F-FDG PET[J]. Eur J Radiol, 2014, 83(11): 2087-2092. DOI:10.1016/j.ejrad.2014.07.018 |
| [24] |
Seki S, Fujisawa Y, Yui M, et al. Dynamic Contrast-enhanced Area-detector CT vs. Dynamic Contrast-enhanced Perfusion MRI vs. FDG-PET/CT: Comparison of Utility for Quantitative Therapeutic Outcome Prediction for NSCLC Patients Undergoing Chemoradiotherapy[J]. Magn Reson Med Sci, 2020, 19(1): 29-39. DOI:10.2463/mrms.mp.2018-0158 |
 2020, Vol. 47
2020, Vol. 47