文章信息
- 2019年CNS《成人脑转移瘤新型及试验性疗法的循证指南》解读
- Interpretation of Evidence-based Guidelines on Role of Emerging and Investigational Therapies for Treatment of Adults with Metastatic Brain Tumors Published by CNS in 2019
- 肿瘤防治研究, 2020, 47(2): 124-128
- Cancer Research on Prevention and Treatment, 2020, 47(2): 124-128
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1253
- 收稿日期: 2019-10-09
- 修回日期: 2019-11-07
脑转移瘤(metastatic brain tumors)是成人最常见的颅内肿瘤[1],其发病率约为原发性脑肿瘤的3~10倍[2],是危及人类健康的重要疾患。为此,美国神经外科医师大会(Congress of Neurological Surgeons, CNS)曾于2010年发布《脑转移瘤治疗的循证医学指南》,对新诊断的脑转移瘤的全脑放疗、手术切除、立体定向放射外科和化疗、复发性和(或)进展性脑转移瘤的治疗、预防性抗癫痫药物的应用和激素治疗等方面进行了系统阐述[3-4],为脑转移瘤的规范化治疗奠定了基础。基于近年来脑转移瘤新型治疗方法的研究进展,该学会利用Medline和Cochrane数据库,通过回顾性分析自2008年9月至2015年12月间发表的相关英文文献,制定了2019版《成人脑转移瘤治疗中新兴及试验性疗法的系统回顾和循证指南》(以下简称2019版《指南》)[5],重点讨论高强度聚焦超声、激光间质热疗、放射增敏、免疫调节、分子靶向药物等新型治疗方法,对脑转移瘤治疗的临床研究和应用具有指导意义,现将该《指南》解读如下,供临床医生参考。
1 证据来源分类和推荐力度Ⅰ类证据,1级推荐:证据来自一项或多项设计良好的临床试验,包括对此类临床试验的综述(荟萃分析);Ⅱ类证据,2级推荐:证据来自一项或多项设计良好的具有同期对照的观察性研究,如非随机队列研究、案例对照研究和其他对照研究,包括设计稍有欠缺的随机对照试验;Ⅲ类证据,3级推荐:证据来自专家共识、病例研究、病例报告和历史对照研究,以及设计上有明显缺陷的随机对照试验。
2 脑转移瘤的临床治疗现状目前脑转移瘤的主要治疗策略包括手术切除、立体定向放射外科(stereotactic radiosurgery, SRS)治疗、全脑放疗(whole brain radiation therapy, WBRT)和化疗等。2010版《指南》指出,手术切除+WBRT优于单纯WBRT,在改善肿瘤的初始转移灶局部控制率和全脑控制率方面也优于单纯手术切除(Ⅰ类证据)[6];对l~4个脑转移灶、KPS≥70分的患者,单次SRS+WBRT在肿瘤的局部控制和患者的功能状态维持方面均优于单纯WBRT;除对化疗十分敏感的生殖细胞瘤等脑转移瘤外,WBRT后常规化疗对延长患者生存期无帮助;对于未出现癫痫者不推荐预防性应用抗癫痫治疗;对于无症状、无占位效应的脑转移瘤患者也不推荐使用激素[4]。限于缺乏高质量的文献支持,2010版《指南》并未对替莫唑胺等新型化疗药物、吉非替尼等靶向药物在脑转移瘤治疗中的应用得出确切结论。近年来脑转移瘤的新型分子药物和新疗法不断涌现,在某些肿瘤的脑转移灶的控制方面显示出一定应用前景,为此2019版《指南》在文献回顾的基础上,对脑转移瘤的新型治疗策略进行了探讨。
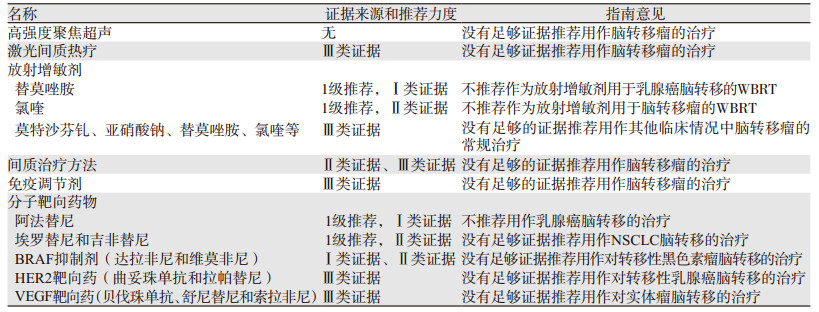
3 脑转移瘤的新型及试验性疗法各疗法的临床试验结果、证据等级及推荐等级,见表 1。
|
对《指南》中各种疗法建议的解读如下:
3.1 高强度聚焦超声高强度聚焦超声(high intensity focused ultrasound, HIFU)作为一项无创技术,能在超声或MRI引导下通过体表装置将超声束的能量传导至靶组织,引起局部升温和组织破坏,几乎不影响其邻近组织。虽然HIFU在肝、肾、乳腺及胰腺等恶性肿瘤的消融取得了较好疗效[7],还可促进患者淋巴细胞增殖、诱导抗肿瘤抗体的产生和细胞免疫[8],从而对清除治疗靶区以外的肿瘤细胞发挥积极作用,但目前关于HIFU在脑转移瘤治疗方面的文献均未达到2019版《指南》的纳入标准,因此尚缺乏足够的证据推荐将HIFU用于脑转移瘤患者的治疗。
3.2 激光间质热疗激光间质热疗(laser interstitial thermal therapy, LITT)始于20世纪80年代,近年来在MRI实时引导下的激光束能精准地将一定能量传导至目标组织,通过升温和光凝固迅速发生不可逆性坏死,其精准、微创的特性尤其适用于神经外科,对SRS治疗无效的深部脑转移瘤可能安全且有效[9]。目前已有多项小样本量的病例研究显示LITT对初治后进展的脑转移瘤患者是安全的[10]。此外,LITT还可能通过影响血脑屏障的通透性与化疗药物发挥协同作用[11]。然而,2019版《指南》指出,现有临床试验的数据尚难以对LITT用于脑转移瘤的治疗做出推荐。
3.3 放射增敏剂放射增敏剂(radiation sensitizers)指与放疗同时应用能增强放疗效果的化合物,多通过干扰肿瘤细胞的细胞周期、DNA修复或其他相关通路发挥作用。已有研究显示,莫特沙芬钆能够显著延长非小细胞肺癌(non-small cell lung cancer, NSCLC)脑转移患者的无进展生存期[12],但目前尚无充足证据支持替莫唑胺、亚硝酸钠、氯喹、帕土匹龙、伏立诺他和沙纳唑等药物的放疗增敏效应。因此,2019版《指南》提出,在对于乳腺癌脑转移患者进行WBRT时不推荐将替莫唑胺作为放射增敏剂(1级推荐,Ⅰ类证据)[13]。同样,因缺乏足够依据支持,2019版《指南》也不推荐将氯喹作为脑转移瘤WBRT中的放射增敏剂(1级推荐,Ⅱ类证据)[14]。此外,也没有足够的证据推荐将放射增敏剂,如莫特沙芬钆、亚硝酸钠、替莫唑胺或氯喹等,用作其他临床情况中对脑转移瘤患者的常规治疗。
3.4 间质治疗间质治疗(interstitial modalities)包括近距放射治疗、卡莫司汀晶片、术中放疗和光动力疗法(photodynamic therapy, PDT)等。有研究显示近距放射治疗(如立体定向近距放射治疗(stereotactic brachytherapy, SBT)[15])、卡莫司汀晶片[16]等具有与SRS相似的安全性和疗效(Ⅲ类证据)。然而,一项回顾性研究显示,SBT组的预后不及SRS组[17](Ⅲ类证据)。此外,PDT虽然已广泛用于皮肤癌的治疗,但在脑转移瘤中的应用甚少。因此,2019版《指南》认为尚缺乏足够的证据支持任何间质治疗方法作于脑转移瘤的治疗。
3.5 免疫调节剂临床常用的免疫调节剂(immune modulators)主要有单抗、过继细胞疗法和肿瘤疫苗等,其中过继细胞免疫疗法在脑胶质瘤的治疗中已取得进展[18]。目前全身性免疫疗法主要有白细胞介素-2(IL-2)、易普利单抗、针对程序性细胞死亡1(programmed cell death 1, PD-1)蛋白的单克隆抗体培布珠单抗、尼沃单抗,以及尼沃单抗联合易普利单抗等。研究显示,尼沃单抗和培布珠单抗与易普利单抗相比,在黑色素瘤全身性转移患者中获得的缓解率更高、不良反应更轻,且单药治疗时均对颅内转移瘤有效[19-20]。尽管免疫调节剂显示出良好的应用前景,CNS在系统回顾相关文献后发现,目前达到纳入标准的文献均不符合Ⅰ类或Ⅱ类证据的要求。虽然抗细胞毒性T淋巴细胞相关性蛋白4(cytotoxic T lymphocyte associated protein 4, CTLA-4)单克隆抗体易普利单抗在黑色素瘤脑转移的患者中显示出良好安全性和有效性[21](Ⅲ类证据),但尚需更大规模的研究证实。因此,2019版《指南》指出,目前没有足够的证据推荐将免疫疗法用作对脑转移瘤的治疗。
此外,免疫调节剂和分子靶向药的临床应用中还存在脑转移瘤对治疗的特异反应等问题,如“治疗效应”、“假性进展”等可能影响脑转移瘤的治疗效应评估。免疫治疗后肿瘤相关特异反应的影像学特征及时相规律尚未阐明,影像学检查有时可能会得出误导的结论。影像的间歇增强既可能代表治疗失败,也可能是增强的炎性反应、免疫应答。例如,使用易普利单抗治疗黑色素瘤时,炎性反应细胞浸润、肿瘤组织坏死等会造成治疗初期肿瘤体积的增大,但后续的治疗和评估证实了肿瘤负荷的降低[22]。在临床试验和实际应用中以上因素应被纳入考虑。
3.6 分子靶向药物分子靶向治疗(molecular targeted agents)指基于肿瘤的分子学特征选择相应的癌症治疗方案。恶性肿瘤的生长、播散有赖于细胞表面膜受体的活性,针对此类膜受体的药物统称为分子靶向药物。与免疫调节剂不同,这类药物的靶点均位于肿瘤细胞表面。2019版《指南》重点讨论了表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor, EGFR TKI)、BRAF抑制剂、人类表皮生长因子受体2(human epidermal growth factor receptor-2, HER2)和血管内皮生长因子(vascular endothelial growth factor, VEGF)的靶向药治疗脑转移瘤的效果。结果显示,EGFR TKI阿法替尼在随机研究中未明显改善乳腺癌脑转移瘤患者的预后,且有较强的药物毒性[23]。类似地,虽然一项非随机对照试验显示WBRT加用EGFR TKI埃罗替尼可以改善NSCLC脑转移患者的治疗转归[24](Ⅱ类证据),但另外两项独立的研究(Ⅰ类证据和Ⅱ类证据)提示埃罗替尼无治疗获益[25],还有较强的药物毒性[26]。因此,2019版《指南》尚不推荐将阿法替尼用于乳腺癌脑转移患者的治疗(1级推荐,Ⅰ类证据)。同时,也没有足够证据推荐埃罗替尼和吉非替尼用作NSCLC脑转移的治疗。2019版《指南》还指出,虽然BRAF抑制剂达拉非尼和维莫非尼用于黑色素瘤脑转移患者治疗的小规模研究显示出了一定的安全性和有效性[27-28](Ⅲ类证据),但尚没有足够证据推荐达拉非尼和维莫非尼用作黑色素瘤脑转移的治疗。因此,没有足够证据推荐HER2靶向药曲妥珠单抗和拉帕替尼用于乳腺癌脑转移,也没有足够证据推荐VEGF靶向药贝伐珠单抗、舒尼替尼和索拉非尼用于实体瘤脑转移。
值得一提的是,靶向药物治疗脑转移瘤的疗效评估常受化疗药、其他靶向药和系统性治疗的影响,有时难以评估特定药物的疗效。其次,虽然多数脑转移瘤的分子特征与原发肿瘤相似,可继续使用针对原发肿瘤的靶向药,但也有研究显示ER阳性乳腺癌的转移灶中高达13%的转移瘤细胞ER测定结果与原发肿瘤不一致[29],有必要在用药前对转移灶进行分子特征评估。再者,不同类型的原发肿瘤对靶向药物有不同的敏感度,而同类型原发肿瘤的不同亚型对药物的反应亦可能有显著差异。此外,未纳入2019版《指南》文献回顾范围的靶向药(如PARP抑制剂和PI3K抑制剂等)对脑转移瘤治疗的价值尚有待研究。
3.7 指南中未提及的新型疗法肿瘤电场治疗(tumor-treating fields, TTF)已用于胶质母细胞瘤的治疗,通过体表装置发出特定电场频率干扰细胞分裂可抑制肿瘤增长并显著延长胶质母细胞瘤患者的总生存期[30];高频率不可逆电穿孔(high-frequency irreversible electroporation, H-FIRE)也已用于原发性脑肿瘤的治疗研究[31],但这些新型治疗方法尚未纳入2019版《指南》讨论范围,其疗效有待于后续临床试验阐明。
4 结语和展望脑转移瘤仍是威胁人类健康的重要疾患。手术、放疗和化疗仍然是脑转移瘤的主要治疗策略,但基于肿瘤特点的全身性治疗和局部治疗在某些恶性肿瘤脑转移灶的控制方面崭露头角。然而,2019版《指南》回顾的文献尚不足以支持上述新型疗法用于脑转移瘤的治疗,亟待进一步研究来确定其在脑转移瘤治疗中的风险及获益。由此可见,迫切需要针对单一药物或治疗方法、设计良好的大规模随机对照临床试验来揭示新型疗法对特定类型脑转移瘤的治疗价值,以改善脑转移瘤患者的预后。
作者贡献
汤韫钰:文稿设计与撰写
范存刚:文稿设计、审阅及指导
刘如恩:文稿指导
| [1] |
Moore AJ, Newell DW. Neurosurgery: Principles and Practice[M].//Amin-Hanjani S, Harsh GR. Tumors: Cerebral Metastases and Lymphoma. London: Springer London, 2005: 281-297.
|
| [2] |
Soffietti R, Abacioglu U, Baumert B, et al. Diagnosis and treatment of brain metastases from solid tumors: guidelines from the European Association of Neuro-Oncology (EANO)[J]. Neuro Oncol, 2017, 19(2): 162-174. DOI:10.1093/neuonc/now241 |
| [3] |
Kalkanis SN, Linskey ME. Evidence-based clinical practice parameter guidelines for the treatment of patients with metastatic brain tumors: introduction[J]. J Neurooncol, 2010, 96(1): 7-10. DOI:10.1007/s11060-009-0065-4 |
| [4] |
范存刚, 张庆俊. 解读2010年AANS/CNS《脑转移瘤治疗的循证医学指南》[J]. 中华神经外科杂志, 2010, 26(11): 1047-1049. [Fan CG, Zhang QJ. Interpretation of the AANS/CNS management of brain metastases evidence-based clinical practice parameter guidelines[J]. Zhonghua Shen Jing Wai Ke Za Zhi, 2010, 26(11): 1047-1049. DOI:10.3760/cma.j.issn.1001-2346.2010.11.031] |
| [5] |
Elder JB, Nahed BV, Linskey ME, et al. Congress of Neurological Surgeons Systematic Review and Evidence-Based Guidelines on the Role of Emerging and Investigational Therapties for the Treatment of Adults With Metastatic Brain Tumors[J]. Neurosurgery, 2019, 84(3): E201-E203. DOI:10.1093/neuros/nyy547 |
| [6] |
Gaspar LE, Mehta MP, Patchell RA, et al. The role of whole brain radiation therapy in the management of newly diagnosed brain metastases: a systematic review and evidence-based clinical practice guideline[J]. J Neurooncol, 2010, 96(1): 17-32. DOI:10.1007/s11060-009-0060-9 |
| [7] |
Ter HaaR G. HIFU Tissue Ablation: Concept and Devices[J]. Adv Exp Med Biol, 2016, 880: 3-20. |
| [8] |
Mauri G, Nicosia L, Xu Z, et al. Focused ultrasound: tumour ablation and its potential to enhance immunological therapy to cancer[J]. Br J Radiol, 2018, 91(1083): 20170641. |
| [9] |
Hong CS, Deng D, Vera A, et al. Laser-interstitial thermal therapy compared to craniotomy for treatment of radiation necrosis or recurrent tumor in brain metastases failing radiosurgery[J]. J Neurooncol, 2019, 142(2): 309-317. DOI:10.1007/s11060-019-03097-z |
| [10] |
Rao MS, Hargreaves EL, Khan AJ, et al. Magnetic resonance-guided laser ablation improves local control for postradiosurgery recurrence and/or radiation necrosis[J]. Neurosurgery, 2014, 74(6): 658-667. |
| [11] |
Leuthardt EC, Duan C, Kim MJ, et al. Hyperthermic Laser Ablation of Recurrent Glioblastoma Leads to Temporary Disruption of the Peritumoral Blood Brain Barrier[J]. PLoS One, 2016, 11(2): e0148613. DOI:10.1371/journal.pone.0148613 |
| [12] |
Mehta MP, Shapiro WR, Phan SC, et al. Motexafin gadolinium combined with prompt whole brain radiotherapy prolongs time to neurologic progression in non-small-cell lung cancer patients with brain metastases: results of a phase Ⅲ trial[J]. Int J Radiat Oncol Biol Phys, 2009, 73(4): 1069-1076. DOI:10.1016/j.ijrobp.2008.05.068 |
| [13] |
Cao KI, Lebas N, Gerber S, et al. Phase Ⅱ randomized study of whole-brain radiation therapy with or without concurrent temozolomide for brain metastases from breast cancer[J]. Ann Oncol, 2015, 26(1): 89-94. DOI:10.1093/annonc/mdu488 |
| [14] |
Rojas-Puentes LL, Gonzalez-Pinedo M, Crismatt A, et al. Phase Ⅱ randomized, double-blind, placebo-controlled study of whole-brain irradiation with concomitant chloroquine for brain metastases[J]. Radiat Oncol, 2013, 8: 209. DOI:10.1186/1748-717X-8-209 |
| [15] |
Ruge M I, Kickingereder P, Grau S, et al. Stereotactic biopsy combined with stereotactic (125)iodine brachytherapy for diagnosis and treatment of locally recurrent single brain metastases[J]. J Neurooncol, 2011, 105(1): 109-118. DOI:10.1007/s11060-011-0571-z |
| [16] |
Brem S, Meyers CA, Palmer G, et al. Preservation of neurocognitive function and local control of 1 to 3 brain metastases treated with surgery and carmustine wafers[J]. Cancer, 2013, 119(21): 3830-3838. DOI:10.1002/cncr.28307 |
| [17] |
Ruge MI, Kocher M, Maarouf M, et al. Comparison of stereotactic brachytherapy (125 iodine seeds) with stereotactic radiosurgery (LINAC) for the treatment of singular cerebral metastases[J]. Strahlenther Onkol, 2011, 187(1): 7-14. DOI:10.1007/s00066-010-2168-4 |
| [18] |
郭建贵, 牟永告. 胶质瘤的过继细胞免疫治疗[J]. 中国神经肿瘤杂志, 2013, 11(1): 53-57. [Guo JG, Mu YG. Adoptive Immunotherapy for Glioma[J]. Zhongguo Shen Jing Zhong Liu Za Zhi, 2013, 11(1): 53-57.] |
| [19] |
Robert C, Long GV, Brady B, et al. Nivolumab in previously untreated melanoma without BRAF mutation[J]. N Engl J Med, 2015, 372(4): 320-330. DOI:10.1056/NEJMoa1412082 |
| [20] |
Carlino MS, Long GV, Schadendorf D, et al. Outcomes by line of therapy and programmed death ligand 1 expression in patients with advanced melanoma treated with pembrolizumab or ipilimumab in KEYNOTE-006: A randomised clinical trial[J]. Eur J Cancer, 2018, 101: 236-243. DOI:10.1016/j.ejca.2018.06.034 |
| [21] |
Queirolo P, Spagnolo F, Ascierto PA, et al. Efficacy and safety of ipilimumab in patients with advanced melanoma and brain metastases[J]. J Neurooncol, 2014, 118(1): 109-116. |
| [22] |
Di Giacomo AM, Danielli R, Guidoboni M, et al. Therapeutic efficacy of ipilimumab, an anti-CTLA-4 monoclonal antibody, in patients with metastatic melanoma unresponsive to prior systemic treatments: clinical and immunological evidence from three patient cases[J]. Cancer Immunol Immunother, 2009, 58(8): 1297-1306. DOI:10.1007/s00262-008-0642-y |
| [23] |
Cortés J, Dieras V, Ro J, et al. Afatinib alone or afatinib plus vinorelbine versus investigator's choice of treatment for HER2-positive breast cancer with progressive brain metastases after trastuzumab, lapatinib, or both (LUX-Breast 3): a randomised, open-label, multicentre, phase 2 trial[J]. Lancet Oncol, 2015, 16(16): 1700-1710. DOI:10.1016/S1470-2045(15)00373-3 |
| [24] |
Zhuang H, Yuan Z, Wang J, et al. Phase Ⅱ study of whole brain radiotherapy with or without erlotinib in patients with multiple brain metastases from lung adenocarcinoma[J]. Drug Des Devel Ther, 2013, 7: 1179-1186. |
| [25] |
Lee SM, Lewanski CR, Counsell N, et al. Randomized trial of erlotinib plus whole-brain radiotherapy for NSCLC patients with multiple brain metastases[J]. J Natl Cancer Inst, 2014, 106(7): pii: dju151. |
| [26] |
Sperduto PW, Wang M, Robins HI, et al. A phase 3 trial of whole brain radiation therapy and stereotactic radiosurgery alone versus WBRT and SRS with temozolomide or erlotinib for non-small cell lung cancer and 1 to 3 brain metastases: Radiation Therapy Oncology Group 0320[J]. Int J Radiat Oncol Biol Phys, 2013, 85(5): 1312-1318. DOI:10.1016/j.ijrobp.2012.11.042 |
| [27] |
Azer MW, Menzies AM, Haydu LE, et al. Patterns of response and progression in patients with BRAF-mutant melanoma metastatic to the brain who were treated with dabrafenib[J]. Cancer, 2014, 120(4): 530-536. DOI:10.1002/cncr.28445 |
| [28] |
Dummer R, Goldinger SM, Turtschi CP, et al. Vemurafenib in patients with BRAF(V600) mutation-positive melanoma with symptomatic brain metastases: final results of an open-label pilot study[J]. Eur J Cancer, 2014, 50(3): 611-621. DOI:10.1016/j.ejca.2013.11.002 |
| [29] |
Lindstrom LS, Karlsson E, Wilking UM, et al. Clinically used breast cancer markers such as estrogen receptor, progesterone receptor, and human epidermal growth factor receptor 2 are unstable throughout tumor progression[J]. J Clin Oncol, 2012, 30(21): 2601-2608. DOI:10.1200/JCO.2011.37.2482 |
| [30] |
Fabian D, Guillermo Prieto Eibl MDP, Alnahhas I, et al. Treatment of Glioblastoma (GBM) with the Addition of Tumor-Treating Fields (TTF): A Review[J]. Cancers (Basel), 2019, 11(2): pii: E174. DOI:10.3390/cancers11020174 |
| [31] |
Rossmeisl JH Jr, Garcia PA, Pancotto TE, et al. Safety and feasibility of the NanoKnife system for irreversible electroporation ablative treatment of canine spontaneous intracranial gliomas[J]. J Neurosurg, 2015, 123(4): 1008-1025. DOI:10.3171/2014.12.JNS141768 |
 2020, Vol. 47
2020, Vol. 47


