文章信息
- 癌性疼痛患者营养状况与血清C反应蛋白的相关性
- Correlation Between Nutritional Status and Serum C-reactive Protein in Patients with Cancer Pain
- 肿瘤防治研究, 2020, 47(5): 372-375
- Cancer Research on Prevention and Treatment, 2020, 47(5): 372-375
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1250
- 收稿日期: 2019-10-09
- 修回日期: 2020-01-14
肿瘤已成为全球发病率及死亡率最高的疾病之一,癌性疼痛、营养不良、全身炎性反应是肿瘤患者常见的伴发症状,对患者生活质量和临床结局造成较大影响[1]。血清C反应蛋白(C-reactive protein, CRP)是全身性炎性反应的代表,炎性反应与肿瘤之间相互诱导。目前,关于癌性疼痛患者血清CRP水平与营养不良关系的报道很少。本研究旨在通过评价不同疼痛程度患者营养状态、炎性反应水平等各项指标的差异及相关性,以期为临床肿瘤治疗提供科学依据。
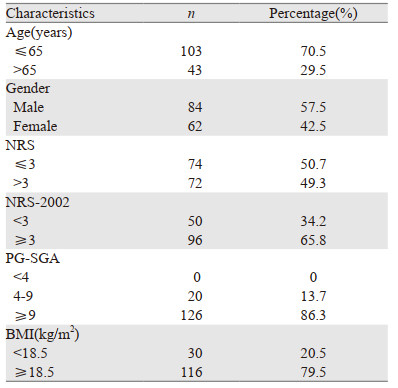
1 资料与方法 1.1 临床资料选择天津医科大学肿瘤医院2018年8月—2019年5月收治的146例癌痛患者为研究对象,其中,男84例,女62例,平均年龄60.3±10.1岁。
纳入标准:(1)18~90岁,有意识,无沟通障碍,可配合相关检查;(2)组织学诊断恶性肿瘤;(3)存在癌性疼痛持续l周以上。排除标准:(1)艾滋病患者或器官移植患者;(2)处于难以评估的危急情况;(3)有急性损伤、感染性发热或急性肝脏疾病等并发症;(4)患者拒绝回答或不能回答问题等无法进行营养评估。
1.2 方法采用统一的调查表,由经过培训的营养师在患者入院24 h之内完成对患者的营养状况测量和指标检测。
1.2.1 疼痛强度由患者自评,采用数字评分法(NRS)进行评估,以数字0~10来描述疼痛强度,0分为无痛,1~3分为轻度疼痛,4~6分为中度疼痛,7~10分为重度疼痛。
1.2.2 营养风险筛查采用NRS-2002进行风险筛查,总评分≥3分说明存在营养风险,< 3分为无营养风险。
1.2.3 患者主观整体评估(PG-SGA)包括两部分内容:第一部分为患者自评表,主要由体重、进食情况、症状体征、活动和身体功能四个方面组成,由患者自己完成,得分相加得到A评分。第二部分为医务人员评估表,包括疾病与营养需求的关系、代谢方面的需求、体格检查三个方面内容,评分分别记为B、C、D评分。PG-SGA定量评价总分=A+B+C+D评分。
1.2.4 身体测量指标身高、体重,并计算体质指数(BMI),握力(HGS)。
1.2.5 血液指标血清前白蛋白(PA)、总蛋白(TP)、白蛋白(ALB)、胆碱酯酶(CHE)、血红蛋白(HGB)、红细胞计数(RBC)、白细胞计数(WBC)、C反应蛋白(CRP)、中性粒细胞数量(N)、中性粒细胞比例(N%)、淋巴细胞计数(LYM)、淋巴细胞比例(LYM%)等。
1.3 统计学方法采用SPSS22.0软件进行统计学分析,符合正态分布的计量资料以x±s表示,两组间比较采用t检验,定量资料相关性分析采用Pearson相关分析。P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料146例患者的基本信息见表 1。
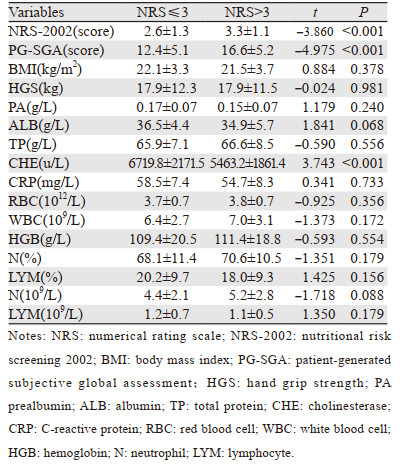
以NRS评分作为标准,分为轻度疼痛(NRS≤3)和中重度疼痛(NRS > 3)两组,两组患者NRS-2002、PG-SGA、胆碱酯酶差异均有统计学意义(均P < 0.05)。两组患者BMI、握力、前白蛋白、白蛋白、总蛋白、血红蛋白、C反应蛋白、中性粒细胞比例、淋巴细胞比例、中性粒细胞数量、红细胞、白细胞、淋巴细胞计数差异均无统计学意义(均P > 0.05),见表 2。
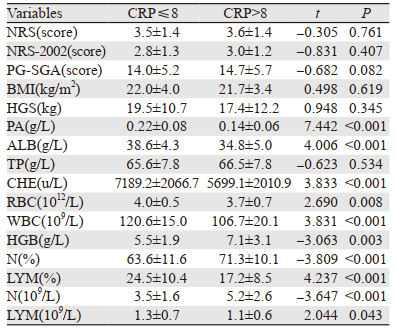
以C反应蛋白浓度作为标准,分为非炎性反应组(CRP≤8)和炎性反应组(CRP > 8),两组患者前白蛋白、白蛋白、血红蛋白、胆碱酯酶、白细胞、中性粒细胞比例、淋巴细胞总数差异均有统计学意义(均P < 0.05)。两组患者疼痛评分、NRS-2002、PG-SGA、BMI、总蛋白差异均无统计学意义(均P > 0.05),见表 3。
|
疼痛评分与胆碱酯酶、淋巴细胞总数、BMI呈负相关(P < 0.05),与NRS-2002、PG-SGA呈正相关(P < 0.05),见表 4。
C反应蛋白浓度与前白蛋白、白蛋白、胆碱酯酶、血红蛋白、淋巴细胞总数呈负相关(P < 0.05),与NRS-2002、PG-SGA呈正相关(P < 0.05),见表 5。
本研究结果显示,PG-SGA在癌性疼痛患者中具有更高的敏感度,这可能是由于PG-SGA患者自评表部分包括了进食情况、影响饮食的症状以及身体功能活动等,评估涉及的内容较NRS-2002更详细。此外,癌性疼痛患者因为疼痛本身及服用一些止疼药物引起的包括恶心、呕吐、食欲下降、便秘、活动减少等情况,会增加PG-SGA得分。因此,对于癌性疼痛患者进行营养状态评估时,建议先完成NRS-2002营养风险筛查,再进行PG-SGA评估,以便能同时提高营养评估的敏感度和特异性,为更准确地筛选出具有营养治疗适应证的患者,并给予规范的营养治疗提供科学依据。
关于不同癌性疼痛程度的营养状况及炎性反应的分析结果,发现轻度疼痛(NRS≤3)和中重度疼痛(NRS > 3)的患者NRS-2002、PG-SGA、胆碱酯酶差异均有统计学意义(均P < 0.05)。同时发现疼痛评分与胆碱酯酶、淋巴细胞总数、BMI呈负相关(P < 0.05),与NRS-2002、PG-SGA呈正相关(P < 0.05)。表明癌性疼痛与营养状况密切相关,疼痛程度越重,营养状况越差,免疫功能也会受到影响,与国外报道一致[2]。
近年来,癌症和炎性反应间的相关性已被广泛接受并成为一个热门的研究课题[3]。炎性反应是癌症的十大特征之一[4-5],它在不同的癌症中起着决定性的作用,包括肿瘤发生、侵袭和转移,导致患者的病情恶化[6-7]。与炎性反应相关的物质可用作炎性反应的标志物,血清C反应蛋白是被广泛接受的全身性炎性反应的代表。临床和实验室研究发现,许多恶性肿瘤患者血清C反应蛋白升高,提示恶性肿瘤、血清C反应蛋白和慢性炎性反应存在相关性[8],并且血清C反应蛋白升高可能代表癌症的进展或晚期阶段,对肿瘤进展及预后判断具有重要意义[9-10]。本研究显示,炎性反应组(CRP > 8)和非炎性反应组(CRP≤8)患者前白蛋白、白蛋白、血红蛋白、胆碱酯酶、白细胞、中性粒细胞比例、淋巴细胞总数差异均有统计学意义(均P < 0.05)。美国肠内与肠外营养学会推荐用于诊断成年人营养不良的标准中包括肌肉质量和肌肉力量的减少[11]。本研究发现,癌痛患者握力普遍下降,炎性反应组握力下降更明显,但两组差异无统计学意义。
本研究还发现随着患者血清CRP的升高,即机体应激状态越强烈,相应伴随着越低的前白蛋白、白蛋白、总蛋白、胆碱酯酶、血红蛋白、淋巴细胞总数,同时具备较高的NRS-2002和PG-SGA评分,提示炎性反应指数较高的患者相对营养状况较差。Alberici等的研究显示,C反应蛋白与患者营养状况存在相关[12-14]。以往的研究表明癌症患者血清C反应蛋白升高的发生率为24%~83%[15-17]。本研究结果显示,近75%的癌痛患者存在C反应蛋白水平升高。由此可见,癌性疼痛患者机体处于较严重的炎性反应应激状态,体内代谢状况发生改变,使患者静息能量消耗增加,从而加重营养不良[18]。
综上所述,癌性疼痛患者的营养风险和营养不良发生率都较高,因此需要及时、有效地对住院患者进行营养风险和营养不良筛查,综合评估其营养状况,对存在营养风险和营养不良的患者制定有针对性的营养治疗方案。同时,由于大部分癌痛患者处于较严重的应激状态,C反应蛋白浓度测定能为临床提供更多的实用信息,进而为癌症患者制定出更完善的诊治策略,以提高其生存率及生存质量。由于条件限制,本研究收集到的病例数相对较少,同时只研究了入院时癌痛患者营养状况与C反应蛋白的关系,对镇痛治疗后指标之间的变化未进行记录,我们将在后续的研究中进一步完善并加以阐述。
作者贡献
陈亚军:试验设计、数据收集、统计及文章撰写
李春蕾:数据整理与分析
曾亚奇、董杰、李玥莹:数据收集
张萍:数据校对
王昆:文章质量控制及审校
| [1] |
Sugimoto H, Kawashima H, Ohno E, et al. The prognostic factors and trajectory of HRQOL in patients with pancreatic cancer who received psychiatric intervention[J]. J Gastroenterol Hepatol, 2016, 31(3): 685-690. |
| [2] |
Chabowski M, Polański J, Jankowska-Polańska B, et al. Is nutritional status associated with the level of anxiety, depression and pain in patients with lung cancer?[J]. J Thorac Dis, 2018, 10(4): 2303-2310. DOI:10.21037/jtd.2018.03.108 |
| [3] |
MantovaniA, Allavena P, Sica A, et al. Cancer-related inflammation[J]. Nature, 2008, 454(7203): 436-444. DOI:10.1038/nature07205 |
| [4] |
Diakos CI, Charles KA, McMillan DC, et al. Cancer-related in?ammation and treatment effectiveness[J]. Lancet Oncol, 2014, 15(11): e493-503. DOI:10.1016/S1470-2045(14)70263-3 |
| [5] |
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646-674. DOI:10.1016/j.cell.2011.02.013 |
| [6] |
Dolan RD, McSorley ST, Horgan PG, et al. The role of the systemic inflammatory response in predicting outcomes in patients with advanced inoperable cancer: Systematic review and meta-analysis[J]. Crit Rev Oncol Hematol, 2017, 116: 134-146. DOI:10.1016/j.critrevonc.2017.06.002 |
| [7] |
Singh R, Mishra MK, Aggarwal H. Immunity, inflammation, and cancer[J]. Mediators Inflamm, 2017, 2017: 6027305. |
| [8] |
Li J, Wang C, Liu X, et al. Severe malnutrition evaluated by patient-generated subjective global assessment results in poor outcome among adult patients with acute leukemia: A retrospective cohort study[J]. Medicine(Baltimore), 2018, 97(3): e9663. |
| [9] |
胡昊昀, 周磊, 高翔, 等. C反应蛋白在肿瘤患者感染的诊断和病情监测中的价值[J]. 检验医学, 2016, 31(4): 253-257. [Hu HY, Zhou L, Gao X, et al. Significance of C-reactive protein in the diagnosis and disease monitoring among cancer patients with infection[J]. Jian Yan Yi Xue, 2016, 31(4): 253-257. DOI:10.3969/j.issn.1673-8640.2016.04.003] |
| [10] |
Shrotriya S, Walsh D, Nowacki AS, et al. Serum C-reactive protein is an important and powerful prognostic biomarker in most adult solid tumors[J]. PLoS One, 2018, 13(8): e0202555. DOI:10.1371/journal.pone.0202555 |
| [11] |
White JV, Guenter P, Jensen G, et al. Consensus statement of the Academy of Nutrition and Dietetics/American Society for Parenteral and Enteral nutrition: characteristics recommended for the identification and documentation of adult malnutrition (undernutrition)[J]. J Acad Nutr Diet, 2012, 112(5): 730-738. DOI:10.1016/j.jand.2012.03.012 |
| [12] |
Alberici Pastore C, Paiva Orlandi S, González MC. Association between an inflammatory- nutritional index and nutritional status in cancer patients[J]. Nutr Hosp, 2013, 28(1): 188-193. |
| [13] |
Yu JM, Yang M, Xu HX, et al. Association Between Serum C-Reactive Protein Concentration and Nutritional Status of Malignant Tumor Patients[J]. Nutr Cancer, 2019, 71(2): 240-245. |
| [14] |
Paulsen ø, Laird B, Aass N, et al. The relationship between pro-inflammatory cytokines and pain, appetite and fatigue in patients with advanced cancer[J]. PLoS One, 2017, 12(5): e0177620. DOI:10.1371/journal.pone.0177620 |
| [15] |
Deans DA, Tan BH, Wigmore SJ, et al. The influence of systemic inflammation, dietary intake and stage of disease on rate of weight loss in patients with gastro-oesophageal cancer[J]. Br J Cancer, 2009, 100(1): 63-69. |
| [16] |
Ishizuka M, Nagata H, Takagi K, et al. Inflammation-based prognostic score is a novel predictor of postoperative outcome in patients with colorectal cancer[J]. Ann Surg, 2007, 246(6): 1047-1051. DOI:10.1097/SLA.0b013e3181454171 |
| [17] |
Proctor MJ, Talwar D, Balmar SM, et al. The relationship between the presence and site of cancer, an inflammation-based prognostic score and biochemical parameters. Initial results of the Glasgow Inflammation Outcome Study[J]. Br J Cancer, 2010, 103(6): 870-876. DOI:10.1038/sj.bjc.6605855 |
| [18] |
Gangadharan A, Choi SE, Hassan A, et al. Protein calorie malnutrition, nutritional intervention and personalized cancer care[J]. Oncotarget, 2017, 8(14): 24009-24030. DOI:10.18632/oncotarget.15103 |
 2020, Vol. 47
2020, Vol. 47