文章信息
- 肺癌合并静脉血栓栓塞症患者的诊疗特点
- Diagnosis and Treatment Characteristics of Lung Cancer Patients with Venous Thromboembolism
- 肿瘤防治研究, 2020, 47(5): 335-339
- Cancer Research on Prevention and Treatment, 2020, 47(5): 335-339
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1243
- 收稿日期: 2019-10-09
- 修回日期: 2020-03-04
静脉血栓栓塞症(venous thromboembolism, VTE)包括深静脉血栓(deep venous thrombosis, DVT)和肺栓塞(pulmonary embolism, PTE),是肿瘤患者常见的并发症之一[1-2]。VTE的发生往往提示肿瘤患者的预后较差[3]。有研究表明,VTE是肿瘤患者第二大死亡原因[4]。在活动性肿瘤尤其是肺癌活动期患者中,VTE的发生风险可能更高[5]。因此,肺癌患者合并VTE越来越受到关注。目前国内研究主要集中在肺癌围术期血栓和肺癌患者住院期间发生的血栓[6-7],也有文献报道了肺癌患者合并VTE的临床特征和危险因素分析[8-10],本研究重点关注肺癌患者在抗肿瘤诊治全程中VTE的发生情况、治疗现状以及预后,并进一步从抗肿瘤治疗的角度,分析VTE对肺癌患者的抗肿瘤治疗方案的影响,从而为肺癌合并VTE患者的诊断、治疗和管理提供参考。
1 资料与方法 1.1 临床资料收集北京大学肿瘤医院胸部肿瘤内二科2012年9月—2019年8月间收治的所有肺癌患者的临床资料,筛选出其中发生VTE的患者。
入选标准:(1)经病理证实为肺癌的患者,包括非小细胞肺癌、小细胞肺癌和部分肺神经内分泌肿瘤; (2)接受过针对肺癌的抗肿瘤治疗,包括手术、化疗、放疗、靶向药或免疫治疗等; (3)不论是否有症状,必须有经影像学证实的VTE。以上三条标准须同时满足。
排除标准:(1)临床诊断疑似肺癌,但尚未经病理确诊; (2)肺部良性肿瘤; (3)没有进行过抗肿瘤治疗; (4)临床疑似VTE,但未经影像学确诊; (5)临床资料严重缺失、不完整的。以上五条标准中满足任意一条,即被排除。
1.2 VTE的诊断标准及疗效评价标准肺栓塞的诊断按照2018年中华医学会呼吸病分会制定的《肺血栓栓塞症诊治与预防指南》诊断标准:(1)存在肺血栓栓塞症发生危险因素; (2)有呼吸困难、呼吸急促、胸痛或晕厥等临床表现; (3)螺旋CT肺动脉造影(CTPA)、核素V/Q显像、磁共振肺动脉造影(MRPA)或肺动脉造影(PAA)等任何一项检查阳性即可确诊。深静脉血栓经加压静脉超声(CUS)、CT静脉造影或核磁静脉显像、静脉造影确诊。
肺栓塞疗效评价标准:(1)显效:呼吸困难、胸痛等症状明显减轻或消失,动脉氧分压上升 > 75%,CT或核素CT扫描(ECT)显示:肺动脉段血栓或缺损肺段减少 > 75%;(2)有效:呼吸困难、胸痛等症状较前减轻或消失,动脉氧分压上升50%~75%,CT或ECT显示:肺动脉段血栓或缺损肺段减少50%~75%;(3)无效:呼吸困难、胸痛等症状无明显减轻,动脉氧分压无明显上升,CT或ECT显示:肺动脉段血栓或缺损肺段无明显变化; (4)恶化(死亡):呼吸困难、胸痛等症状进行性加重,动脉氧分压进行性下降,CT或ECT显示:肺动脉段血栓或缺损肺段较前增加。
深静脉血栓的疗效评价标准:显效:临床症状基本消失,肢体周径正常,影像学检查未见血栓; 有效:肢体周径差显著缩小,临床症状改善,影像学检查发现血栓附壁; 无效:症状及相关指标未见好转甚至加重,影像学检查发现新生血栓。总有效率=(显效+有效)例数/总例数×100%。
1.3 研究方法回顾性分析肺癌合并VTE的患者信息,收集肺癌合并VTE患者的临床数据,包括姓名、性别、年龄、肺癌的病理诊断、肿瘤分期、VTE的诊断、VTE是否在抗肿瘤治疗期间发生、VTE对于抗肿瘤治疗的影响、VTE是否有症状、抗血栓治疗方案、效果及不良反应等。
1.4 统计学方法采用SPSS21.0软件进行统计学分析。连续变量用中位数或者均值±标准差表示,分类变量用计数及百分数表示。
1.5 伦理学审核本研究为回顾性研究,对患者无干预。所有流程符合本医院伦理标准及赫尔辛基宣言。所有患者治疗前均已签署知情同意书。
2 结果 2.1 基线资料根据入排标准,从1 766例肺癌患者中筛选出VTE阳性患者115例(6.5%),其中男78例(67.8%),女37例(32.2%),年龄27~79岁,中位年龄61岁。肺腺癌76例(66.1%),肺鳞癌19例(16.5%),小细胞肺癌13例(11.3%),其他或者分型不明确肺癌7例(6.1%)。Ⅰ~Ⅲ期36例(31.3%),Ⅳ期79例(68.7%)。
2.2 VTE的发生情况115例肺癌患者中,深静脉血栓82例(71.3%),肺栓塞21例(18.3%),肺栓塞合并深静脉血栓12例(10.4%)。症状型VTE患者74例(64.3%),无症状型VTE患者41例(35.7%)。27例(23.5%)发生在抗肿瘤治疗开始之前或者治疗结束后的随访期内,88例(76.5%)发生在抗肿瘤治疗期间。
2.3 VTE的治疗情况115例中有102例(88.7%)患者进行了抗血栓治疗,6例(5.2%)未进行抗血栓治疗,7例(6.1%)患者抗血栓治疗情况不详。
2.3.1 抗血栓治疗方案在102例进行抗血栓治疗的患者中,5例(4.9%)采用非药物治疗(支架治疗),97例(95.1%)应用抗凝药物治疗。
在97例抗凝药物治疗中,应用溶栓治疗2例,选择低分子肝素治疗81例,选择新型口服抗凝药13例,选择华法林1例。65例(67.0%)患者接受了足量或标准剂量的规范抗凝治疗,32例(33.0%)患者的药物未给予足量或标准剂量。
2.3.2 VTE的预后情况52例(45.2%)VTE患者经治疗后显效或有效,32例(27.8%)患者无效,31例(27.0%)患者血栓情况未复查或者不详。
2.3.3 抗血栓治疗的不良反应11例(9.6%)患者在抗血栓治疗中出现不良反应,其中9例发生出血,1例出现血小板下降伴肝功能异常,1例出现皮疹。
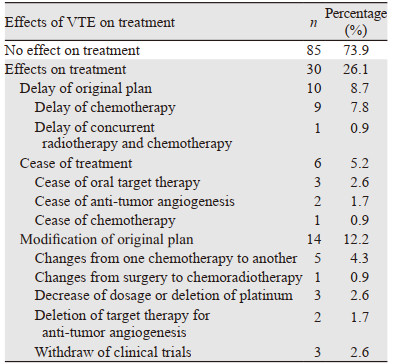
2.4 VTE对于抗肿瘤治疗的影响115例患者中,85例(73.9%)患者未因VTE的发生影响抗肿瘤治疗方案,30例(26.1%)患者因VTE的发生影响了原抗肿瘤治疗,见表 1。
肿瘤相关血栓(cancer-associated thrombosis, CAT)在不同类型肿瘤中的发生风险存在差别,其中肺癌患者发生VTE的风险较高[11]。有研究报道肺癌合并VTE的发生率为1.4%~13.9%[12-13]。本研究中,肺癌患者VTE的发生率为6.5%,略高于国内杜晖等报道的5.2%[6],但是低于国内由王辰院士牵头的中国血栓研究组报道的13.2%[7]。考虑原因可能为:(1)本研究为回顾性研究,仅收集已经发生VTE的患者,而并不会对患者进行血栓筛查,因此,可能造成VTE的漏诊。(2)本研究中,症状型VTE占64.3%,无症状者占35.7%,这与国内许小毛等报道的肺癌患者中40.0%的肺栓塞为偶然发现结果相近[8]。实际临床中有很多肺癌患者可能存在VTE,但是因为没有明显的临床症状,比如呼吸困难和肢体肿胀,并没有进行相关的血栓筛查,从而造成VTE的漏诊。本研究中大部分(88.7%)患者都进行了抗血栓治疗,但是仍有11.3%的患者未进行抗血栓治疗或者治疗情况不详。肺癌患者在明确已发生VTE的情况下未进行抗血栓治疗的原因可能包括两方面:(1)肺癌与VTE同时存在造成治疗的复杂性。所有的抗凝治疗都存在出血风险[14],患者在接受抗肿瘤治疗尤其是化疗时、肺癌发生骨髓转移时都可能出现血小板减少,导致出血风险的增加,所以肿瘤科医生在权衡利弊后可能选择不进行抗血栓治疗。(2)肿瘤科医生本身对VTE的关注不足,如果患者无明显症状,往往以抗肿瘤治疗为主,不再进行抗凝治疗,同时也担心出血等不良反应会影响到患者的整体抗肿瘤治疗。本研究中只有67.0%的患者使用足量或标准剂量抗凝药物治疗,这也说明,由于肺癌患者本身疾病特点或者医生出于对患者出血风险的担心,可能导致抗凝药物减量使用。关于抗凝药物出血等不良反应的风险,本研究中7.8%的患者发生出血事件,高于国外报道的抗凝药物低分子肝素用于治疗CAT时2%~4%的出血事件发生率和新型口服抗凝药用于CAT时0~7%的出血事件发生率[15-16]。因此,肺癌患者的抗凝治疗选择存在更多的复杂性,需要充分评估抗凝治疗的获益和风险后进行个体化的治疗。
抗血栓治疗效果方面,本研究中只有45.2%的患者VTE治疗显效或者有效,而27.8%的患者无效或者恶化,而有报道显示CAT复发风险为3.4%~14.1%[15-17]。本研究中VTE治疗的有效率不高的原因可能包括:(1)肺癌患者本身存在高凝状态,化疗等抗肿瘤治疗周期长,血栓复发风险高; (2)抗凝治疗不规范,抗凝药物剂量不足或者疗程不足。关于抗凝治疗疗程,不同的指南建议略有不同:无抗凝禁忌证者推荐治疗疗程至少3~6月,活动期肿瘤建议终身抗凝,导管相关血栓至少3月或与置管时间相同[18-21]。
关于VTE对于抗肿瘤治疗的影响,国内外相关研究较少。本研究中,26.1%的患者因为VTE而影响原抗肿瘤治疗方案,即导致原计划进行的抗肿瘤治疗方案调整或者正在进行的抗肿瘤治疗方案推迟、甚至原方案终止。(1)抗肿瘤治疗方案推迟的原因:患者在抗肿瘤治疗过程中发生VTE时,处于血栓急性期,患者可能有明显胸闷等症状,如不及时处理甚至危及生命,而肿瘤属于慢性病,因此抗肿瘤治疗方案暂时停止,先处理VTE,待患者VTE稳定后继续抗肿瘤治疗; (2)抗肿瘤治疗方案调整的原因:肺癌的治疗方案中常用化疗联合抗血管生成类药物,如贝伐珠单抗等。有研究报道,贝伐珠单抗与癌症患者发生VTE的风险增加相关[22]。因此,会停用抗血管生成类药物。另外化疗药物中的顺铂可能也与血栓形成有关,因此在调整方案时可能会减量或停用铂类药物。部分患者从临床试验出组,原因为VTE中有的发生了严重不良事件,故按照研究方案规定出组; (3)抗肿瘤治疗终止的原因考虑为:① VTE的发生导致患者一般情况较差,无法继续耐受抗肿瘤治疗; ② VTE可能是肿瘤进展或者肿瘤终末期的表现,后续已无有效的抗肿瘤治疗方案。总之,本研究表明肺癌患者一旦发生VTE,可能严重影响其抗肿瘤治疗。因此,有必要针对高血栓风险的肺癌患者进行有效分层并采取预防措施。目前,肿瘤相关血栓的预防性抗凝研究已经或者正在进行[23],期望进一步降低肿瘤患者的VTE发生率,改善患者的预后。
本研究仍有一些局限性和不足:(1)本研究数据来自北京大学肿瘤医院的单中心,样本量不够大,数据可能存在偏倚,因此需要进行多中心的协同研究。(2)本研究为回顾性分析,在血栓发生率的统计方面可能低于实际情况,因此需要开展前瞻性的真实世界观察研究,数据才能更加准确完善。(3)本研究描述肺癌患者发生VTE的情况,但未具体分析哪些因素,尤其是哪些抗肿瘤治疗药物与VTE的发生有关。因此下一步可设立肺癌不合并VTE的患者进行对照,分析VTE发生的危险因素。(4)本研究总体探讨了VTE对肺癌患者抗肿瘤治疗的影响,但肺癌的治疗过程和药物使用情况较为复杂,难以具体分类分析。
综上所述,VTE是肺癌患者的常见并发症,大部分因为有临床症状而被发现。肺癌合并VTE患者的抗血栓治疗情况复杂,治疗效果不理想,出血等不良反应风险较高,严重影响原定抗肿瘤治疗方案的实施,应引起临床的重视。
作者贡献
马旭:提出研究思路及文章撰写
韩森:数据统计和文章撰写
聂鋆、戴玲、胡维亨、陈筱玲、张洁、马向娟、田广明、吴頔、龙皆然、韩金娣、王洋、张自然:收集资料
张艳华、王丹:实验工作的协调和技术指导
方健:实验统筹和文章审阅
| [1] |
Timp JF, Braekkan SK, Versteeg HH, et al. Epidemiology of cancer-associated venous thrombosis[J]. Blood, 2013, 122(10): 1712-1723. DOI:10.1182/blood-2013-04-460121 |
| [2] |
Heit JA, Spencer FA, White RH. The epidemiology of venous thromboembolism[J]. J Thromb Thrombolysis, 2016, 41(1): 3-14. DOI:10.1007/s11239-015-1311-6 |
| [3] |
Chew HK, Wun T, Harvey D, et al. Incidence of venous thromboembolism and its effect on survival among patients with common cancers[J]. Arch Intern Med, 2006, 166(4): 458-464. DOI:10.1001/archinte.166.4.458 |
| [4] |
Khorana AA. Venous thromboembolism and prognosis in cancer[J]. Thromb Res, 2010, 125(6): 490-493. DOI:10.1016/j.thromres.2009.12.023 |
| [5] |
Streiff MB. Association between cancer types, cancer treatments, and venous thromboembolism in medical oncology patients[J]. Clin Adv Hematol Oncol, 2013, 11(6): 349-357. |
| [6] |
杜晖, 赵洪林, 李梅, 等. 肺癌患者入院时下肢深静脉血栓的发生率及相关危险因素分析[J]. 中国肺癌杂志, 2018, 21(10): 761-766. [Du H, Zhao HL, Li M, et al. Analysis of incidence of lower extremity venous thrombosis and its related risk factors in admitted patients with lung cancer[J]. Zhongguo Fei Ai Za Zhi, 2018, 21(10): 761-766. DOI:10.3779/j.issn.1009-3419.2018.10.05] |
| [7] |
Zhang Y, Yang Y, Chen W, et al. Prevalence and associations of VTE in patients with newly diagnosed lung cancer[J]. Chest, 2014, 146(3): 650-658. |
| [8] |
孙薇, 王海燕, 文仲光, 等. 肺癌并发肺栓塞患者的临床特征[J]. 中华结核和呼吸杂志, 2016, 39(3): 198-202. [Sun W, Wang HY, Wen ZG, et al. Clinical characteristics of lung cancer complicated with pulmonary embolism[J]. Zhonghua Jie He He Hu Xi Za Zhi, 2016, 39(3): 198-202. DOI:10.3760/cma.j.issn.1001-0939.2016.03.012] |
| [9] |
许小毛, 杨鹤, 乔立松, 等. 肺癌合并静脉血栓栓塞症患者的临床特点及预后分析[J]. 中华医学杂志, 2014, 94(26): 2045-2049. [Xu XM, Yang H, Qiao LS, et al. Clinical characteristic and outcomes of lung cancer patients with venous thromboembolise[J]. Zhonghua Yi Xue Za Zhi, 2014, 94(26): 2045-2049. DOI:10.3760/cma.j.issn.0376-2491.2014.26.011] |
| [10] |
龚长艳, 李智文, 周德训, 等. 肺癌患者症状性静脉血栓栓塞症危险因素分析[J]. 中华结核和呼吸杂志, 2016, 39(6): 454-458. [Gong CY, Li ZW, Zhou DX, et al. Risk factors of lung cancer complincated with symptomatic venous thromboembolism[J]. Zhonghua Jie He He Hu Xi Za Zhi, 2016, 39(6): 454-458. DOI:10.3760/cma.j.issn.1001-0939.2016.06.010] |
| [11] |
Corrales-Rodriguez L, Blais N. Lung cancer associated venous thromboembolic disease: a comprehensive review[J]. Lung Cancer, 2012, 75(1): 1-8. |
| [12] |
Khorana AA, Francis CW, Culakova E, et al. Frequency, risk factors, and trends for venous thromboembolism among hospitalized cancer patients[J]. Cancer, 2007, 110(10): 2339-2346. DOI:10.1002/cncr.23062 |
| [13] |
Connolly GC, Dalal M, Lin J, et al. Incidence and predictors of venous thromboembolism (VTE) among ambulatory patients with lung cancer[J]. Lung Cancer, 2012, 78(3): 253-258. |
| [14] |
Zamorano JL, Lancellotti P, Rodriguez Muñoz D, et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC)[J]. Eur Heart J, 2016, 37(36): 2768-2801. DOI:10.1093/eurheartj/ehw211 |
| [15] |
Raskob GE, van Es N, Verhamme P, et al. Edoxaban for the Treatment of Cancer-Associated Venous Thromboembolism[J]. N Engl J Med, 2018, 378(7): 615-624. DOI:10.1056/NEJMoa1711948 |
| [16] |
Young AM, Marshall A, Thirlwall J, et al. Comparison of an Oral Factor Xa Inhibitor With Low Molecular Weight Heparin in Patients With Cancer With Venous Thromboembolism: Results of a Randomized Trial (SELECT-D)[J]. J Clin Oncol, 2018, 36(20): 2017-2023. DOI:10.1200/JCO.2018.78.8034 |
| [17] |
McBane RD 2nd, Wysokinski WE, Le-Rademacher JG, et al. Apixaban and dalteparin in active malignancy-associated venous thromboembolism: The ADAM VTE trial[J]. J Thromb Haemost, 2020, 18(2): 411-421. DOI:10.1111/jth.14662 |
| [18] |
Watson HG, Keeling DM, Laffan M, et al. Guideline on aspects of cancer-related venous thrombosis[J]. Br J Haematol, 2015, 170(5): 640-648. DOI:10.1111/bjh.13556 |
| [19] |
Kearon C, Akl EA, Ornelas J, et al. Antithrombotic Therapy for VTE Disease: CHEST Guideline and Expert Panel Report[J]. Chest, 2016, 149(2): 315-352. |
| [20] |
Farge D, Bounameaux H, Brenner B, et al. International clinical practice guidelines including guidance for direct oral anticoagulants in the treatment and prophylaxis of venous thromboembolism in patients with cancer[J]. Lancet Oncol, 2016, 17(10): e452-e466. DOI:10.1016/S1470-2045(16)30369-2 |
| [21] |
NCCN.Cancer-Associated Venous Thromboembolic Disease(Version 1.2019)[EB/OL].Fort Washington: NCCN, [2019-02-28]. https://www.nccn.org/professionals/physician_gls/default.asp.
|
| [22] |
Nalluri SR, Chu D, Keresztes R, et al. Risk of venous thromboembolism with the angiogenesis inhibitor bevacizumab in cancer patients: a meta-analysis[J]. JAMA, 2008, 300(19): 2277-2285. DOI:10.1001/jama.2008.656 |
| [23] |
Barbarawi M, Zayed Y, Kheiri B, et al. The role of anticoagulation in venous thromboembolism primary prophylaxis in patients with malignancy: A systematic review and meta-analysis of randomized controlled trials[J]. Thromb Res, 2019(181): 36-45. |
 2020, Vol. 47
2020, Vol. 47