文章信息
- 循环肿瘤细胞数量变化在预测局限性肾癌术后复发转移中的作用
- Effect of Change in Circulating Tumor Cell Counts in Predicting Postoperative Recurrence and Metastasis of Localized Renal Carcinoma
- 肿瘤防治研究, 2020, 47(2): 112-114
- Cancer Research on Prevention and Treatment, 2020, 47(2): 112-114
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1236
- 收稿日期: 2019-10-08
- 修回日期: 2019-12-10
2. 442000 十堰,湖北医药学院附属人民医院骨科中心;
3. 442000 十堰,湖北医药学院附属十堰市太和医院泌尿外科
2. Department of Orthopedic Center, Renming Hospital, Hubei University of Medicine, Shiyan 442000, China;
3. Department of Urinary Surgery, Taihe Hospital, Hubei University of Medicine, Shiyan 442000, China
肾癌是起源于肾实质泌尿小管上皮系统的恶性肿瘤,发病率仅次于膀胱癌,但死亡率位居泌尿生殖系统首位,占成人全部恶性肿瘤的2%~3%[1]。肾癌对放化疗治疗效果不明显,手术为其主要治疗方式,其中以腹腔镜手术为首选。肾癌同其他恶性肿瘤一样,术后存在一定复发率,但缺乏可靠标志物。循环肿瘤细胞(circulating tumor cell, CTC)是指从原发或继发肿瘤灶的不同部位脱落,在各种细胞因子作用下进入循环系统,可以在患者外周血检测到异质性肿瘤细胞。近年来研究发现循环肿瘤细胞在监测肿瘤复发转移等方面具有非常重要的作用,目前已成为讨论的热点[2]。本文旨在探讨术后循环肿瘤细胞的变化与肾癌复发转移之间的关系。
1 资料与方法 1.1 临床资料将十堰市太和医院2014年1月—9月收治的41例局限性肾癌患者纳入研究。纳入标准:(1)年龄18~70岁,性别不限;(2)病检示pT1bN0M0的肾癌,行部分切除手术;(3)手术后能配合长期随访,并同患者及其家属签订随访同意书;(4)随访期间出现复发及转移的局限性肾癌患者必须存有病理诊断(本院和外院均可)。排除标准:(1)不能配合或者有精神系统疾病或者合并其他器官及组织癌症患者;(2)随访期间出现其他肿瘤(不包含肾转移癌);(3)肾脏合并其他疾病患者,如炎性反应及发热等全身疾病、急慢性肾小球肾炎、IgA肾病、SLE系统性红斑狼疮、肾鹿角状结石等。纳入41例患者中,阳性组(CTC术后3月≥CTC术前)平均年龄(57.8±11.9)岁,其中男14例,女9例;阴性组(CTC术后3月< CTC术前)平均年龄(58.9±11)岁,其中男11例,女7例。相关操作均经患者及家属同意并且通过医院伦理委员会审查。
1.2 方法 1.2.1 数据收集收集患者年龄、性别、手术方式、病理诊断以及TNM分期、复发患者影像学资料及病理诊断、术前和术后3月循环肿瘤细胞数值、随访期间出现肿瘤复发转移的时间。
1.2.2 循环肿瘤细胞检测方法术前和术后3月分别采集7.5 ml肾癌患者外周静脉血至ACD抗凝血管中。(1)去除血清:常温800 g离心8 min,去除上层血清,保留下层血细胞;(2)去除红细胞:50 ml离心管中加入3 ml样本密度分离液,在样本密度分离液上层叠加血细胞,450 g离心8 min后,将含有白细胞和CTCs的白膜层吸到新的50 ml离心管中;(3)去除白细胞:在放有白细胞混液的离心管中加入处理好的200 μl磁珠,将离心管倾斜约30°置于摇床上,130 r/min,摇动20 min,450 g离心8 min,然后去除白细胞和磁珠混合物,吸取上清液至新的15 ml离心管中,加入清洗液清洗后弃上清液至50 μl;(4)液染抗体:加入2 µl抗原修复液,10 min后加入anti-CD45、anti-CK18抗体和抗体稀释液的混合液,室温避光孵育20 min,650 g离心5 min,弃上清液至100 μl;(5)固定和涂片:混匀细胞沉淀后加入100 µl固定液混匀、涂片,过夜烘干玻片;(6)CTC的杂交和分析:烘干的玻片经过晾置、杂交洗液清洗和无水乙醇洗涤、脱水后,进行CEP8探针杂交。杂交条件为76℃变性10 min,37℃杂交4 h。清洗液清洗后滴加5 μl DAPI染液封片并于荧光显微镜下观察。
1.2.3 循环肿瘤细胞鉴定方法显微镜下见细胞呈椭圆形、圆形或者长方形,细胞形态及边缘完整,可见完整细胞核结构。应用差减富集-荧光免疫染色原位杂交技术(SE-iFISH)进行检测,样本应符合CK+/CD45-/DAPI+/CEP8=2或CK+/CD45-/DAPI+/CEP8 > 2或CK-/CD45-/DA PI+/CEP8 > 2可判定为循环肿瘤细胞。以上检测由2名或者多名研究人员同时鉴定。
1.3 统计学方法采用SPSS22.0软件对所得数据进行统计分析。计量资料以均数±标准差(x±s)表示,采用t检验比较不同组别之间的差异。计数资料采用χ2检验比较不同组别之间差异。生存率采用Kaplan-Meier计算,组间整体生存率的比较使用Log rank检验。P < 0.05为差异有统计学意义。
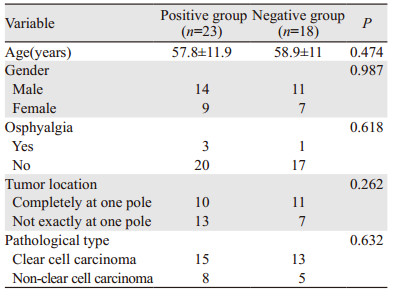
2 结果 2.1 两组患者一般临床资料分析阳性组和阴性组局限性肾癌患者的性别、年龄、腰痛、肿瘤位置、病理类型差异均无统计学意义(P > 0.05),见表 1。
41例局限性肾癌患者中,阳性组(n=23)出现10例复发转移,复发转移率为43.5%;阴性组(n=18)出现2例复发转移,复发转移率为11.1%,两组比较差异有统计学意义(P=0.024)。
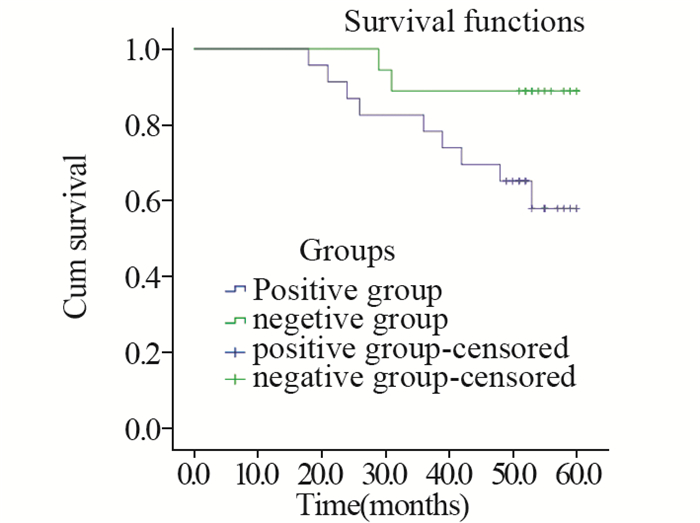
2.3 两组局限性肾癌患者5年生存差异分析阳性组5年生存率为58%,阴性组5年生存率为88.9%。Log rank检验结果显示两组生存率差异有统计学意义(P=0.048),见图 1。
|
| 图 1 两组局限性肾癌患者5年总生存率比较 Figure 1 Comparison of 5-year overall survival between positive group and negative group |
肾癌是泌尿系统常见的恶性肿瘤,近年来发病率呈上升趋势,对放化疗治疗不敏感,手术治疗可提高其生存率,但仍有20%~30%患者术后出现复发转移,最终导致死亡[3-4]。既往由于肾癌术后缺乏能进行监测的特异性标志物,只能常规依靠影像学技术,然而目前现有影像技术只能发现0.5~1 cm病灶[5]。因此寻找一种指标用于肾癌术后复发转移风险的评估和肿瘤微病灶的诊断显得尤为重要。自1869年澳大利亚籍医生Thomas Ashworth在1例死亡患者体内发现CTC以来,肿瘤液体活检拉开了序幕。随后几年里研究发现循环肿瘤细胞在监测肾癌早期复发转移方面具有重要作用[6]。由于局限性肾癌患者术后并非都会出现复发转移,同时循环肿瘤细胞检测费用昂贵,所以对每位患者术后均进行长期监测,不仅增加患者经济负担,也造成过度医疗。因此筛选出高危人群进行监测,是当前需解决的热点问题。
当前循环肿瘤细胞作为恶性肿瘤预后监测的指标已达到共识。例如,有研究将前列腺癌患者治疗后每7.5 ml血液中循环肿瘤细胞数目不小于5作为预后较差的指标,同时发现治疗后循环肿瘤细胞数目下降30%可以延长生存期[7]。Chemi等[8]报道在肺癌患者中循环肿瘤细胞数值增加,肿瘤复发转移的风险增加。Riethdorf等[9]报道乳腺癌患者循环肿瘤细胞数值不同、无进展生存期及总生存期不同,说明循环肿瘤细胞变化影响肿瘤患者预后。庞明辉等[10]探讨了88例结直肠癌患者术后循环肿瘤细胞变化趋势与肿瘤复发之间的关系,发现术后循环肿瘤细胞持续升高,肿瘤复发可能性非常大。然而,有报道提示在肾细胞癌中初始循环肿瘤细胞数目与肾癌术后复发转移不存在关系,而与循环肿瘤细胞变化趋势存在相关性[11]。Nagaya等[12]报道了一位72岁肾癌患者行舒尼替尼治疗后病灶减小,与循环肿瘤细胞计数降低存在正相关性。本研究发现阳性组局限性肾癌患者术后肿瘤复发转移率为43.5%,阴性组为11.1%,两组差异有统计学意义。同时阳性组5年生存率为58.0%,阴性组为88.9%,两组存在明显差异,进一步说明局限性肾癌患者手术治疗后若循环肿瘤细胞数目增加,提示肿瘤容易出现复发转移,同时具有更低的生存率。因此,对于此类患者临床医师需高度警惕,同时也应告知患者术后规律复查病情。
综上所述,若局限性肾癌患者术后循环肿瘤细胞数目增加,提示肿瘤易出现复发转移,同时具有更低的5年生存率。本研究进一步证实循环肿瘤细胞数目变化将会成为局限性肾癌患者术后较好的监测指标。然而本研究也存在一定局限性,随访终点时间不长,未能更长时间监测循环肿瘤细胞数目,以及样本量不多。后期将继续随访并纳入更多的样本进行讨论。
作者贡献
陈涛:患者收集与随访,论文设计及撰写
李丽:参与部分实验,患者随访
姚启盛:论文设计及修改
李昊、王黎:细胞检测
陈从波、杨勇:论文指导
| [1] |
Kızılay F, Turna B, Apaydın E, et al. Comparison of long-term outcomes of laparoscopic and robot-assisted laparoscopic partial nephrectomy[J]. Kaohsiung J Med Sci, 2019, 35(4): 238-243. |
| [2] |
Lin E, Cao T, Nagrath S, et al. Circulating Tumor Cells: Diagnostic and Therapeutic Applications[J]. Annu Rev Biomed Eng, 2018, 20: 329-352. |
| [3] |
Williamson TJ, Pearson JR, Ischia J, et al. Guideline of guidelines: follow-up after nephrectomy for renal cell carcinoma[J]. BJU Int, 2016, 117(4): 555-562. |
| [4] |
Capitanio U, Bensalah K, Bex A, et al. Epidemiology of renal cell carcinoma[J]. Eur Urol, 2019, 75(1): 74-84. |
| [5] |
倪福旭. 小肾癌的影像学诊断方法比较[J]. 影像研究与医学应用, 2019, 3(5): 42-43. [Ni FX. Compared the methods of imaging diagnosis for small renal cell carcinoma[J]. Ying Xiang Yan Jiu Yu Yi Xue Ying Yong, 2019, 3(5): 42-43.] |
| [6] |
Santoni M, Cimadamore A, Cheng L, et al. Circulating Tumor Cells in Renal Cell Carcinoma: Recent Findings and Future Challenges[J]. Front Oncol, 2019, 9: 228. |
| [7] |
Lorente D, Olmos D, Mateo J, et al. Decline in Circulating Tumor Cell Count and Treatment Outcome in Advanced Prostate Cancer[J]. Eur Urol, 2016, 70(6): 985-992. |
| [8] |
Chemi F, Rothwell DG, McGranahan N, et al. Pulmonary venous circulating tumor cell dissemination before tumor resection and disease relapse[J]. Nat Med, 2019, 25(10): 1534-1539. |
| [9] |
Riethdorf S, Müller V, Loibl S, et al. Prognostic Impact of Circulating Tumor Cells for Breast Cancer Patients Treated in the Neoadjuvant "Geparquattro" Trial[J]. Clin Cancer Res, 2017, 23(18): 5384-5393. |
| [10] |
庞明辉, 罗坤, 侯能易, 等. 结直肠癌患者外周循环肿瘤细胞的变化及临床意义[J]. 中华实验外科杂志, 2017, 34(1): 35-37. [Pang MH, Luo K, Hou NY, et al. Colorectal cancer patients with peripheral circulating tumor cells of the change and clinical significance[J]. Zhonghua Shi Yan Wai Ke Za Zhi, 2017, 34(1): 35-37.] |
| [11] |
Wang ZL, Zhang P, Li HC, et al. Dynamic changes of different phenotypic and genetic circulating tumor cells as a biomarker for evaluating the prognosis of RCC[J]. Cancer Biol Ther, 2019, 20(4): 505-512. |
| [12] |
Nagaya N, Kanayama M, Nagata M, et al. The Surge in the Number of Circulating Tumor Cells Following Treatment with Sunitinib for Metastatic Renal Cell Carcinoma: A Case Report[J]. Intern Med, 2018, 57(18): 2695-2700. |
 2020, Vol. 47
2020, Vol. 47