文章信息
- 原发EGFR(19 del)和PIK3CA(Exon 2)共突变非小细胞肺癌1例报道并文献复习
- Primary EGFR (19 del) and PIK3CA (Exon 2) Mutations in Non-small Cell Lung Cancer: A Case Report and Literature Review
- 肿瘤防治研究, 2020, 47(5): 398-400
- Cancer Research on Prevention and Treatment, 2020, 47(5): 398-400
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1175
- 收稿日期: 2019-09-12
- 修回日期: 2019-12-24
2. 100142 北京,空军特色医学中心肿瘤科
2. Department of Medical Oncology, Air Force Medical Center, Beijing 100142, China
PIK3CA是PI3Ks家族成员之一,作用于PI3K-AKT-mTOR信号通路上,PIK3CA突变在非小细胞肺癌(non-small cell lung cancer, NSCLC)中的发生率为2%~5%,鳞癌较腺癌更多见且PIK3CA的突变多发生在Exon 9和Exon 20[1-2]。在非小细胞肺癌中,PIK3CA突变发生在Exon 2的既往报道较少。PIK3CA突变可激活PI3K-AKT-mTOR信号通路,促进肿瘤细胞的生长[3]。PIK3CA突变基因与其他单独的致癌基因突变相比,可能具有较弱的独立致癌性,多与其他致癌基因突变共同存在,最多见的共突变伴侣为EGFR,其中EGFR Exon 21 L858R较EGFR Exon 19 del更多见[4]。我们在临床工作中发现了一例带有EGFR p.E746-A750del(Ex19)合并PIK3CA p.K111N(Ex2)突变的非小细胞肺癌罕见病例,总生存期为8月。
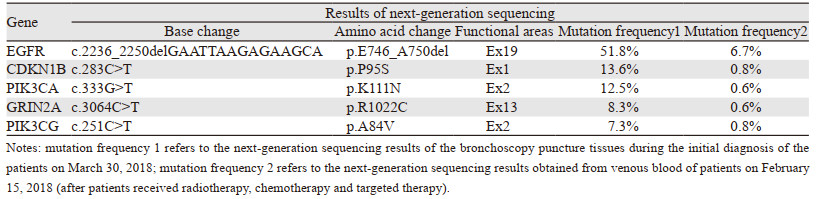
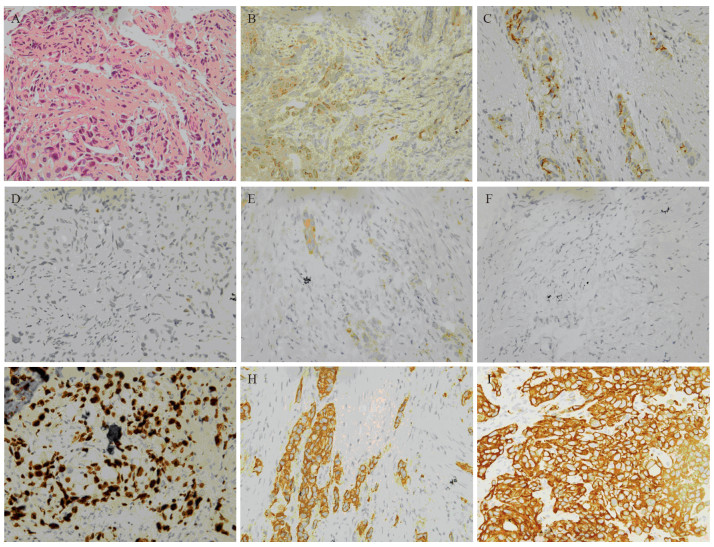
1 临床资料患者女,54岁,无吸烟史,既往史无特殊。2017年8月因咳嗽在空军特色医学中心行胸部CT检查提示肺部占位性病变,进一步行PET-CT检查考虑右肺中叶支气管开口部位中央型肺癌伴全身多处转移瘤(右肺门及纵隔淋巴结、右肾、双侧髂骨、胸3椎体)。2017年9月7日行支气管镜检查,病理示:低分化腺癌,见图 1A。免疫组织化学:TTF-1(+)、NapsinA(+)、P40(-)、CK5/6(灶状+)、NSE(-)、Ki-67(60%)、CK7(++)、CKpan(+),见图 1B~I)。ARMS法基因检测:EGFR Exon 19缺失突变。于2017年9月14日和2017年10月5日行2周期贝伐珠单抗(400 mg, d1, Q21)+培美曲塞(0.8 g, d1, Q21)+顺铂(40 mg, d1~3, Q21)静脉滴注,2周期化疗疗效评估胸腹盆腔CT显示原有病灶稳定,右肺上叶、胸7椎体、双肾及左侧肾上腺新发转移灶,疗效评估:病情进展(progress disease, PD)。于2017年10月31日开始口服吉非替尼(250 mg, 每日1次)联合贝伐珠单抗原剂量治疗,1月后胸腹盆腔CT检查右肺上叶病灶及右肺中叶病灶、双肾病灶、左肾上腺病灶略好转,胸6、胸9、腰1新发转移瘤,胸腔积液增多。患者病情并未得到控制,出现背部疼痛进行性加重,于2017年12月25日—2018年1月15日行肺门纵隔病灶、胸3、胸6、胸7、胸9、腰1椎体,双侧髂骨及右肾下极处病灶局部放疗。放疗后患者背部疼痛缓解,继续原剂量吉非替尼和贝伐珠单抗治疗。2018年2月27日行PET-CT检查:放疗区域肿瘤大部分受到明显抑制,但全身多处新发高代谢病灶,主要表现在颈6、颈7、胸2、胸4椎体及双侧附件,提示前期全身治疗效果欠佳。为寻找治疗突破口,取静脉血行二代基因测序,结果显示:EGFR p.E746-A750del(Ex19)和PIK3CA p.K111N(Ex2)共突变,见表 1。2018年3月对椎体新发病灶行局部放疗,并调整治疗方案为吉非替尼联合依维莫司(5 mg,每日1次)靶向治疗。3周后患者血小板低至22×109/L,考虑与依维莫司有关,停依维莫司,给患者对症升血小板治疗。患者自发病以来病情持续进展,对靶向治疗及化疗反应较差,为进一步明确PIK3CA突变出现时间,将患者患病初期支气管镜穿刺组织行二代基因测序,结果证实为原发EGFR p.E746-A750del(Ex19)及PIK3CA p.K111N(Ex2)共突变,见表 1。患者于2018年5月7日因肺部恶性肿瘤死亡。
|
| A: HE staining; B: TTF-1(+); C: NapsinA(+); D: P40(-); E: CK5/6(Focal +); F: NSE(-); G: Ki-67(60%); H: CK7(++); I: CK-pan(+) (EnVision×400). 图 1 患者支气管镜活检组织HE染色及免疫组织结果 Figure 1 HE staining and immunohistochemical results of the patient's bronchoscopy biopsy tissues |
NSCLC的发生发展是一个相当复杂的过程,其中包括多种信号分子的参与,如EGFR、ALK、MET、HER2等。近年来,PI3K-AKT-mTOR信号通路在NSCLC的研究中受到充分关注,其激活可调节细胞增殖、抑制凋亡、促进肿瘤血管形成及肿瘤侵袭[5],PIK3CA突变是PI3K家族中唯一的肿瘤特异性突变[6]。PIK3CA突变频率较高的肿瘤类型是子宫内膜癌、乳腺癌、结肠癌等,在子宫内膜癌中突变率可达40%[7]。PIK3CA的突变主要发生在Exon 9和Exon 20,其分别编码PIK3CA的螺旋结合域和催化亚基[8]。有文献曾报道在108例原发性子宫内膜癌中检测到58例PIK3CA突变,其中约50%突变位于Exon 9和Exon 20[9]。而在NSCLC中PIK3CA Exon 2突变的病例既往报道少,本例患者通过二代基因检测发现EGFR 19del(E746-A750del)和PIK3CA Exon 2(p.K111N)共突变,临床罕见。患者对化疗、靶向治疗均不敏感,整个治疗过程病情持续进展,以骨转移为著。PIK3CA Exon 9或Exon 20突变与EGFR突变共存的NSCLC患者多认为预后较差、生存期短[1, 10-11],也有报道认为这种共突变不影响EGFR-TKI的敏感度,但预后差[11]。PIK3CA Exon 2突变对EGFR-TKI疗效影响的报道较少,本例患者对多种治疗反应较差可能与PIK3CA Exon 2突变有关。
患者初治时所获得的支气管镜活检组织二代基因检测结果:EGFR 19del突变频率为51.8%,PIK3CA pK111N突变频率为12.5%。经过放化疗及3周期吉非替尼靶向治疗后,抽取静脉血行二代基因检测结果:EGFR 19del突变频率为6.7%,PIK3CA pK111N突变频率为0.6%。患者整体突变水平呈下降趋势,但影像学评估为PD。目前多数研究认为循环肿瘤DNA(circulating tumor DNA, ctDNA)的水平与患者肿瘤负荷呈一定正相关[12],而本例患者在肿瘤负荷持续增大的情况下,ctDNA水平不升反降。有研究[13]认为ctDNA浓度的高低可能与药物治疗反应无明确相关:药物治疗有效时,血液循环里的肿瘤细胞减少,ctDNA水平随之减少;或者当肿瘤细胞对药物敏感时,大量肿瘤细胞被杀伤坏死,释放ctDNA入血,血液中的ctDNA浓度可能升高。药物治疗无效时,肿瘤细胞进一步增殖分化,分泌更多的ctDNA,可能使ctDNA水平升高;或者药物对肿瘤细胞的杀伤作用弱,坏死凋亡的细胞比例少,释放的ctDNA少。综上,ctDNA浓度与疗效之间的关系需大样本临床研究进一步探索[14]。肺癌本身就是异质性比较大的瘤种,目前研究认为ctDNA可突破肿瘤异质性反映肿瘤整体基因组信息,但实际上ctDNA检测可能代表所有的克隆群或某部分优势亚克隆群,甚至仅是一些微量且非优势的克隆群。当根据检测结果给予相应靶向治疗后,此通路突变频率减少被抑制,但因这部分克隆群并非优势群体,病灶仍然会继续增大,这可能是本例患者治疗效果差的原因。基于现有的检测手段,如何综合分析检测结果并给NSCLC患者制定更加有效的治疗手段,是值得我们深思的问题。
作者贡献
李向敏:患者随访及论文撰写
樊再雯:指导论文
张兰兰:收集患者临床资料及患者随访
| [1] |
Li S, Li L, Zhu Y, et al. Coexistence of EGFR with KRAS, or BRAF, or PIK3CA somatic mutations in lung cancer: a comprehensive mutation profiling from 5125 Chinese cohorts[J]. Br J Cancer, 2014, 110(11): 2812-2820. |
| [2] |
Spoerke JM, O'Brien C, Huw L, et al. Phosphoinositide 3-kinase (PI3K) pathway alterations are associated with histologic subtypes and are predictive of sensitivity to PI3K inhibitors in lung cancer preclinical models[J]. Clin Cancer Res, 2012, 18(24): 6771-6783. |
| [3] |
Haley L, Tseng LH, Zheng G, et al. Performance characteristics of next-generation sequencing in clinical mutation detection of colorectal cancers[J]. Mod Pathol, 2015, 28(10): 1390-1399. |
| [4] |
梁乃新, 刘雅昕, 刘磊, 等. 非小细胞肺癌患者PIK3CA基因与其他致癌基因共突变[J]. 协和医学杂志, 2015, 6(3): 186-190. [Liang NX, Liu YX, Liu L, et al. Co-mutation of PIK3 CA and Other Oncogenes in Patients with Non-small Cell Lung Cancer[J]. Xie He Yi Xue Za Zhi, 2015, 6(3): 186-190. DOI:10.3969/j.issn.1674-9081.2015.03.005] |
| [5] |
刘亮洪, 张洪云, 刘晓智, 等. 脑胶质瘤中+miR-7与+EGFR/PI3K+信号通路相关基因蛋白表达的关系[J]. 山东医药, 2014, 54(27): 1-3. [Liu LH, Zhang HY, Liu XZ, et al. Correlation between miR-7 and expression of EGFR/PI3K signal pathway related protein in glioma[J]. Shandong Yi Yao, 2014, 54(27): 1-3. DOI:10.3969/j.issn.1002-266X.2014.27.001] |
| [6] |
Bader AG, Kang S, Vogt PK. Cancer-specific mutations in PIK3CA are oncogenic in vivo[J]. Proc Natl Acad Sci U S A, 2006, 103(5): 1475-1479. |
| [7] |
Joshi A, Ellenson LH. PI3K/PTEN/AKT Genetic Mouse Models of Endometrial Carcinoma[J]. Adv Exp Med Biol, 2017, 943: 261-273. |
| [8] |
Wang L, Hu H, Pan Y, et al. PIK3CA Mutations Frequently Coexist with EGFR/KRAS Mutations in Non-Small Cell Lung Cancer and Suggest Poor Prognosis in EGFR/KRAS Wildtype Subgroup[J]. PLoS One, 2014, 9(2): e88291. |
| [9] |
Rudd ML, Price JC, Fogoros S, et al. A unique spectrum of somatic PIK3CA (p110alpha) mutations within primary endometrial carcinomas[J]. Clin Cancer Res, 2011, 17(6): 1331-1340. |
| [10] |
Hu W, Liu Y, Chen J. Concurrent gene alterations with EGFR mutation and treatment efficacy of EGFR-TKIs in Chinese patients with non-small cell lung cancer[J]. Oncotarget, 2017, 8(15): 25046-25054. |
| [11] |
Eng J, Woo KM, Sima CS, et al. Impact of concurrent PIK3CA mutations on response to EGFR tyrosine kinase inhibition in EGFR-mutant lung cancers and on prognosis in oncogene-driven lung adenocarcinomas[J]. J Thorac Oncol, 2015, 10(12): 1713-1719. |
| [12] |
Ignatiadis M, Lee M, Jeffrey SS. Circulating Tumor Cells and Circulating Tumor DNA: Challenges and Opportunities on the Path to Clinical Utility[J]. Clin Cancer Res, 2015, 21(21): 4786-4800. |
| [13] |
Alix-Panabières C, Pantel K. Clinical Applications of Circulating Tumor Cells and Circulating Tumor DNA as Liquid Biopsy[J]. Cancer Discov, 2016, 6(5): 479-491. |
| [14] |
Usui K, Yokoyama T, Naka G, et al. Plasma ctDNA monitoring during epidermal growth factor receptor (EGFR)-tyrosine kinase inhibitor treatment in patients with EGFR-mutant non-small cell lung cancer (JP-CLEAR trial)[J]. Jpn J Clin Oncol, 2019, 49(6): 554-558. |
 2020, Vol. 47
2020, Vol. 47