文章信息
- 碳离子和质子治疗肝细胞癌的Meta分析
- Carbonions and Proton Therapy for Hepatocellular Carcinoma: A Meta-analysis
- 肿瘤防治研究, 2020, 47(5): 358-366
- Cancer Research on Prevention and Treatment, 2020, 47(5): 358-366
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1158
- 收稿日期: 2019-09-12
- 修回日期: 2020-03-08
2. 730000 兰州,中国科学院近代物理研究所生物医学中心;
3. 730000 兰州,兰州重离子医院;
4. 730000 兰州,兰州大学基础医学院循证医学中心;
5. 730000 兰州,中国科学院近代物理研究所医学物理室
2. Biomedical Center, Institute of Modern Physics, Chinese Academy of Sciences, Lanzhou 730000, China;
3. Lanzhou Heavy Ion Hospital, Lanzhou 730000, China;
4. Evidence-Based Medicine Center, School of Basic Medicine, Lanzhou University, Lanzhou 730000, China;
5. Medical Physics Laboratory, Institute of Modern Physics, Chinese Academy of Sciences, Lanzhou 730000, China
原发性肝癌是高发病率和高死亡率的恶性肿瘤,其中约50%的新发和死亡病例发生在中国,根据中国最新癌症报告,肝癌位居中国恶性肿瘤发生率第4位,死亡率第2位[1]。肝细胞癌(hepatocellular carcinoma, HCC)是肝癌的主要组织学亚型, 由于发病隐匿,发现时大多数患者已处于局部晚期或已发生转移,只有5%~40%的HCC患者适合接受手术切除,除此之外,射频消融、冷冻消融、介入栓塞药物治疗、放射治疗、靶向治疗等在HCC的治疗中发挥了重要作用[2]。然而放射性肝损伤限制了放疗在肝癌中的应用。随着放射治疗技术的不断发展,放射治疗在肝癌中的应用逐渐增多且作用越显重要,其中碳离子和质子都具有Bragg峰型的剂量分布,可以输送较高剂量至靶区,而不会增加周围组织器官的剂量,还具有较高的相对生物学效应(relative biological effectiveness, RBE),尤其是碳离子,对肿瘤细胞具有更大的杀伤作用。由于这些独特的放射物理学和生物学的优势,碳离子和质子治疗肝细胞癌的研究不断开展,目前国内碳离子质子治疗中心也在陆续开展。本研究采用Meta分析的方法评价碳离子和质子治疗HCC的疗效及可行性,旨在为临床应用提供参考。
1 资料与方法 1.1 文献检索策略计算机检索PubMed、EMBASE、The Cochrane Library、中国生物医学文献数据库、中国期刊全文数据库和万方数据库查找有关碳离子质子治疗HCC的临床研究,检索时间均为建库至2019年10月23日,同时追溯纳入研究的参考文献,以获取以上检索未发现的相关信息。中文检索词包括肝细胞癌、碳离子、质子等,英文检索词包括Liver Neoplasm*、Hepatocellular Cancer*、Hepatocellular Carcinoma*、Heavy Ion Therap*和Proton Therap*等。采用主题词与关键词相结合的方法进行检索。
1.2 纳入与排除标准纳入标准:(1)经临床或病理诊断的HCC患者; (2)质子或碳离子治疗HCC的回顾性或前瞻性研究; (3)报道了总生存率、肿瘤控制、不良反应等结局指标的研究。排除标准:(1)重复发表的文献。若多篇研究报道了同一临床研究相同测量指标,只选取范围更广的研究,若测量指标不同,分别纳入分析相应的测量指标; 若数据重复报道,根据研究对象纳入时间范围选取样本量大或最新发表的研究; (2)会议摘要、评论等研究信息较少的文献; (3)质子和碳离子联合其他治疗措施的研究; (4)质子或碳离子治疗HCC患者少于10例的研究[3-4]。
1.3 文献筛选及数据提取由两名研究人员独立筛选文献和提取资料,对有分歧的文献通过研究组讨论决定是否纳入。提取资料主要包括:(1)一般资料:作者、发表年份、研究类型、患者数量、性别、年龄等; (2)临床信息:Child-Pugh分级、血管浸润和肿瘤大小等; (3)治疗措施和结局指标:剂量分割方案、生存、局控、复发和不良反应等指标。
1.4 纳入文献质量评价对纳入研究的质量采用美国卫生保健质量和研究机构(Agency for Healthcare Research and Quality, AHRQ)推荐的横断面研究质量评价标准进行评估。该量表共11个条目,包括研究对象选择、研究质量控制和数据处理等方面,用“是”、“否”和“不清楚”回答,当一个条目答案为“否”或“不清楚”,该项目得分为“0”; 答案为“是”,该项目得分为“1”。0~3为低质量,4~7为中等质量,8~11为高质量。质量评价由两名研究人员同时独立进行,产生分歧时经讨论后由第三方进行裁决。
1.5 统计学方法及数据分析采用STATA 12.0软件进行Meta分析,效应量为总生存率(OS)、局控率(LC)、无进展生存率(PFS)、复发率、死亡率和不良反应发生率。采用χ2检验分析统计学异质性,根据Cochrane系统评价指导手册,显著性水平设定为P=0.1,I2设定为50%,当P > 0.1、I2≤50%时,各研究结果之间的异质性可接受、采用固定效应模型进行合并分析; 当P≤0.1、I2 > 50%时,通过亚组分析和敏感度分析找出异质性来源,如果找不到异质性来源则用随机效应模型进行数据合并。
2 结果 2.1 文献筛选结果及纳入研究的基本特征初检出相关文献1 663篇,经过逐层筛选,最终对94篇文献阅读全文进行筛选,其中有研究报道了相同的患者群体,但是结局指标不同,因此我们分别纳入分析,最终纳入30篇文献,其中一篇文献同时对碳离子和质子治疗HCC进行了研究,包括碳离子研究7篇,质子研究23篇,文献筛选流程及结果见图 1。纳入研究的基本特征见表 1,文献质量均为中等以上。其中碳离子和质子治疗研究中Child-Pugh A级患者的所占中位比例分别为82.1%(66.7%~100%)和78.3%(29%~100%),经其他治疗后复发患者所占的中位比例分别为47.6%(33.3%~75%)和63.2%(21.7%~100%)。
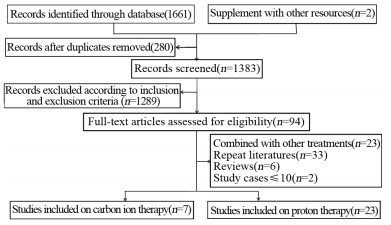
|
| 图 1 文献筛选流程 Figure 1 Flow chart of study selection |
碳离子和质子治疗HCC的1、2、3和5年的合并OS分别为94.2%(92.1%~96.3%)、82.3%(76.9%~87.6%)、65.4%(55.8%~75.0%)、29.2%(21.1%~37.4%)和80.2%(73.3%~87.2%)、65.2%(58.4%~72.1%)、57.4%(49.7%~0.65.1%)、36.9%(28.2%~45.6%),见图 2; 亚组分析显示,碳离子和质子治疗无脉管癌栓、肿瘤直径 < 5 cm、首次治疗、Child-Pugh分级为A级HCC患者的OS均较存在脉管癌栓、肿瘤直径≥5 cm、经其他治疗后复发、Child-Pugh分级为B或C级的有所提高,见表 2、图 3。
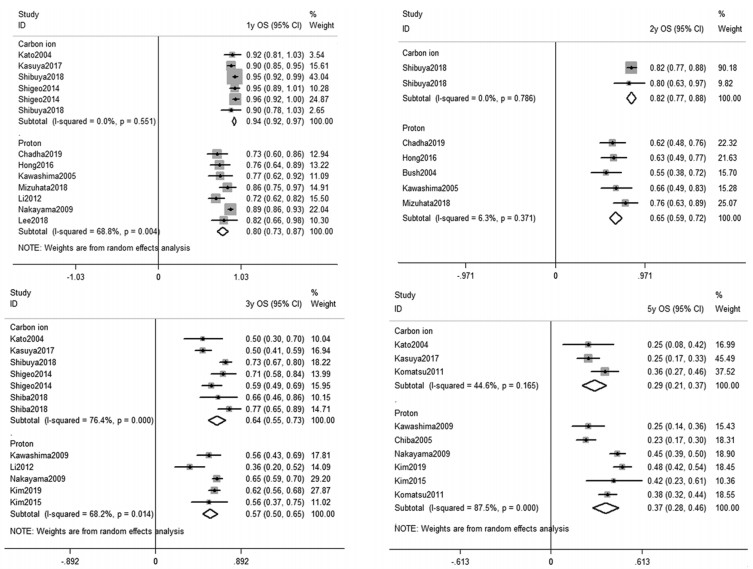
|
| 图 2 碳离子和质子治疗HCC生存率的Meta分析森林图 Figure 2 Forest plot of meta-analysis on OS of HCC patients treated with carbon ion and proton therapy |
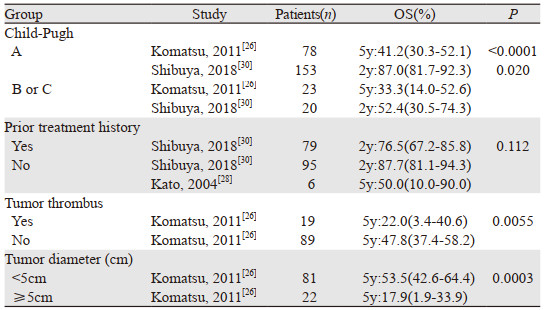
|

|
| 图 3 质子治疗HCC生存率亚组分析森林图 Figure 3 Forest plot of subgroup analysis on survival rate of HCC patients treated with proton therapy |
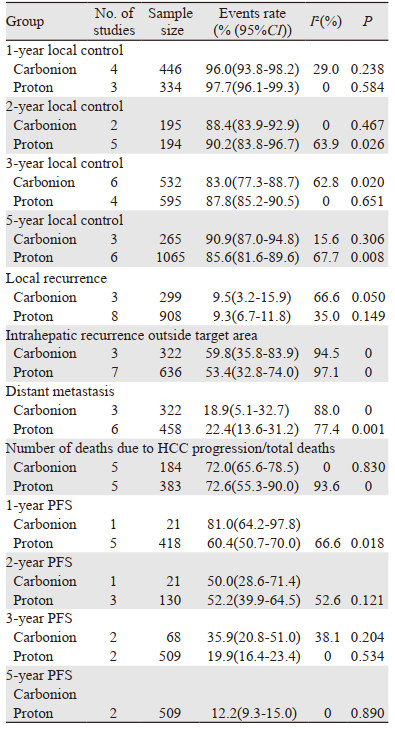
根据合并结果碳离子和质子治疗HCC后均可获得良好的局部控制率,肿瘤进展均以肝内靶区外的进展最常见,导致患者死亡的主要原因均为肝癌进展,结果见表 3。
|
因为大部分研究为回顾性研究,所以并非所有研究都报道了所有不良事件,并且有研究报告≥3级不良反应的发生率为0,0与其他发生率合并会影响合并结果[34],因此仅对不良反应进行描述性分析。总体而言,碳离子和质子治疗后严重不良反应(≥3级)的发生均较少,均无治疗相关死亡发生,3项研究[13, 26, 30]中各有1例4级不良反应报告; 与碳离子治疗相比,质子治疗研究中有3级胃肠道及胆管相关不良反应发生的报告,见表 1。
2.2.4 敏感度分析根据Cochrane手册,当I2为75%~100%时各研究结果间存在较大异质性,因此我们对I2≥75%的合并效应量(碳离子治疗3年OS、质子治疗5年OS、肝内靶区外复发、远处转移、质子治疗死于HCC进展/总死亡率)进行敏感度分析,结果显示排除其中任何一项研究后再做Meta分析,合并后的结果未见明显变化,说明本次Meta评价结果较为稳健。因为目前碳离子和质子治疗HCC的研究尚较少,各纳入研究仅对部分效应量进行报告,且纳入研究中有些基线特征报告不完全,因此对异质性较大的效应量难以进行亚组和回归分析找出异质性来源,所以对其采用随机效应模型进行合并。
2.2.5 发表偏倚分析漏斗图对发表偏倚的判断是基于大于或小于合并效应量的研究数量,在纳入研究较少时,其结果很容易受未纳入研究数量的影响,本研究中对各合并效应量进行报告的文献数量较少,均 < 9篇,因此未对发表偏倚进行分析。
3 讨论肝细胞癌为射线敏感肿瘤,尤其是门脉瘤栓,由于有门静脉血液供氧,氧效应使瘤栓对放疗更为敏感。然而,正常肝组织对传统光子放疗的放射耐受性低,导致病灶区难以给予高剂量。与光子相比,碳离子和质子束具有Bragg峰型剂量分布的物理学优势,可以输送较高剂量至靶区,而不会增加周围组织器官的剂量,且碳离子具有较高的放射生物学效应,Bragg峰区(肿瘤靶区)的RBE值高,损伤或杀死癌细胞以集簇性DNA损伤为主,这种损伤不依赖于细胞所处细胞周期、氧增强比,几乎不能修复,因此碳离子和质子治疗对周围器官辐照小,对局部肿瘤杀伤作用大。本研究对7项碳离子和23项质子治疗HCC的研究分别进行了Meta分析,根据合并结果,碳离子和质子治疗HCC均可获得良好的局部控制率,但长期OS并不令人满意,亚组分析显示相较于存在脉管癌栓、肿瘤直径≥5 cm、复发、Child-Pugh分级为B或C级的HCC患者,无脉管癌栓、肿瘤直径 < 5 cm、初治、Child-Pugh分级为A级的HCC患者碳离子和质子治疗后的OS均有所提高。由此可见,本研究中5年OS并无优势,可能与纳入的各研究均包括了复发、分期较晚、病灶较大和肝功能较差等预后较差的HCC患者相关。
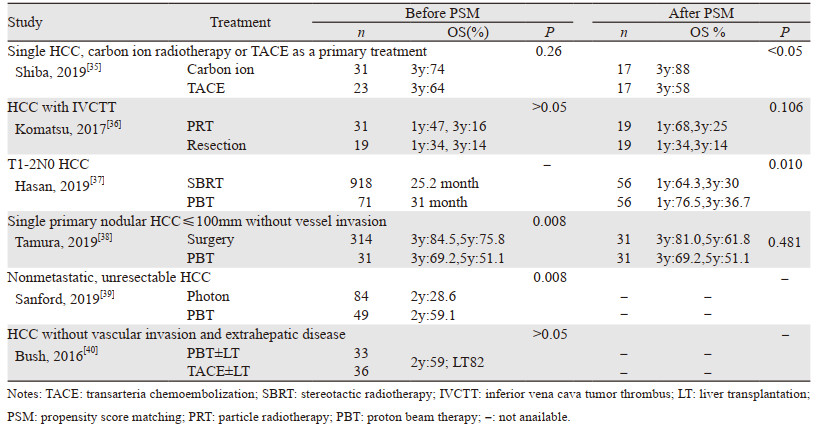
表 4列举了碳离子和质子治疗对比其他方式治疗各类亚型肝细胞癌的生存结果,肝细胞癌的局部治疗方法较多,包括手术切除或移植、射频消融(RFA)、经动脉化疗栓塞(TACE)、经皮酒精注射和放疗,每种方式都有其局限性,然而对于具有单个病灶、肝功能较好、无脉管癌栓以及病灶较小等预示预后较好因素的HCC治疗选择较多,Chiba等[15]报道单个病灶且Child-Pugh A级的HCC患者经质子治疗后5年OS为53.5%,Shigeo等[31]报道碳离子治疗直径≥5 cm的孤立性病灶的1、3、5年OS分别为88%、61%、43%,而日本肝癌研究组[41]报道接受手术治疗直径5~10 cm病灶的1、3、5年OS分别为85.9%、66.1%、52.4%;直径 > 10 cm病灶的1、3、5年的OS分别为77.8%、57.3%、45.4%。因此,碳离子和质子治疗此类预后较好的HCC患者似乎能获得与手术相当但较其他治疗方式好的OS,但由于本研究中有些亚组分析纳入病例少存在一定的选择偏倚,并且大多数研究为回顾性临床研究,所以需要进一步的研究证实。尽管HCC的局部治疗方法多样,但肿瘤体积大的患者不适合RFA、TACE、经皮乙醇注射或SBRT治疗,尽管可选择手术治疗,但大多数患者由于血管侵犯严重,并且中国肝癌与乙型肝炎病毒感染密切相关,大多数HCC患者合并肝硬化,肝功能较差,不适合手术切除,对于不适合上述治疗的HCC患者,碳离子和质子是可行的治疗方法,并且相关前瞻性临床试验相继开展,可进一步提供证据,如日本J-CROS(Japan Carbon Ion Radiation Oncology Study Group)开展了一项针对碳离子治疗不可切除且不适合其他局部治疗的HCC的临床试验(UMIN000020444)。神奈川县癌症中心开展了一项碳离子治疗合并多个病灶或并发症的肝细胞癌的Ⅱ期研究(JPRN-UMIN000026561),韩国国家癌症研究中心启动了一项Ⅱ期临床研究,以证实质子治疗复发或残留HCC患者的有效性和可行性(NCT01643824)。
|
本研究结果得出,大多数HCC患者经碳离子和质子治疗后均会出现复发,主要的复发模式为肝内照射野外复发,死亡的主要原因与HCC进展相关,这与手术、TACE、SBRT等治疗方法的结果相似[35, 38, 42]。Mizumoto等[17]对质子治疗HCC的PFS的相关预测因素进行了分析,发现PFS与CTV、肝功能及肿瘤数量显著相关。Shiba等[33]对碳离子治疗HCC的PFS的相关预测因素进行了分析,发现PFS与肝功能显著相关,由此考虑HCC治疗后肝内照射野外的高复发率可能与治疗时HCC患者已出现目前的影像技术难以检测到的微观病灶,或合并肝硬化时难以辨别真实的病灶边界相关。Lee等[23]的研究中,质子治疗联合索拉非尼的2年OS高于质子单独治疗(50% vs. 28.6%),但差异无统计学意义(P > 0.05); Bush等[7]比较了质子联合肝移植治疗和单独质子治疗的OS,差异有统计学意义(P < 0.001),虽然这些研究患者数量少,存在一定的偏倚,但其结果提示质子与其他治疗联合或可降低肝内复发改善局部控制,进而提高OS,因此,有必要开展相关碳离子和(或)质子联合其他方法治疗HCC的研究。目前已有相关研究开展,例如洛马林达大学开展了一项质子+索拉菲尼vs.索拉菲尼治疗HCC的前瞻性临床研究(NCT01141478)。另外,Nakayama等[16]报道62例接受了2程及以上质子治疗的复发HCC患者1、3和5年的OS分别为98.3%、83.9%和50.5%,Tamura等[38]报道了手术和质子治疗后复发的HCC患者经后续治疗后获得的中位生存期分别为63和40.2月,差异无统计学意义(P=0.196),对具体后续治疗的方式进行分析发现,手术、质子治疗和射频消融相对于TACE、常规放疗、分子靶向药物、化疗等其他治疗更能延长复发患者的中位生存期,并且差异有统计学意义(P=0.003)。为提高HCC患者的总体生存率,需对出现复发的HCC患者进行后续治疗,在HCC治疗过程中保护正常肝组织以耐受后续治疗很重要,Oshiro等[43]研究显示质子治疗后复发的HCC患者重复质子治疗仍具有良好的耐受性和安全性。Shirai等[44]报道了重复碳离子治疗3例复发HCC患者的2年局部控制率为100%,无严重肝不良反应发生。而一项重复光子治疗复发HCC的回顾性研究[45]显示,36%的病例出现严重放疗相关肝不良反应(≥3级),治疗相关死亡率为25%。可见碳离子和质子较光子具有良好的剂量定位特性,对正常肝组织具有较好的保护,有利于后续治疗进行。
本研究结果得出,碳离子和质子治疗HCC严重不良反应(≥3级)发生率低,无治疗相关死亡发生,是安全可行的。但质子治疗有研究报道3级胃肠道反应及胆管相关并发症[15, 26],而接受碳离子治疗无相关报道,这一方面考虑与质子相比,碳离子剂量分布更具优势,可能减少胆管、胃肠道等的剂量,另一方面考虑纳入研究间的基线特征存在异质性,难以直接进行比较,有待进一步研究。
本研究存在一定的局限性:(1)纳入碳离子和质子研究基线特征间存在差异,且有些基线特征报道不完全,难以直接进行比较分析; (2)碳离子质子治疗相关剂量及靶区勾画的差异可能影响治疗结果,但因相关数据报告不完整,难以进行具体分析; (3)因为纳入研究大部分为回顾性研究,很少有研究对不良反应进行全面报告,因此无法合并分析。
综上,碳离子和质子治疗HCC均可获得良好的局控率和较低的不良反应,对预后较好的HCC,碳离子和质子治疗有可能成为有效的替代治疗选择; 对预后不良的HCC患者碳离子和质子治疗也显示出较好的疗效,因此碳离子和质子治疗HCC具有广阔的临床应用前景; 但目前开展治疗的临床机构及病例数较少,尤其是碳离子治疗的研究,需开展大规模的前瞻性临床研究进一步证实碳离子和质子治疗HCC的疗效及安全性。
作者贡献
邵丽华、罗宏涛、刘锐锋:文献收集与筛选、数据处理和统计学分析及文章撰写
田金徽、李征、杨震:指导数据处理和统计学分析、质量评价、研究结果评估
张秋宁、王小虎、杨克虎:研究设计及文章修改与审校
| [1] |
郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28. [Zheng RS, Sun KX, Zhang SW, et al. Report of cancer epidemiology in China, 2015[J]. Zhonghua Zhong Liu Za Zhi, 2019, 41(1): 19-28.] |
| [2] |
European Association For The Study Of The Liver, European Organisation For Research And Treatment Of Cancer. EASL-EORTC Clinical Practice Guidelines: Management of hepatocellular carcinoma[J]. J Hepatol, 2012, 56(4): 908-943. |
| [3] |
Habermehl D, Debus J, Ganten T, et al. Hypofractionated carbon ion therapy delivered with scanned ion beams for patients with hepatocellular carcinoma-feasibility and clinical response[J]. Radiat Oncol, 2013, 8: 59. |
| [4] |
Nakamura M, Fukumitsu N, Kamizawa S. A validated proton beam therapy patch-field protocol for effective treatment of large hepatocellular carcinoma[J]. J Radiat Res, 2018, 59(5): 632-638. |
| [5] |
Chadha AS, Gunther JR, Hsieh CE, et al. Proton beam therapy outcomes for localized unresectable hepatocellular carcinoma[J]. Radiother Oncol, 2019, 133: 54-61. |
| [6] |
Hong TS, Wo JY, Yeap BY, et al. Multi-Institutional Phase Ⅱ Study of High-Dose Hypofractionated Proton Beam Therapy in Patients With Localized, Unresectable Hepatocellular Carcinoma and Intrahepatic Cholangiocarcinoma[J]. J Clin Oncol, 2016, 34(5): 460-468. DOI:10.1200/JCO.2015.64.2710 |
| [7] |
Bush DA, Kayali Z, Grove R, et al. The safety and efficacy of high-dose proton beam radiotherapy for hepatocellular carcinoma: a phase 2 prospective trial[J]. Cancer, 2011, 117(13): 3053-3059. |
| [8] |
Bush DA, Hillebrand DJ, Slater JM, et al. High-Dose proton beam radiotherapy of hepatocellular carcinoma: Preliminary results of a phase Ⅱ trial[J]. Gastroenterology, 2004, 127(5 Suppl 1): S189-S193. DOI:10.1053/j.gastro.2004.09.033 |
| [9] |
Kawashima M, Kohno R, Nakachi K, et al. Dose-Volume Histogram Analysis of the Safety of Proton Beam Therapy for Unresectable Hepatocellular Carcinoma[J]. Int J Radiat Oncol Biol Phys, 2011, 79(5): 1479-1486. |
| [10] |
Kawashima M, Furuse J, Nishio T, et al. Phase Ⅱ Study of Radiotherapy Employing Proton Beam for Hepatocellular Carcinoma[J]. J Clin Oncol, 2005, 23(9): 1839-1846. DOI:10.1200/JCO.2005.00.620 |
| [11] |
Mizuhata M, Takamatsu S, Shibata S, et al. Respiratory-Gated Proton Beam Therapy for Hepatocellular Carcinoma Adjacent to the Gastrointestinal Tract without Fiducial Markers[J]. Cancers(Basel), 2018, 10(2): 58. |
| [12] |
Shibata S, Takamatsu S, Yamamoto K, et al. Proton Beam Therapy without Fiducial Markers Using Four-Dimensional CT Planning for Large Hepatocellular Carcinomas[J]. Cancers(Basel), 2018, 10(3): 71. |
| [13] |
Yu JI, Yoo GS, Cho S, et al. Initial clinical outcomes of proton beam radiotherapy for hepatocellular carcinoma[J]. Radiat Oncol J, 2018, 36(1): 25-34. |
| [14] |
李家敏, 刘素文, 黄术林, 等. 质子束治疗肝细胞癌的临床价值及预后因素分析[J]. 中华放射肿瘤学杂志, 2012, 21(1): 27-28. [Li JM, Liu SW, Huang SL, et al. Clinical value and prognostic factors of proton beam therapy for hepatocellular carcinoma[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2012, 21(1): 27-28.] |
| [15] |
Chiba T, Tokuuye K, Matsuzaki Y, et al. Proton Beam Therapy for Hepatocellular Carcinoma: A Retrospective Review of 162 Patients[J]. Clin Cancer Res, 2005, 11(10): 3799-3805. |
| [16] |
Nakayama H, Sugahara S, Tokita M, et al. Proton beam therapy for hepatocellular carcinoma: the University of Tsukuba experience[J]. Cancer, 2009, 115(23): 5499-5506. |
| [17] |
Mizumoto M, Okumura T, Hashimoto T, et al. Proton Beam Therapy for Hepatocellular Carcinoma: A Comparison of Three Treatment Protocols[J]. Int J Radiat Oncol Biol Phys, 2011, 81(4): 1039-1045. |
| [18] |
Fukuda K, Okumura T, Abei M, et al. Long-term outcomes of proton beam therapy in patients with previously untreated hepatocellular carcinoma[J]. Cancer Sci, 2017, 108(3): 497-503. |
| [19] |
Sugahara S, Nakayama H, Fukuda K, et al. Proton-Beam Therapy for Hepatocellular Carcinoma Associated with Portal Vein Tumor Thrombosis[J]. Strahlenther Onkol, 2009, 185(12): 782-788. |
| [20] |
Sugahara S, Oshiro Y, Nakayama H, et al. Proton Beam Therapy for Large Hepatocellular Carcinoma[J]. Int J Radiat Oncol Biol Phys, 2010, 76(2): 460-466. |
| [21] |
Kim TH, Park JW, Kim BH, et al. Does Risk-Adapted Proton Beam Therapy Have a Role as a Complementary or Alternative Therapeutic Option for Hepatocellular Carcinoma?[J]. Cancers(Basel), 2019, 11(2): 230. |
| [22] |
Kim TH, Park JW, Kim YJ, et al. PhaseⅠDose-Escalation Study of Proton Beam Therapy for Inoperable Hepatocellular Carcinoma[J]. Cancer Res Treat, 2015, 47(1): 34-45. DOI:10.4143/crt.2013.218 |
| [23] |
Lee SU, Park JW, Kim TH, et al. Effectiveness and safety of proton beam therapy for advanced hepatocellular carcinoma with portal vein tumor thrombosis[J]. Strahlenther Onkol, 2014, 190(9): 806-814. |
| [24] |
Lee CH, Hung SP, Hong JH, et al. How small is TOO small? New liver constraint is needed- Proton therapy of hepatocellular carcinoma patients with small normal liver[J]. PLoS One, 2018, 13(9): e0203854. |
| [25] |
Kim DY, Park JW, Kim TH, et al. Risk-adapted simultaneous integrated boost-proton beam therapy (SIB-PBT) for advanced hepatocellular carcinoma with tumour vascular thrombosis[J]. Radiother Oncol, 2017, 122(1): 122-129. |
| [26] |
Komatsu S, Fukumoto T, Demizu Y, et al. Clinical results and risk factors of proton and carbon ion therapy for hepatocellular carcinoma[J]. Cancer, 2011, 117(21): 4890-4904. |
| [27] |
Kimura K, Nakamura T, Ono T, et al. Clinical results of proton beam therapy for hepatocellular carcinoma over 5cm[J]. Hepatol Res, 2017, 47(13): 1368-1374. |
| [28] |
Kato H, Tsujii H, Miyamoto T, et al. Results of the first prospective study of carbon ion radiotherapy for hepatocellular carcinoma with liver cirrhosis[J]. Int J Radiat Oncol Biol Phys, 2004, 59(5): 1468-1476. |
| [29] |
Kasuya G, Kato H, Yasuda S, et al. Progressive hypofractionated carbon-ion radiotherapy for hepatocellular carcinoma: Combined analyses of 2 prospective trials[J]. Cancer, 2017, 123(20): 3955-3965. |
| [30] |
Shibuya K, Ohno T, Terashima K, et al. Short-course carbon ion radiotherapy for hepatocellular carcinoma: a multi-institutional retrospective study[J]. Liver Int, 2018, 38(12): 2239-2247. |
| [31] |
Shigeo Y. Hepatocellular Carcinoma[M]//Tsujii H, Kamada T, Shirai T. Carbon-ion Radiotherapy: Principles, Practices, and Treatment Planning. Japan: Spinger, 2014: 213-218.
|
| [32] |
Shibuya K, Ohno T, Katoh H, et al. A feasibility study of high-dose hypofractionated carbon ion radiation therapy using four fractions for localized hepatocellular carcinoma measuring 3cm or larger[J]. Radiother Oncol, 2018, 132: 230-235. |
| [33] |
Shiba S, Shibuya K, Katoh H, et al. No Deterioration in Clinical Outcomes of Carbon Ion Radiotherapy for Sarcopenia Patients with Hepatocellular Carcinoma[J]. Anticancer Res, 2018, 38(6): 3579-3586. |
| [34] |
Sweeting MJ, Sutton AJ, Lambert PC. What to add to nothing? Use and avoidance of continuity corrections in meta-analysis of sparse data[J]. Stat Med, 2004, 23(9): 1351-1375. |
| [35] |
Shiba S, Shibuya K, Katoh H, et al. A comparison of carbon ion radiotherapy and transarterial chemoembolization treatment outcomes for single hepatocellular carcinoma: a propensity score matching study[J]. Radiat Oncol, 2019, 14(1): 137. |
| [36] |
Komatsu S, Kido M, Asari S, et al. Particle radiotherapy, a novel external radiation therapy, versus liver resection for hepatocellular carcinoma accompanied with inferior vena cava tumor thrombus: A matched-pair analysis[J]. Surgery, 2017, 162(6): 1241-1249. |
| [37] |
Hasan S, Abel S, Verma V, et al. Proton beam therapy versus stereotactic body radiotherapy for hepatocellular carcinoma: practice patterns, outcomes, and the effect of biologically effective dose escalation[J]. J Gastrointest Oncol, 2019, 10(5): 999-1009. |
| [38] |
Tamura S, Okamura Y, Sugiura T, et al. A comparison of the outcomes between surgical resection and proton beam therapy for single primary hepatocellular carcinoma[J]. Surg Today, 2020, 50(4): 369-378. |
| [39] |
Sanford NN, Pursley J, Noe B, et al. Protons versus Photons for Unresectable Hepatocellular Carcinoma: Liver Decompensation and Overall Survival[J]. Int J Radiat Oncol Biol Phys, 2019, 105(1): 64-72. |
| [40] |
Bush DA, Smith JC, Slater JD, et al. Randomized Clinical Trial Comparing Proton Beam Radiotherapy to Transarterial Chemoembolization for Hepatocellular Carcinoma-Results of an Interim Analysis[J]. Int J Radiat Oncol Biol Phys, 2016, 95(1): 477-482. DOI:10.1016/j.ijrobp.2016.02.027 |
| [41] |
Kudo M, Izumi N, Ichida T, et al. Report of the 19th follow-up survey of primary liver cancer in Japan[J]. Hepatol Res, 2016, 46(5): 372-390. |
| [42] |
Choi BO, Choi IB, Jang HS, et al. Stereotactic body radiation therapy with or without transarterial chemoembolization for patients with primary hepatocellular carcinoma: preliminary analysis[J]. BMC Cancer, 2008, 8: 351. |
| [43] |
Oshiro Y, Mizumoto M, Okumura T, et al. Analysis of repeated proton beam therapy for patients with hepatocellular carcinoma[J]. Radiother Oncol, 2017, 123(2): 240-245. |
| [44] |
Shirai K, Ohno T, Saitoh JI, et al. Prospective study of isolated recurrent tumor re-irradiation with carbon-ion beams[J]. Front Oncol, 2019, 9: 181. |
| [45] |
Huang Y, Chen SW, Fan CC, et al. Clinical parameters for predicting radiation-induced liver disease after intrahepatic reirradiation for hepatocellular carcinoma[J]. Radiat Oncol, 2016, 11(1): 89. |
 2020, Vol. 47
2020, Vol. 47