文章信息
- 基于深度学习的肺结节筛检和定性诊断分析
- Pulmonary Nodule Screening and Qualitative Diagnosis Based on Deep Learning
- 肿瘤防治研究, 2020, 47(4): 283-287
- Cancer Research on Prevention and Treatment, 2020, 47(4): 283-287
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1107
- 收稿日期: 2019-09-02
- 修回日期: 2019-10-15
随着高分辨率CT(high resolution CT, HRCT)在肺癌早期筛查应用的普及,图像数量倍增、小结节显示率提高及定量测量使阅片工作量显著增加,高强度工作使影像科医生易视觉疲劳,加之经验不足等,不可避免地导致小结节的漏诊和误诊。如何在大量图像资料中准确检测出结节并早期定性,已成为临床迫切需求。基于深度学习的人工智能(artificial intelligence, AI)是目前各行各业研究的热点,已广泛运用于影像、临床及病理等多个医学领域[1-2],在肺结节诊断方面AI凭借其准确的算法模型,不仅能在短时间内检出结节,而且能够对结节良恶性进行预判,但对其筛检及预判结果目前尚无明确定论[3-4]。本研究通过比较不同主体的阅片结果,并分析AI相关量化参数,探讨AI在肺结节检测和定性诊断中的临床价值。
1 资料与方法 1.1 研究对象收集2018年10月—2019年4月间行胸部CT平扫患者250例。纳入标准:(1)结节直径≤3 cm;(2)CT图像层厚为1 mm;排除标准:(1)排除肺部弥漫性病变;(2)排除图像有严重伪影。另将经手术病理证实的170例(184个结节)良、恶性患者入组本研究定性诊断分析,其中男性75例、女性95例。根据中华医学会心胸学组关于胸部CT肺结节数据标注与质控达成的专家共识,按照结节内支气管及血管边缘是否能识别分为实性结节和磨玻璃结节(ground-glass nodules, GGN)(包括纯磨玻璃结节及混杂磨玻璃结节)[5]。170例中,实性结节92例共100个结节,其中良性45例50个结节(男21例、女24例,平均年龄57.9±12.2岁):6个结核、11个错构瘤、2个硬化性肺泡细胞瘤、9个炎性反应、20个淋巴增生、2个炭末沉积;恶性47例50个结节(男性17例、女性30例,平均年龄60.8±7.2岁):44个浸润性腺癌、3个微浸润性腺癌、2个原位癌、1个大细胞神经内分泌癌。GGN 78例84个结节:其中良性28例31个结节(男14例、女14例,平均年龄53.9±10.5岁):3个不典型腺瘤样增生、5个肺泡间隔纤维化、8个结核、3个炭末沉积、12个炎性反应;恶性50例53个结节(男23例、女27例,平均年龄55.9±8.5岁):37个浸润性腺癌、13个微浸润性腺癌、2个原位癌、1个小细胞神经内分泌癌。
1.2 CT扫描方法采用Siemens SOMATOM Definition AS 128层螺旋CT机、Siemens SOMATOM Definition Flash及联影uCT 760进行胸部HRCT扫描。扫描参数为:(1)Siemens SOMATOM Definition AS 128层螺旋CT机及Siemens SOMATOM Definition Flash:管电压100 kV,管电流80 mAs,CarekV semi,自动管电流调制,螺距0.938,重建卷积函数采用B70 f。(2)联影uCT 760:管电压100 kV,管电流80 mAs,自动管电流调制,螺距0.938,肺窗滤波函数B-SHARP-C。重建层厚1 mm,层间距1 mm。扫描范围从肺尖至肺底全部区域,两侧包括胸壁、腋窝。图像分析采用肺窗(窗宽:1500 HU,窗位:-400 HU)。
1.3 图像分析处理 1.3.1 肺结节筛检的相关指标由两名从事胸部影像诊断的高年资主任医师对250例患者胸部CT图像进行再次诊断,定量结节个数,二者意见不一致时,商议后统一结果。根据阅片方式不同,分成三组:A组:由住院医师单独阅片;B组:由AI(医学影像辅助诊断软件Dr.Wise Lung Analyzer,版本:V1.1.0.1,型号:MIDS-PNA)单独阅片;C组:由住院医结合AI综合阅片,记录每组阅片时间及结节检出数,分别计算其误诊率、漏诊率、敏感度、阳性预测值。误诊率=误诊数/检出数×100%,漏诊率=漏诊数/(漏诊数+检出数)×100%,敏感度=诊断正确数/结节总数×100%,阳性预测值=诊断正确数/检出数×100%。
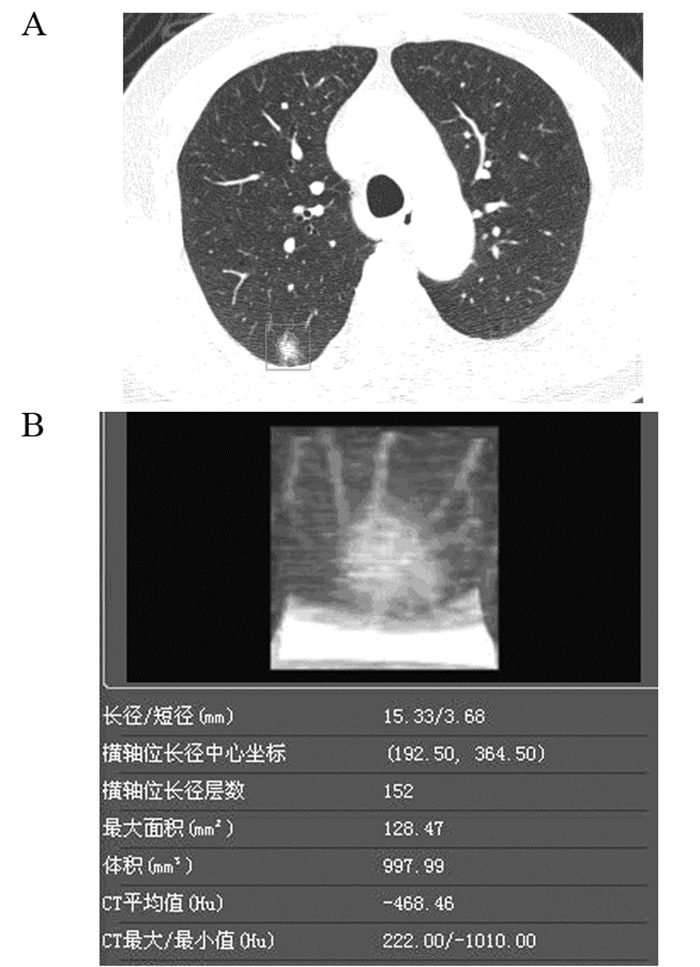
1.3.2 肺结节定性诊断的相关指标将经手术病理证实的170例患者肺窗薄层图像调入AI分析,见图 1,得到相关量化参数:结节长径、短径、最大面积、体积、平均CT值、最大CT值、最小值CT值及恶性概率。长径和短径均为结节在三维空间内的最大截面长径和短径。恶性概率为AI基于计算机深度学习分析肺结节特征给出结节恶变的可能性。
|
| 图 1 AI自动筛选肺结节并标注其位置(A)及AI自动测量肺结节相关量化参数(B) Figure 1 AI automatically selected pulmonary nodules, labeled their location(A) and measured related quantification parameters(B) |
采用SPSS21.0软件包进行数据处理。计算A、B、C三组肺结节检出效能的误诊率、漏诊率、敏感度、阳性预测值和平均诊断时间,三组比较采用χ2检验和t检验。比较实性结节及GGN良、恶性组间一般临床资料和AI量化参数的差异,采用受试者工作特征(receiver operator characteristic, ROC)曲线分析其诊断效能。P < 0.05为差异有统计学意义。
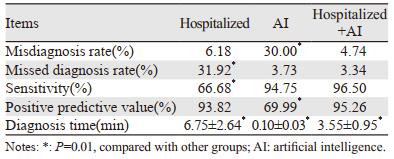
2 结果 2.1 肺结节检出情况的比较经高年资主任医师确认共有2 230个结节。A组检出1 585个结节,误诊98个,漏诊743个;B组检出3 019个结节,误诊906个,漏诊117个;C组检出2 259个结节,误诊107个,漏诊78个。三组误诊率、漏诊率、敏感度、阳性预测值及平均诊断时间差异均有统计学意义(均P=0.01),见表 1。
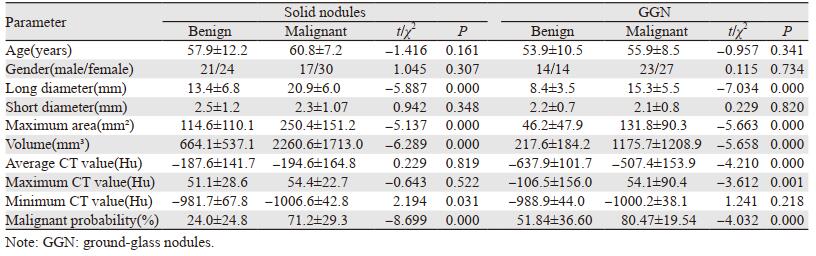
实性结节良、恶性组间年龄、性别、短径、平均CT值、最大CT值均差异无统计学意义(P > 0.05);长径、最大面积、体积、最小CT值及恶性概率差异均有统计学意义(P < 0.05)。GGN良、恶性组间年龄、性别、短径、最小CT值差异均无统计学意义(P > 0.05),长径、最大面积、体积、平均CT值、最大CT值及恶性概率差异均有统计学意义(P < 0.05),见表 2。
|
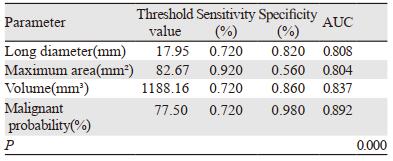
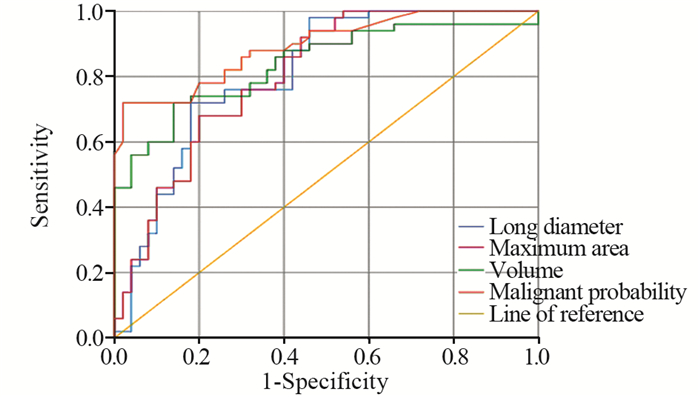
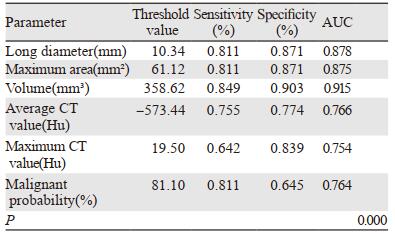
对良、恶性组间有统计学差异的各个参数进行ROC曲线分析,实性结节曲线下面积(AUC)大于0.7的参数为:长径、最大面积、体积、恶性概率,见表 3、图 2。GGN曲线下面积(AUC)大于0.7的参数为:长径、最大面积、体积、平均CT值、最大CT值及恶性概率,见表 4、图 3。
|
|
| 图 2 实性结节各参数的ROC曲线图 Figure 2 ROC curve of each parameter of solid nodules |
|
|
| 图 3 GGN各参数的ROC曲线图 Figure 3 ROC curve of each parameter of GGN |
肺癌是我国最常见恶性肿瘤,致死率高,早期发现、早期治疗可提高患者的生存率,而高效的肺结节检测对肺癌的风险评估具有重要意义。为提升诊断准确性,计算机辅助诊断系统(computer aided diagnostic system, CAD)和AI应运而生。目前用于肺结节筛查和定性的辅助诊断软件国内外各有不同,主要是由于模型算法不同使其结果的敏感度、特异性出现一定偏差[6]。
现阶段CAD和AI已被看作放射科医生的第二双眼睛,在肺结节的检测和诊断中发挥着重要作用[7]。本研究结果显示A组(住院医)的漏诊率明显高于B(AI)、C(住院医+AI)两组,而敏感度明显低于B、C两组,这可能是由于人工在进行重复大量阅片过程中极易产生视觉疲劳,大大影响了结节的检出情况。B组的误诊率明显高于A、C两组,而阳性预测值明显低于A、C两组,研究发现AI容易将肺门区及纵隔旁血管误判为结节,表明AI的算法有待更正和提高。AI是基于大数据深度学习所得到的算法模型可以避免主观偏差,虽然部分模型筛选的结果中包含了一些假阳性结节,但明显降低了假阴性,避免肺结节漏诊的发生。因此,本研究中C组阅片明显提高了肺结节的检出率,减少了漏诊风险,又弥补了AI假阳性率高的缺点。同时,本研究中AI平均6 s能完成一例阅片,而一般人工阅片需要7 min,人工结合AI大大提高了影像科医生的工作效率和诊断准确性,与胡琼洁[8]和邵亚军等[9]研究结果一致。
AI对肺结节的各指标进行准确量化,减少了人工测量的误差,可重复性强,且对于随访患者前后两次的比较和倍增时间的计算更加优于手动测量。以往有较多研究探讨肺结节良、恶性间三维特征的差异,AI正是基于这些数据及结节的形态学特征对其良恶性进行预判。本研究中实性结节良恶性组间短径、平均CT值、最大CT值均无统计学差异,而结节长径、最大面积、体积良恶性组间有统计学差异,恶性组均显著大于良性组,与恶性肿瘤的侵袭性强、生长速度快有关,与顾亚峰等[10]的研究结果相近。研究表明,基于测量肺结节体积和体积倍增时间的方案比基于直径的方案更适合早期肺癌的检测,对恶性结节的预测更加精准[11],肺结节AI将二者均纳入结节的检测模型算法中,提高了诊断的准确率。由于结节密度不均,其内往往含有正常肺组织,因此最小CT值诊断效能较低,可信度不高。恶性概率是AI结合病灶的形态学及三维特征通过模型计算的综合指标,经ROC曲线分析得出AUC为0.892,当临界值为77.50%时,诊断敏感度、特异性分别为72.0%、98.0%。
本研究中,GGN良恶性组间短径和最小CT值无统计学差异,结节长径、最大面积、体积、平均CT值、最大CT值及恶性概率均有统计学差异,与Shi等[12]研究结果一致。对各参数行ROC曲线分析,AUC均大于0.7。GGN的长径取临界值为10.34 mm时,敏感度和特异性分别为81.1%、87.1%,与Kitami等[13]和熊廷伟等[14]研究结果相近,Yang等[15]研究也表明直径用于预判良恶性GGN的准确率为78.7%,ROC曲线AUC为0.861,敏感度和特异性分别为78.0%、80.0%。关于GGN的CT值以往研究结果各有不同,矫娜等[16]研究表明恶性GGN的平均CT值及最大CT值均明显大于良性GGN,而Xiang等[17]认为两者差异并无统计学意义,本研究结果也表明两者间有统计学差异,病理机制可能是由于恶性GGN内肿瘤细胞沿着肺泡间隔贴壁生长,导致肺泡腔内气体减少,或由于肺泡塌陷、纤维化等导致病灶内局部密度增高[18]。两组间GGN的恶性概率具有统计学差异,当恶性概率大于81.10%时,提示恶性GGN的可能性较大,具有一定参考价值。
综上,在肺结节的检出及良恶性鉴别诊断方面,AI可在短时间内有效提高结节检出的敏感度,并自动提取、分析其三维特征进行量化,预判结节的恶性概率,且结果可信度较高,是影像科医生可靠而实用的有力助手,可在临床中广泛应用。但目前AI假阳性率仍较高,需进一步更新其算法提高特异度。本研究的不足之处:(1)需扩大样本量,进一步对结果进行验证。(2)未引入随访数据等重要指标说明AI在肺结节随访中的价值,有待进一步研究。
作者贡献
张正华:研究设计、实施监督及论文撰写
蔡雅倩:数据整理和分析
韩丹:理论指导和论文修改
周小君、黄益龙、李浚利:病例资料的收集和整理
| [1] |
Litjens G, Kooi T, Bejnordi BE, et al. A survey on deep learning in medical image analysis[J]. Med Image Anal, 2017, 42(9): 60-88. |
| [2] |
Qin C, Yao D, Shi Y, et al. Computer-aided detection in chest radiography based on artificial intelligence: a survey[J]. Biomed Eng Online, 2018, 17(1): 113. |
| [3] |
Gong L, Jiang S, Yang Z, et al. Automated pulmonary nodule detection in CT images using 3D deep squeeze-and-excitation networks[J]. Int J Comput Assist Radiol Surg, 2019, 14(11): 1969-1979. |
| [4] |
Valente IR, Cortez PC, Neto EC, et al. Automatic 3D pulmonary nodule detection in CT images: A survey[J]. Comput Methods Programs Biomed, 2016, 124: 91-107. |
| [5] |
中国食品药品检定研究院, 中华医学会放射学分会心胸学组. 胸部CT肺结节数据标注与质量控制专家共识(2018)[J]. 中华放射学杂志, 2019, 53(1): 9-15. [China Institute of Food and Drug Control, Chinese Medical Association. Expert consensus on the rule and quality control of pulmonary nodule annotation based on thoracic CT (2018)[J]. Zhonghua Fang She Xue Za Zhi, 2019, 53(1): 9-15.] |
| [6] |
Shaffie A, Soliman A, Fraiwan L, et al. A Generalized Deep Learning-Based Diagnostic System for Early Diagnosis of Various Types of Pulmonary Nodules[J]. Technol Cancer Res Treat, 2018, 17: 1533033818798800. |
| [7] |
Zhang G, Yang Z, Gong L, et al. An Appraisal of Nodule Diagnosis for Lung Cancer in CT Images[J]. J Med Syst, 2019, 43(7): 181. |
| [8] |
胡琼洁, 陈冲, 王玉锦, 等. 实习医师以共同阅片和第二阅片者模式使用计算机辅助检测系统在低剂量CT中的应用研究[J]. 放射学实践, 2018, 33(10): 1022-1028. [Hu QJ, Chen C, Wang YJ, et al. A computer-aided detection (CAD) system on low-dose chest CT images in concurent-reader and second-reader modes:influence on interns[J]. Fang She Xue Shi Jian, 2018, 33(10): 1022-1028.] |
| [9] |
邵亚军, 张荣宝, 郭佑民, 等. 计算机辅助工具对肺结节检测效能的研究[J]. 实用放射学杂志, 2018, 34(9): 1430-1433. [Shao YJ, Zhang BR, Guo YM, et al. Effectiveness of computer-aided detection for pulmonary nodules[J]. Shi Yong Fang She Xue Za Zhi, 2018, 34(9): 1430-1433.] |
| [10] |
顾亚峰, 李琼, 范丽, 等. 不同窗宽窗位下肺亚实性结节及其实性成分大小对病理等级的预测价值[J]. 中华放射学杂志, 2017, 51(7): 484-488. [Gu YF, Li Q, Fan L, et al. Predictive value of whole nodule size and solid component size of pulmonary subsolid nodule with different window setting for the pathologic grade[J]. Zhonghua Fang She Xue Za Zhi, 2017, 51(7): 484-488.] |
| [11] |
Du Y, Zhao Y, Sidorenkov G, et al. Methods of computed tomography screening and management of lung cancer in Tianjin: design of a population-based cohort study[J]. Cancer Biol Med, 2019, 16(1): 181-188. |
| [12] |
Shi Z, Deng J, She Y, et al. Quantitative features can predict further growth of persistent pure ground-glass nodule[J]. Quant Imaging Med Surg, 2019, 9(2): 283-291. |
| [13] |
Kitami A, Sano F, Hayashi S, et al. Correlation between histological invasiveness and the computed tomography value in pure ground-glass nodules[J]. Surg Today, 2016, 46(5): 593-598. |
| [14] |
熊廷伟, 李川, 龚明福, 等. MSCT在肺孤立性磨玻璃结节鉴别诊断中的价值[J]. 中华肺部疾病杂志(电子版), 2018, 11(4): 401-404. [Xiong TW, Li C, Gong MF, et al. Value of multi-slice spiral CT in differential diagnosis of solitary ground-glass opacity in lungs[J]. Zhonghua Fei Bu Ji Bing Za Zhi(Dian Zi Ban), 2018, 11(4): 401-404.] |
| [15] |
Yang Y, Wang WW, Ren Y, et al. Computerized texture analysis predicts histological invasiveness within lung adenocarcinoma manifesting as pure ground-glass nodules[J]. Acta Radiol, 2019, 60(10): 1258-1264. |
| [16] |
矫娜, 吴明祥, 龚静山, 等. 计算机辅助诊断定量分析表现为磨玻璃样结节的肺原位腺癌与非典型腺瘤样增生[J]. 中国CT和MRI杂志, 2015, 13(6): 29-31. [Jiao N, Wu MX, Gong JS, et al. Computer-aided Differential Diagnosis of Adenocarcinoma Insitu and Atypical Adenomatous Hyperplasis Which Appear as Ground Glass Opacity[J]. Zhongguo CT He MRI Za Zhi, 2015, 13(6): 29-31.] |
| [17] |
Xiang W, Xing Y, Jiang S, et al. Morphological factors differentiating between early lung adenocarcinomas appearing as pure ground-glass nodules measuring ≤10 mm on thin-section computed tomography[J]. Cancer Imaging, 2014, 14: 33. |
| [18] |
曹恩涛, 于红, 范丽, 等. 纯磨玻璃密度结节肺腺癌的CT三维定量分析[J]. 中华放射学杂志, 2016, 50(12): 940-945. [Cao ET, Yu H, Fan L, et al. Quantitative CT analysis of early-stage lung adenocarcinoma with pure ground-glass opacity[J]. Zhonghua Fang She Xue Za Zhi, 2016, 50(12): 940-945.] |
 2020, Vol. 47
2020, Vol. 47