文章信息
- 基于IPA探析COPB2基因对人骨肉瘤细胞的分子调控机制
- Molecular Regulation Mechanism of COPB2 Gene on Human Osteosarcoma Cell Based on Ingenuity Pathway Analysis
- 肿瘤防治研究, 2020, 47(4): 251-255
- Cancer Research on Prevention and Treatment, 2020, 47(4): 251-255
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1084
- 收稿日期: 2019-08-27
- 修回日期: 2020-01-15
外被体包被蛋白β2亚基(coatomer protein complex subunit beta 2, COPB2)参与构成外被体包被蛋白复合体I,主要负责细胞内高尔基体和内质网间的囊泡转运[1-2]。在保持内质网、高尔基体的完整性,维持细胞稳态中发挥重要作用。随着研究的深入,人们发现COPB2除了参与囊泡运输外,COPB2还与细胞周期调控[3]、细胞凋亡[4-5]密切相关,并且还参与多条细胞信号通路转导[6-9]。近年来多项研究显示,COPB2基因在上皮来源癌细胞中呈高表达,并能够通过不同分子调控机制及信号通路影响细胞周期、凋亡,从而促进癌细胞异常增殖,并且COPB2的表达水平与患者预后相关,COPB2高表达患者预后较差[4, 8-10]。COPB2在上皮来源恶性肿瘤的发生发展中发挥重要作用。
COPB2在人骨肉瘤细胞中的表达水平、在人骨肉瘤的发生发展中的作用,尚无文献报道。为探讨COPB2对人骨肉瘤细胞的分子调控机制,本研究首先检测COPB2在人骨肉瘤细胞系中的表达情况,进一步基于IPA软件(ingenuity pathway analysis)的生物信息学分析,探析COPB2对人骨肉瘤细胞可能的分子调控机制,为后续进一步研究提供理论基础。
1 材料与方法 1.1 RT-qPCR检测COPB2在人骨肉瘤细胞系中的表达水平人骨肉瘤细胞系U-2OS、MG-63、HOS购自上海吉凯基因化学技术有限公司,Saos-2购自中科院。以2×104/ml密度制成细胞悬液,接种于6孔板,每种细胞设3个复孔,置于37℃、5%CO2培养箱中培养。待细胞生长达80%时收集细胞,应用TRIzol法进行总RNA提取,RNA反转录后行RT-qPCR检测(SYBR Master Mixture,TAKARA)。选用GADPH为内参,GAPDH:上游5’-TGACTTCAACAGCGACACCCA-3’,下游5’-CACCCTGTTGCTGTAGCCAAA-3’;COPB2:上游-5’GTGGGGACAAGCCATACCTC-3’,下游5’-GTGCTCTCAAGCCGGTAGG-3’。测定ΔCt值,当ΔCt值≤12时,该细胞中基因为高丰度表达。
1.2 应用RNAi技术下调U-2OS细胞COPB2表达人骨肉瘤细胞系U-2OS,以培养基按2×104个每毫升密度制成细胞悬液,接种于6孔板中培养。细胞分为COPB2沉默组(knock down, KD)和对照组(normal control, NC),每组设3个复孔。定期更换培养基,待细胞密度达到2×104个每毫升时,更换绿色荧光蛋白慢病毒培养基继续培养(KD组慢病毒含COPB2沉默序列:LVPGCSIL-004PSC3634-2;NC组不含COPB2沉默序列:psc3741。慢病毒由上海吉凯基因技术有限公司提供),感染复数10:1。感染后16 h更换普通培养基继续培养,感染后72 h收集细胞在荧光显微镜下观察并应用RT-qPCR检测COPB2基因沉默效率。COPB2和GADPH上下游引物序列同上。应用2-∆∆Ct法进行数据分析。
1.3 人基因表达谱分析收集KD和NC组细胞,采用TRIzol法进行总RNA抽提,抽提所得总RNA经NanoDrop 2000和Agilent Bioanalyzer 2100质检(质控标准:NanoDrop 2000-1.7 < A260/A280 < 2.2;Agilent 2100 Bioanalyzer-RIN≥7.0,并且28S/18S > 0.7)。应用体外反转录试剂盒(GeneChip 3’IVT Express Kit,Affymetrix)制备带生物素标志的aRNA(amplified RNA)。将aRNA进行纯化,然后将其片段化后与芯片探针杂交。应用人基因表达谱芯片(GeneChip PrimeView human, Affymetrix)对两组细胞进行基因表达谱检测,基因表现有显著差异的筛选标准为:倍数变化在1.5倍以上(|倍数变化/FC| > 1.5),并且差异有统计学意义(P < 0.05)。
1.4 IPA分析将得到的基因表达谱分析结果输入在线整合分析软件—IPA软件系统(http://www.ingenuity.com/)进行分析[11]。
1.4.1 经典通路分析首先基于差异基因列表与各个通路包含的基因集合,通过计算显著性(P < 0.05)来找到表达差异基因主要富集在哪些通路中;接下来基于差异基因受调控信息(上调/下调)并与文献记载的调控信息相比较(|Z| > 2),明确调控通路。
1.4.2 疾病功能分析基于数据库(Ingenuity Knowledge Base),分析差异基因在不同疾病与功能分类中的富集情况(P < 0.05,|Z| > 2)。
1.4.3 互作网络分析对每一个调控网络进行打分,该分值检测了同一个网络中差异基因的数量,同一个网络中包含实验差异基因的数量越多,得分则越高。
1.5 统计学方法采用SPSS21.0统计软件进行方差分析,计量资料均采用均值±标准差(x±s)表示。两组数据比较前采用Shapiro-Wilk法进行正态性检验,Levene检验方法进行方差齐性检验,满足条件时采用独立样本t检验;不满足条件时采用Wilcoxon符号秩和检验。生物信息分析统计由IPA软件实现。P < 0.05为差异有统计学意义,|Z评分| > 2视为COPB2对差异基因的调控有意义。
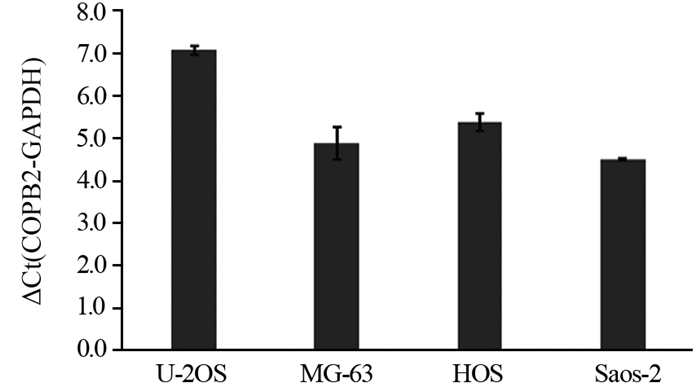
2 结果 2.1 RT-qPCR检测COPB2在人骨肉瘤细胞系中的表达水平RT-qPCR结果显示COPB2在人骨肉瘤细胞系U-2OS、MG-63、HOS和Saos-2中表达丰度均较高,见图 1。ΔCt值分别为7.08±0.10、4.88±0.40、5.38±0.20和4.51±0.03。
|
| RT-qPCR results showed that the COPB2 gene was highly expressed in human osteosarcoma cell lines U-2OS (ΔCt=7.08±0.10), MG-63 (ΔCt=4.88±0.40), HOS (ΔCt=5.38±0.20) and Saos-2 (ΔCt=4.51±0.03) with GAPDH as an internal reference. (ΔCt=the Ct value of the target gene-the Ct value of the internal reference gene. When the ΔCt value is≤12, the target gene is highly expressed in the cells). 图 1 RT-qPCR检测COPB2表达情况 Figure 1 COPB2 expression detected by RT-qPCR |
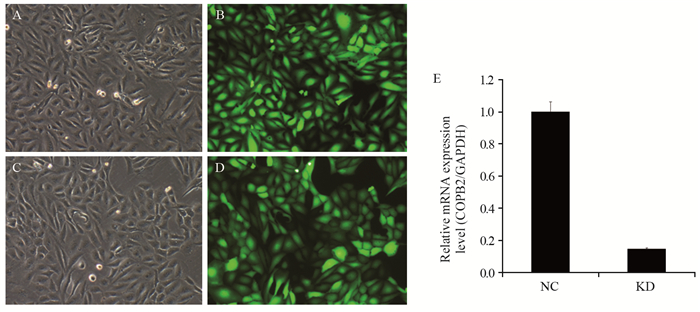
KD组和NC组U-2OS细胞在慢病毒感染后均贴壁成团生长,细胞形态呈不规则三角形或长梭形。荧光显微镜显示大部分细胞表达绿色荧光蛋白,提示慢病毒感染效率较高,见图 2A~2D。RT-qPCR结果显示KD组COPB2 mRNA表达水平为NC组的14.8%,差异有统计学意义(P=0.001),见图 2E。
|
| NC: control group; KD: silence group; U-2OS cells of NC(A, B) and KD(C, D) group: Under the microscope, U-2OS cells adhered to a cluster to grow, showing irregular triangle or long spindle shape, most of the cells expressed green fluorescent protein (×100); E: The mRNA expression level of COPB2 gene was significantly decreased in KD group (P=0.001). 图 2 慢病毒感染沉默COPB2基因 Figure 2 COBP2 gene was silenced by lentiviral |
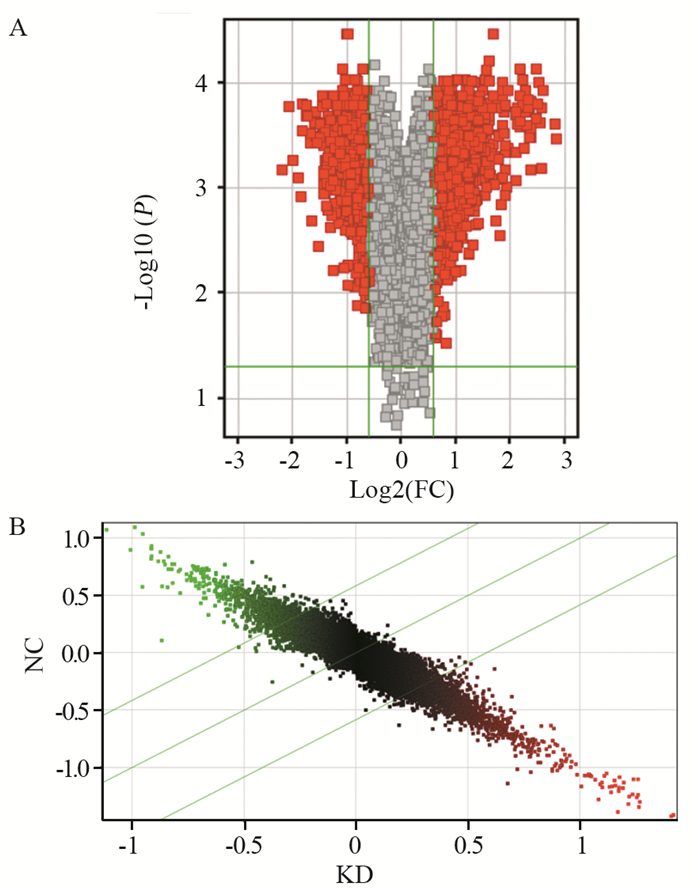
KD组COPB2表达水平较NC组下降4.0倍(FC=-4.0)。两组相比,1393个基因表达出现显著差异,其中上调基因数831个,下调基因数562个,见图 3。
|
| A: volcano plot; red indicated all probes with fold change greater than 1.5 and P < 0.05. KD was down-regulated relative to NC on the left and up-regulated on the right. B: Scatter plot: The upper part above the upper green line indicated that the KD exhibited a 1.5-fold down-regulation of the probe relative to the NC, and the lower part below the lower green line indicated that the KD exhibited a 1.5-fold up-regulation with respect to the NC. 图 3 人基因表达谱分析结果 Figure 3 Human gene expression profiling results |
经典通路分析结果显示,在已知的400条经典通路中,150条转导通路中差异基因富集达到显著水平(P < 0.05),其中3条转导通路|Z| > 2,这三条通路及其富集的差异基因包括凝血栓蛋白1(thrombospondin 1, TSP1)抑制血管形成通路、急性期反应通路、细胞周期蛋白和细胞周期调控通路,见表 1。
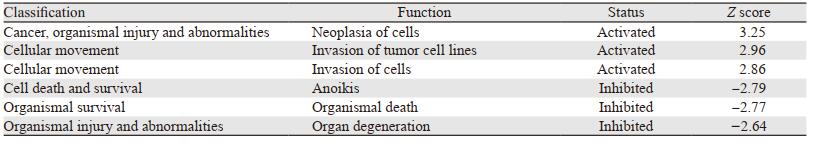
疾病功能分析结果显示,被激活的功能主要集中在恶性肿瘤、机体损伤与异常、细胞运动中,与细胞瘤变、肿瘤细胞侵袭和细胞侵袭相关。被抑制的功能主要集中在细胞生存与死亡、机体损伤与异常中,与细胞失巢凋亡、机体死亡和器官退变相关,见表 2。疾病功能分析结果显示COPB2基因与骨肉瘤细胞瘤变、侵袭力和失巢凋亡等功能相关。
互作网络分析结果显示差异基因的生物功能主要集中在恶性肿瘤、细胞周期和机体损伤与异常。差异基因包括ACSL3、AFF4、Alpha tubulin、ANKRD28、ANKRD37、BAG2、Beta Tubulin、CBLB、CCT5、DISC1、DNM3、DPCD、Dynamin、FKBP5、GSE1、HMG20A、ITSN1、LZTFL1、MED12、mediator、NDRG1、p85(pik3r)、PINK1、PPP4R3B、PPP6C、RPAP3、SCOC、SMARCC1、Spectrin、SYBU、TAB 2、TCP1、TGFBR2、TNKS、TTC8,该网络得分35分。
3 讨论骨肉瘤是一种由间充质干细胞或骨母细胞染色体异位、基因突变、细胞异常分化导致的高度恶性肿瘤,最常见于儿童和青少年[12]。手术联合化疗仍是骨肉瘤治疗的标准治疗方案,但局限性骨肉瘤患者5年生存率不超过70%,且出现肺转移后仅15%~30%,治疗效果差强人意[13]。特别是对于化疗药物反应不佳的骨肉瘤患者,目前临床缺乏行之有效的治疗手段[14]。究其原因,在于骨肉瘤的分子发病机制尚不明确。因此,对骨肉瘤发病机制的深入研究和新的精准治疗靶点的寻找极为重要。
本研究基于IPA生物信息学分析,对COPB2在人骨肉瘤中的可能作用和作用机制进行探析。结果显示COPB2在人骨肉瘤细胞系中呈高表达,可能通过TSP1抑制血管形成通路、急性期反应通路、细胞周期蛋白和细胞周期调控通路在肿瘤发生发展中起到重要作用,并对骨肉瘤细胞侵袭能力、增殖凋亡发挥调控作用。
IPA经典通路分析结果显示,三条通路被显著激活或抑制。TSP1是一种糖蛋白,来源于血小板的α颗粒,通过与CD47结合在止血和血管形成过程中发挥重要作用[15]。急性期反应是机体对外界刺激所作出的应激反应,表现为体内某种特殊分子浓度的改变,激发机体的特定功能,而细胞周期调控则维持着组织器官的正常功能及损伤修复。上述三个信号通路中,细胞周期调控通路与恶性肿瘤最为相关。细胞增殖异常与恶性肿瘤发生、发展关系密切。Cheng等[16]研究显示细胞周期调控蛋白在骨肉瘤的发生发展中起到关键作用,作为骨肉瘤治疗的药物靶点,有着较好的研究前景。细胞周期调控蛋白中,以cyclinD1(CCND1)、p21(CDKN1A)、cyclinD2(CCND2)和cyclinE2(CCNE2)与骨肉瘤关系密切,cyclinD1、cyclinD2和cyclinE2是G1期的主要调控蛋白,异常表达后会导致细胞周期G1期缩短,大量细胞进入S期,细胞增殖异常,已被证实与乳腺癌、肝癌等多种恶性肿瘤相关[17-18]。此外p21被证实在骨肉瘤肿瘤组织中的表达水平高于癌旁组织[19]。
COPB2作为外被体包被蛋白复合体Ⅰ的7个亚基之一,对细胞周期也具有一定的调控作用。COPB2能够辅助锌指X连接蛋白向细胞核内转运,促进rDNA转录,调控细胞增殖[3]。在恶性肿瘤领域,Wang等[6]以结肠癌细胞系为研究对象,应用慢病毒介导RNAi技术沉默COPB2表达,COPB2沉默组细胞增殖能力和细胞克隆能力下降,进一步发现COPB2沉默后p16和p21表达水平升高,从而cyclinA1和cyclinA2表达水平降低。研究结果提示COPB2基因能够通过调节cyclinA1、cyclinA2,对细胞周期发挥调控作用。因此,COPB2表达异常能够对细胞周期调控产生影响,促进恶性肿瘤的发生发展。
综上所述,COPB2在人骨肉瘤细胞系U-2OS、MG-63、HOS和Saos-2中高表达,可能通过细胞周期蛋白和细胞周期调控通路参与骨肉瘤的发生发展。此外,COPB2与骨肉瘤细胞瘤变、侵袭力和失巢凋亡相关。
作者贡献
崔云鹏、潘元星:实验实施、数据分析及论文撰写
林云飞:数据收集
米川、王冰:实验指导
施学东:研究设计及文章修改
| [1] |
Jackson LP. Structure and mechanism of COPI vesicle biogenesis[J]. Curr Opin Cell Biol, 2014, 29(1): 67-73. |
| [2] |
Arakel EC, Schwappach B. Formation of COPI-coated vesicles at a glance[J]. J Cell Sci, 2018, 131(5): jcs209890. DOI:10.1242/jcs.209890 |
| [3] |
Ganji arjenaki M, Nikpour P, Emadi-bygi M. The Potential Mechanism of ZFX Involvement in the Cell Growth[J]. Res Mol Med, 2016, 4(2): 24-29. DOI:10.18869/acadpub.rmm.4.2.24 |
| [4] |
Li ZS, Liu CH, Liu Z, et al. Downregulation of COPB2 by RNAi inhibits growth of human cholangiocellular carcinoma cells[J]. Eur Rev Med Pharmacol Sci, 2018, 22(4): 985-992. |
| [5] |
Li H, Song YH, Du ZP, et al. COPB2-shRNA suppresses cell growth and induces apoptosis of STAD SGC-7901 cells via inactivation of p38 MAPK/Smad2/Chk1/2 as an oncogene[J]. Transl Cancer Res, 2018, 7(6): 1714-1727. DOI:10.21037/tcr.2018.12.18 |
| [6] |
Wang Y, Chai Z, Wang M, et al. COPB2 suppresses cell proliferation and induces cell cycle arrest in human colon cancer by regulating cell cycle-related proteins[J]. Exp Ther Med, 2018, 15(1): 777-784. |
| [7] |
Pu X, Wang J, Li W, et al. COPB2 promotes cell proliferation and tumorigenesis through up-regulating YAP1 expression in lung adenocarcinoma cells[J]. Biomed Pharmacother, 2018, 103: 373-380. DOI:10.1016/j.biopha.2018.04.006 |
| [8] |
Christodoulou EG, Yang H, Lademann F, et al. Detection of COPB2 as a KRAS synthetic lethal partner through integration of functional genomics screens[J]. Oncotarget, 2017, 8(21): 34283-34297. DOI:10.18632/oncotarget.16079 |
| [9] |
Mi Y, Yu M, Zhang L, et al. COPB2 is Upregulated in Prostate Cancer and Regulates PC-3 Cell Proliferation, Cell Cycle, and Apoptosis[J]. Arch Med Res, 2016, 47(6): 411-418. DOI:10.1016/j.arcmed.2016.09.005 |
| [10] |
Bhandari A, Zheng C, Sindan N, et al. COPB2 is up-regulated in breast cancer and plays a vital role in the metastasis via N-cadherin and Vimentin[J]. J Cell Mol Med, 2019, 23(8): 5235-5245. DOI:10.1111/jcmm.14398 |
| [11] |
Krämer A, Green J, Pollard J Jr, et al. Causal analysis approaches in Ingenuity Pathway Analysis[J]. Bioinformatics, 2014, 30(4): 523-530. DOI:10.1093/bioinformatics/btt703 |
| [12] |
Lin YH, Jewell BE, Gingold J, et al. Osteosarcoma: Molecular Pathogenesis and iPSC Modeling[J]. Trend Mol Med, 2017, 23(8): 737-755. DOI:10.1016/j.molmed.2017.06.004 |
| [13] |
Song K, Song J, Lin K, et al. Survival analysis of patients with metastatic osteosarcoma: a Surveillance, Epidemiology, and End Results population-based study[J]. Int Orthop, 2019, 43(8): 1983-1991. DOI:10.1007/s00264-019-04348-4 |
| [14] |
Marina NM, Smeland S, Bielack SS, et al. Comparison of MAPIE versus MAP in patients with a poor response to preoperative chemotherapy for newly diagnosed high-grade osteosarcoma (EURAMOS-1): an open-label, international, randomised controlled trial[J]. Lancet Oncol, 2016, 17(10): 1396-1408. DOI:10.1016/S1470-2045(16)30214-5 |
| [15] |
Adams JC. Thrombospondin-1[J]. Int J Biochem Cell Biol, 1997, 29(6): 861-865. DOI:10.1016/S1357-2725(96)00171-9 |
| [16] |
Cheng L, Wang CC, Jing J. Cell Cycle Kinases in Osteosarcoma: Potential for Therapeutic Intervention[J]. Curr Pharm Des, 2016, 22(31): 4830-4834. DOI:10.2174/1381612822666160512151028 |
| [17] |
John RR, Malathi N, Ravindran C, et al. Mini review: Multifaceted role played by cyclin D1 in tumor behavior[J]. Indian J Dent Res, 2017, 28(2): 187-192. DOI:10.4103/ijdr.IJDR_697_16 |
| [18] |
金东岭, 时志民, 田珂. 乳腺癌中cyclinD2、CDK4的表达及其临床意义[J]. 肿瘤防治研究, 2005, 32(8): 481-483. [Jin DL, Shi ZM, Tian K. Clinical Significance and Expression of cyclin D2, CDK4 in Human Breast Carcinoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2005, 32(8): 481-483. DOI:10.3971/j.issn.1000-8578.3295] |
| [19] |
李月白, 秦国斌, 王义生, 等. 人骨肉瘤中p21wafl/cip1基因的表达[J]. 中华骨科杂志, 2000, 20(1): 30-34. [Li YB, Qin GB, Wang YS, et al. The expression of p21wafl/cip1 gene in human osteosarcoma[J]. Zhonghua Gu Ke Za Zhi, 2000, 20(1): 30-34. DOI:10.3760/j.issn:0253-2352.2000.01.007] |
 2020, Vol. 47
2020, Vol. 47