文章信息
- 原发性食管恶性黑色素瘤1例报道并文献复习
- Primary Esophageal Malignant Melanoma: A Case Report and Literature Review
- 肿瘤防治研究, 2020, 47(3): 223-226
- Cancer Research on Prevention and Treatment, 2020, 47(3): 223-226
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1054
- 收稿日期: 2019-08-19
- 修回日期: 2019-11-28
2. 200072 上海,同济大学附属上海市第十人民医院肿瘤科;
3. 200072 上海,同济大学癌症中心;
4. 200090 上海,同济大学附属杨浦医院全科医学科
2. Department of Oncology, The Tenth People's Hospital, Tongji University, Shanghai 200072, China;
3. Tongji University Cancer Center, Shanghai 200072, China;
4. Department of General Practice, Tongji University, Yangpu Hospital, Shanghai 200090, China
原发性食管恶性黑色素瘤(primary malignant melanoma of the esophagus, PMME)是一种非常罕见的疾病,易侵及血管,更易出现疾病复发和转移,预后较差。患者诊断时多处于肿瘤晚期阶段,目前尚无标准治疗方案。本文介绍1例晚期食管胃恶性黑色素瘤经过手术治疗、化疗联合抗血管治疗、免疫联合抗血管治疗,至今生存超过1年的个案,并复习相关文献,供同行参考。
1 病例资料患者,男,63岁,因进食梗咽不适3月就诊。2018年6月22日胃镜病理检查:(食管距门齿37~45 cm)组织表面被覆复层鳞状上皮,间质内见梭形细胞弥漫分布,细胞异型明显,核分裂相罕见,考虑为间叶源性梭形细胞肿瘤。免疫组织化学:CK(-),CK7(-),CK20(-),p40(-),p63(-),Vimentin(+),CD34(-),Ki67 50%(+)。2018年7月9日上腹部CT示食管下段贲门、胃底占位,周围淋巴结肿大。2018年7月17日全麻下行食管下端及胃底肿物切除术,术中探查食管下段及胃底分别扪及肿瘤各约3、4 cm直径大小,周围淋巴结肿大。术后病理:(下段食道及近端胃切除根治标本)恶性黑色素瘤(图 1~2),见肿瘤两枚,位于食管下端近贲门处,大小分别为4.5 cm×3.8 cm×3.0 cm及5.0 cm×3.5 cm×2.8 cm,两者相距约3.0 cm;另送“食管贲门切缘”和“胃底切缘”未见肿瘤累及;淋巴结情况:贲门旁组2/4,小弯侧0/8,大弯侧0/5有转移;大网膜未见肿瘤累及;免疫组织化学: CK(-), CK7(-),CK20(-),CEA(-),Villin(-),p40(-),CK5/6(-),Vimentin(+), A103(+),S-100(+),HMB45(-),CK8/18(-),p53(+),Ki67 50%(+);BRAF、C-KIT基因检测未见突变。患者2013年因“左肾透明细胞癌”行左肾切除术,无高血压及糖尿病病史,否认肿瘤家族史。
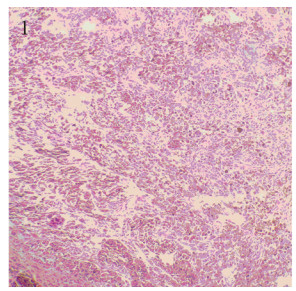
|
| 图 1 患者食管肿瘤切除术后病理HE染色图片(HE×100) Figure 1 Postoperative pathological HE staining pictures of patients esophageal tumor (HE×100) |
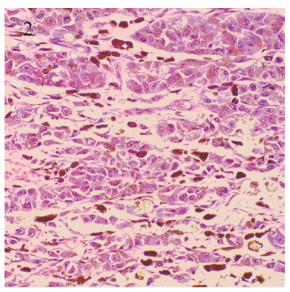
|
| 图 2 患者食管肿瘤病理HE染色图片可见色素沉着(HE×400) Figure 2 Pathological HE staining picture showed pigmentation (HE ×400) |
2018年9月1日患者入院接受术后辅助化疗,治疗前进行基线评估,2018年9月3日上腹CT:肝脏多发转移性病灶,见图 3。2018年9月1日乳酸脱氢酶(lactate dehydrogenase, LDH)171 u/L。依据2009版上呼吸道消化道黑色素瘤AJCC分期,患者诊断为PMME ⅣC期。因患者单肾,为保护患者肾功能,2018年9月3日、2018年9月25日开始两疗程替莫唑胺(300 mg, qd, d1~5)+恩度(15 mg, qd, d1~14)q3w联合治疗,而未加入铂类化疗,化疗后无明显不良反应。两疗程后评估,2018年10月17日胸部CT示T9、10椎体及T12密度不均匀降低,考虑转移性病变,见图 4,此时LDH 173 u/L,考虑患者出现新发骨转移,评估疾病进展(progressive disease, PD),更改治疗方案。定期行唑来膦酸骨修复治疗。
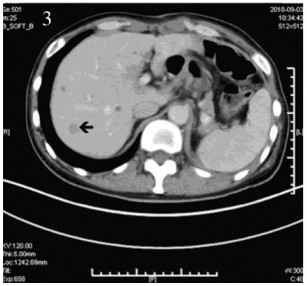
|
| 图 3 腹部CT示肝脏转移 Figure 3 Abdominal CT showed liver metastasis |
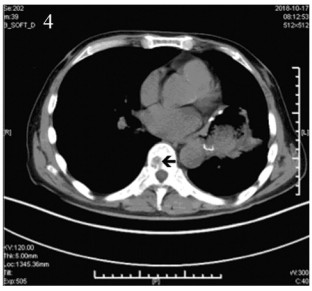
|
| 图 4 胸部CT示骨转移 Figure 4 Chest CT showed bone metastasis |
2018年10月22日、2018年11月12日开始行第一、二疗程免疫联合抗血管生成治疗:帕博利珠单抗(100 mg, d1)+安罗替尼(12 mg, qd, d1~14)q3w。治疗前检查甲状腺、肝肾功能正常,无免疫性基础疾病。治疗不良反应:骨关节酸痛,余无明显不适。两疗程治疗后进行评估,2018年11月29日LDH 272 u/L,病情评估疾病稳定(stable disease, SD)。2018年12月3日、2018年12月24日行第三、四疗程免疫加抗血管生成治疗后行疗效评估,2019年1月7日上腹部增强CT示右侧肾上腺转移性病灶,见图 5。2019年1月8日LDH 356 u/L。患者出现右侧肾上腺新发转移,肝脏病灶较前增多,病情评估PD。后患者因达到帕博利珠单抗及安罗替尼赠药,要求继续原方案治疗,2019年1月14日、2019年2月3日行第五、六疗程免疫加抗血管生成治疗,剂量同前。治疗后再次评估,2019年2月21日疗效评估PD,此时LDH 698 u/L,治疗过程中患者有反酸不适。
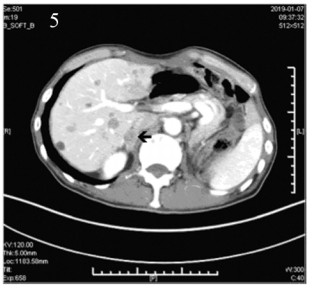
|
| 图 5 腹部CT示右肾上腺转移 Figure 5 Abdominal CT showed right adrenal metastasis |
2019年2月22日、2019年3月22日行两疗程白蛋白紫杉醇(200 mg, d1, d8)+安罗替尼(12 mg, qd, d1~14)q3w联合治疗。不良反应:Ⅳ度骨髓抑制(中性粒细胞绝对值0.36×109/L),后行升白细胞治疗后恢复至正常水平。两疗程后疗效评估为SD。因患者出现Ⅳ度骨髓抑制,后将安罗替尼治疗剂量下调,2019年4月12日继续行第三疗程白蛋白紫杉醇(200 mg, d1, d8)+安罗替尼(10 mg, qd, d1~14)q3w联合治疗。2019年5月7日继续第四疗程白蛋白紫杉醇(200 mg, d1, d8)+安罗替尼(10 mg, qd, d1~14)q3w方案治疗,治疗后白细胞Ⅱ度降低,升白细胞治疗后恢复正常,余无明显乏力等不适反应。2019年5月29日LDH 373 u/L,疗效评估仍为SD。患者体力状况(KPS)评分80分,生活质量较好。
2 讨论PMME是一种侵袭性较高的恶性肿瘤,该疾病易发生转移,多数PMME确诊时已有40%~49%发生转移,周围淋巴结转移占40%~80%,肝转移占31%,纵隔淋巴结转移占19%,肺转移占18%,脑转移占13%[1]。一项包括21例Ⅲ~Ⅳ期PMME患者研究中,总生存期为1~40月,中位生存时间为10月,所有患者均无内脏转移[2]。另一项研究存在远处转移PMME患者,中位生存期3.7月,1年和3年总生存期(overall survival, OS)分别为18%和0[3]。一例晚期食管-胃黑色素瘤患者在术后1月发生复发及转移,术后3.5月死亡[4]。原发胃恶性黑色素瘤全世界报道案例较少,本例患者食管及胃底病灶较近,考虑为PMME移行转移至胃可能性较大,诊断肝转移至今超过1年,目前仍存活并接受治疗中,较既往报道生存期明显延长,显示较好的治疗效果。
手术是最常报道的治疗方法。一项研究中报道,初次手术和复发间隔仅为4.5月[2],本例患者术后至发生肝转移仅1.5月,反映了PMME较强的侵袭性。研究报告了较高区域淋巴结转移率77.78%,且区域淋巴结转移患者中位生存期较短[2]。另一项研究显示淋巴结转移是患者术后生存的一项独立预后不良因素[5],本例患者术后病理显示贲门旁淋巴结2/17转移,提示患者预后较差。
由于其罕见性,PMME尚无标准治疗。国内一项恩度或安慰剂联合达卡巴嗪一线治疗无法手术切除的ⅢC期或Ⅳ期黑色素瘤患者的多中心双盲、随机对照Ⅱ期临床研究中入组患者110例,按1:1的比例随机分为A组(达卡巴嗪250 mg/m2 d1~5+安慰剂d1)和B组(达卡巴嗪250 mg/m2 d1~5+恩度7.5 mg/m2 d1~14)每21天为1周期。安慰剂组和恩度组的中位无进展生存期(progression free survival, PFS)分别为1.5和4.5月,两组中位OS分别为8.0和12.0月,1年生存率分别为22.5%和49.7%。两组不良反应相似,总体治疗耐受性良好,表明恩度联合达卡巴秦较达卡巴嗪单药可明显延长无进展生存及总生存[6]。结合本例患者有左肾切除史,用药过程中需保护患者肾脏功能,我们治疗中未联合使用铂类药物。首次治疗使用替莫唑胺联合恩度,治疗两周期后患者出现新发骨转移考虑疾病进展,但治疗中LDH基本稳定。在帕博利珠单抗联合安罗替尼治疗进展后,再次使用白蛋白紫杉醇化疗联合安罗替尼抗血管生成治疗中,患者首次达到3月疾病稳定过程。盐酸安罗替尼是我国自主研发的一种新型的口服酪氨酸激酶抑制剂,能有效抑制血管内皮生长因子受体、血小板衍生生长因子受体、纤维母细胞生长因子受体、干细胞因子受体等激酶,具有抗肿瘤血管生成和抑制肿瘤生长的双重作用[7]。患者在两个阶段的化疗联合抗血管生成治疗过程中LDH水平无上升趋势,疾病控制稳定,表明患者对化疗联合抗血管生成治疗有效。
关于免疫检查点抑制剂抗PD-1治疗,在皮肤恶性黑色素瘤中取得较好的疗效,而在黏膜恶性黑色素瘤中研究较少。一项研究包含12例PMME使用抗PD-1治疗效果分析,治疗反应率为75%,中位反应持续时间11.4月[8]。国内一项PD-1单抗(JS001)联合阿昔替尼治疗黏膜型黑色素瘤的Ⅰ期临床研究报告了两药联合客观缓解率高达50%,疾病控制率为87.5%,总体不良反应可耐受[9]。本例患者在首次化疗进展后,调整治疗中使用PD1+安罗替尼联合治疗,共行六周期治疗,过程中患者疾病持续进展,肝脏病灶持续增大,新发肾上腺转移,且LDH持续升高,表明本例患者PD-1治疗效果较差。这与另一项研究结果相似,研究表明PD-1检查点抑制剂单药治疗在黏膜黑色素瘤患者,特别是有内脏转移的患者(ORR 17.6%)治疗效果不理想[10]。虽然PMME免疫治疗报道案例较少,且疗效有差异,还需更多的病例验证其疗效,但免疫治疗仍为转移性和不可切除疾病患者提供一定的机会。
PMME患者中有一定比例患者发生BRAF、C-KIT基因突变,对于基因突变者采用相应的维莫非尼、伊马替尼等显示较好疗效[11],本例患者未发生相关BRAF、C-KIT基因突变而未使用相关靶向治疗。
LDH是恶性黑色素瘤的一项肿瘤标志物。本例患者在两阶段化疗联合抗血管生成治疗中LDH水平相对平稳,并且在白蛋白紫杉醇联合安罗替尼用药过程中有下降趋势,见图 6,而在免疫治疗联合安罗替尼过程中明显升高,表明该患者对化疗联合抗血管生成治疗较免疫联合抗血管治疗显示较好的疗效。
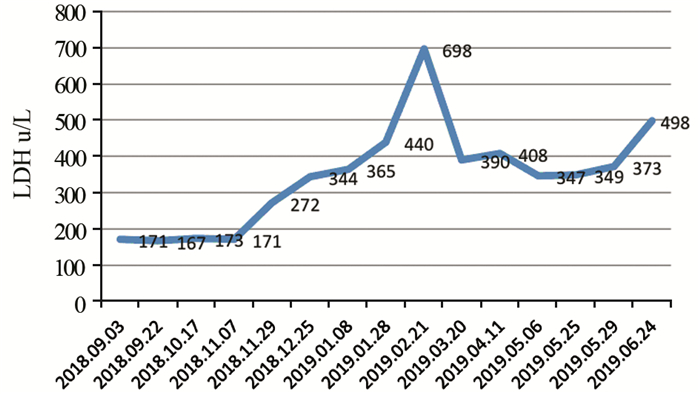
|
| 图 6 患者乳酸脱氢酶水平 Figure 6 Lactate dehydrogenase levels of patient |
PMME是一种高度侵袭性肿瘤,容易发生远处转移,预后极差。单一用药效果较差,联合用药应该是未来治疗的方向。本例患者在发生肝脏转移后,在考虑保护肾脏功能用药情况下,生存期至目前超过1年,显示治疗相对成功,有一定参考价值。
作者贡献
赵华新:临床资料收集及文章撰写
杨森:提供病理图片及说明
郭献灵:论文指导
许青:文章修改及审核
| [1] |
Matsutani T, Onda M, Miyashita M, et al. Primary malignant melanoma of the esophagus treated by esophagectomy and systemic chemotherapy[J]. Dis Esophagus, 2001, 14(3-4): 241-244. DOI:10.1046/j.1442-2050.2001.00193.x |
| [2] |
Sun H, Gong L, Zhao G, et al. Clinicopathological characteristics, staging classification, and survival outcomes of primary malignant melanoma of the esophagus[J]. J Surg Oncol, 2018, 117(4): 588-596. DOI:10.1002/jso.24905 |
| [3] |
Weiner JP, Shao M, Schwartz D, et al. Patterns of care and survival outcomes in the treatment of esophageal melanoma[J]. Dis Esophagus, 2017, 30(2): 1-6. |
| [4] |
Wang L, Zong L, Nakazato H, et al. Primary advanced esophago-gastric melanoma: A rare case[J]. World J Gastroenterol, 2016, 22(11): 3296-3301. DOI:10.3748/wjg.v22.i11.3296 |
| [5] |
Ahn JY, Hwang HS, Park YS, et al. Endoscopic and Pathologic Findings Associated with Clinical Outcomes of Melanoma in the Upper Gastrointestinal Tract[J]. Ann Surg Oncol, 2014, 21(8): 2532-2539. DOI:10.1245/s10434-014-3637-2 |
| [6] |
Cui C, Mao L, Chi Z, et al. A phase Ⅱ, randomized, double-blind, placebo-controlled multicenter trial of Endostar in patients with metastatic melanoma[J]. Mol Ther, 2013, 21(7): 1456-1463. DOI:10.1038/mt.2013.79 |
| [7] |
Xie C, Wan X, Quan H, et al. Preclinical characterization of anlotinib, a highly potent and selective vascular endothelial growth factor receptor-2 inhibitor[J]. Cancer Sci, 2018, 109(4): 1207-1219. |
| [8] |
Wang X, Kong Y, Chi Z, et al. Primary malignant melanoma of the esophagus: A retrospective analysis of clinical features, management, and survival of 76 patients[J]. Thorac Cancer, 2019, 10(4): 950-956. |
| [9] |
Jun G, Sheng X, Si L, et al. A phase Ⅰb study of JS001, a humanized IgG4 mAb against programmed death-1 (PD-1) combination with axitinib in patients with metastatic mucosal melanoma[J]. J Clin Oncol, 2018, 36(15_suppl): 9528. DOI:10.1200/JCO.2018.36.15_suppl.9528 |
| [10] |
D'Angelo SP, Larkin J, Sosman JA, et al. Efficacy and Safety of Nivolumab Alone or in Combination With Ipilimumab in Patients With Mucosal Melanoma: A Pooled Analysis[J]. J Clin Oncol, 2017, 35(2): 226-235. DOI:10.1200/JCO.2016.67.9258 |
| [11] |
Langer R, Becker K, Feith M, et al. Genetic aberrations in primary esophageal melanomas: molecular analysis of c-KIT, PDGFR, KRAS, NRAS and BRAF in a series of 10 cases[J]. Mod Pathol, 2011, 24(4): 495-501. DOI:10.1038/modpathol.2010.220 |
 2020, Vol. 47
2020, Vol. 47


