文章信息
- 培美曲塞为主的化疗方案治疗中老年非霍奇金淋巴瘤回顾性分析
- Retrospective Analysis of Pemetrexed-based Chemotherapy Regimens on Mid-elderly Non-Hodgkin's Lymphoma
- 肿瘤防治研究, 2020, 47(2): 119-123
- Cancer Research on Prevention and Treatment, 2020, 47(2): 119-123
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.1003
- 收稿日期: 2019-08-06
- 修回日期: 2019-11-12
2. 100021 北京,北京市朝阳区三环肿瘤医院内科
2. Department of Internal Medicine, Sanhuan Cancer Hospital, Beijing 100021, China
淋巴瘤是中国十大常见恶性肿瘤之一,据国家癌症中心2015年中国恶性肿瘤流行情况分析报告显示,淋巴瘤年新死亡病例约5万例,病死率为3.62/10万,中国调整死亡率为2.39/10万。2004—2016年淋巴瘤死亡率以每年4.5%的速度呈逐年上升趋势[1]。如何治疗复发或难治性淋巴瘤是淋巴瘤领域面临的主要挑战之一,由于老年患者常难以耐受常规剂量治疗,预后较年轻患者差,所以在临床上寻找更安全有效的治疗方案显得尤为迫切。
结构上与甲氨蝶呤类似,培美曲塞(Pemetrexed, PEM)是一种含有核心为吡咯嘧啶基团的抗叶酸制剂,但作用靶点更多,应用更简单,无需水化、碱化或解毒。培美曲塞药物治疗的安全性,尤其是极低的骨髓抑制毒性,已经在晚期肺癌患者的长期维持治疗中获得证实[2-3];而在淋巴瘤解救化疗,尤其是侵及中枢神经系统的淋巴瘤治疗中的价值,也日益受到重视[4-5]。因此,本研究旨在系统性回顾中国医学科学院肿瘤医院内科采用以培美曲塞为主的化疗方案治疗非霍奇金淋巴瘤(non-Hodgkin lymphoma, NHL)的10例患者资料,初步探讨以培美曲塞为主的化疗方案对NHL的有效性和安全性。
1 资料与方法 1.1 研究对象回顾性收集2016年11月—2018年10月我院收治的NHL患者临床资料。纳入标准:经病理形态学和免疫组织化学确诊为NHL;既往接受含培美曲塞为主的化疗方案;无主要器官功能障碍,心、肺功能检查、血常规、肝脏及肾脏功能检查显示无化疗禁忌。排除标准:患遗传性免疫缺陷及其他获得性免疫系统疾病,如获得性免疫缺陷综合征等;有严重的心、肺、肝、肾等器官功能障碍或器质性病变;精神性疾病患者。入组所有患者化疗前均已签署知情同意书。
1.2 研究方法回顾性收集患者的各项临床资料,记录入选患者的人口学资料(年龄、性别)、一般状态KPS评分、影像学资料、实验室检查、化疗方案及周期、疗效评价及不良反应等信息。原发中枢神经系统淋巴瘤治疗评价标准采用2005年国际淋巴瘤协作组制定的“PCNSL治疗评价标准”[6],弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma, DLBCL)、T淋巴细胞淋巴瘤疗效评价采用2014年修订的Lugano标准[7],将疗效分为完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)和疾病进展(progressive disease, PD);不良反应采用WHO抗癌药物常见不良反应分级标准,分为Ⅰ~Ⅳ级,若出现严重的不良反应,则减量或停止化疗。
1.3 随访采用门诊和电话随访,随访时间截至2019年5月31日。无进展生存期(progression-free survival, PFS)定义为肿瘤患者接受培美曲塞治疗至疾病进展或死亡的时间,总生存期(overall survival, OS)定义为肿瘤患者第一次接受治疗至死亡的时间。
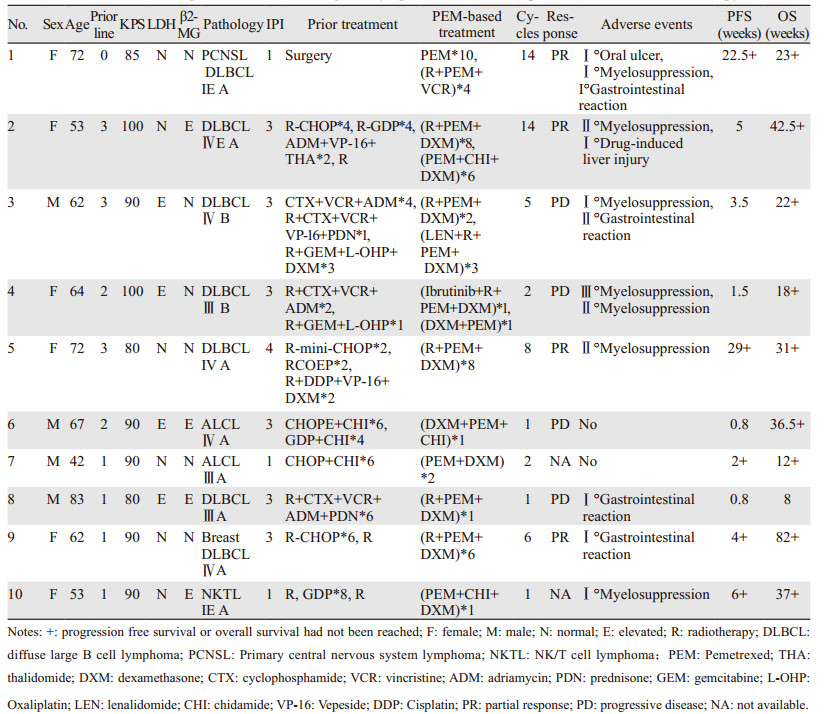
2 结果 2.1 临床资料入组10例接受以培美曲塞为主的化疗方案的NHL患者,男4例,女6例,平均年龄63.2岁(42~83岁),其中60岁以上老年患者7例(70%)。病理类型主要包括DLBCL 7例、血管免疫母T细胞淋巴瘤(angioimmunoblastic T cell lymphoma, AITL)2例和结外NK/T细胞淋巴瘤(extranodal NK/T cel lymphoma, NKTL)1例。10例患者中有1例为术后初治化疗患者,其余皆为复发或难治性病例。疾病分期分布为Ⅰ期2例、Ⅱ期0例、Ⅲ期3例、Ⅳ期5例,晚期Ⅲ~Ⅳ期患者占多数(80%)。所有患者体力评分均为80分以上,具有较好的体力功能。10例患者的临床资料见表 1。
|
10例患者中8例可评价疗效,2例因化疗周期尚未达到疗效评价时间,继续接受化疗,仅纳入不良反应评价。截至随访结束,1例患者2019年1月7日死亡,考虑为疾病进展所致,与药物无关。平均化疗周期为5.4(1~14)周期。
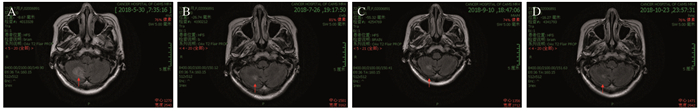
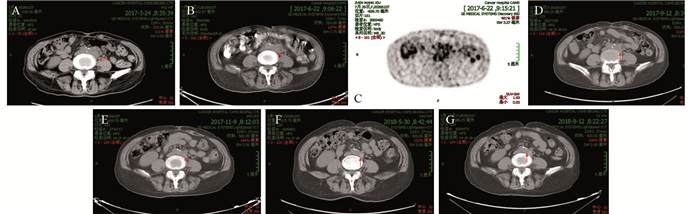
值得注意的是:患者中病例1为原发性中枢神经系统淋巴瘤(primary central nervous system lymphoma, PCNSL),在行枕叶肿物切除术后行培美曲塞单药治疗10周期,疗效评价PR,7月后疾病复发,继续行利妥昔单抗、培美曲塞二钠、长春新碱化疗4周期,疗后评价仍为PR,不良反应可控,见图 1。病例5为DLBCL,在接受三线化疗后,疾病进展,给予利妥昔单抗、培美曲塞、地塞米松化疗8周期,后发生Ⅱ度骨髓抑制,疗效评价为PR,见图 2。
|
| A: before treatment, abnormal signal area was in the right cerebellum, about 2.4cm×2.8cm; B: after two cycles of PEM-based chemotherapy, the abnormal signal area was about 1.3cm×1.2cm; C: after 4 cycles of PEM-based chemotherapy, the abnormal signal area was about 1.3cm×1.2cm; D: after 6 cycles of PEM-based chemotherapy, the abnormal signal area was about 0.9cm×0.8cm. 图 1 典型病例1原发性中枢神经系统淋巴瘤患者脑核磁影像图 Figure 1 Magnetic image of typical case one with PCNSL |
|
| A: before treatment, multiple lymph nodes in the abdominal cavity, retroperitoneum, bilateral paraaortic and bilateral inguinal hernia. The largest one was about 2.7cm×2.0cm; B, C: PET-CT after 5 cycles of PEM-based chemotherapy, Deauville 4 points. Multiple lymph nodes in the abdominal cavity, retroperitoneum, bilateral paraaortic and bilateral inguinal hernia, the largest one was about 2.1×1.7cm, and the maximum SUV was 4.1; D: after 8 cycles of PEM-based chemotherapy, multiple lymph nodes in the abdominal cavity, retroperitoneum, bilateral paraaortic and bilateral inguinal hernia, and the largest one was about 2.1cm×1.5cm; E: two months after chemotherapy, multiple lymph nodes in the peritoneal cavity, retroperitoneum and bilateral iliac vessels. The largest one was about 1.0 cm; F: nine months after chemotherapy, multiple lymph nodes in the cavity and retroperitoneum, the largest one was about 0.9cm; G: 12 months after chemotherapy, there was no obvious enlarged lymph node in the abdominal cavity, retroperitoneum, bilateral paraaortic or bilateral inguinal hernia. 图 2 典型病例5弥漫大B细胞淋巴瘤患者PET-CT图 Figure 2 PET-CT images of typical case five with DLBCL |
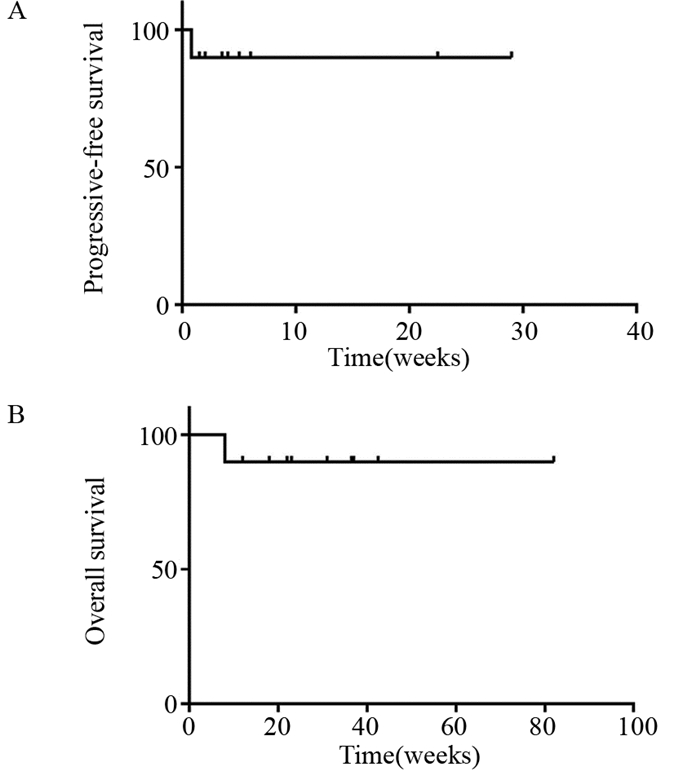
7例DLBCL患者中,4例PR,3例PD,ORR为57%,获得PR患者接受≥6周期含培美曲塞方案的全身化疗。截至2019年5月31日,3月无进展生存率为71.4%,1年总生存率85.7%,2年总生存率42.9%,3年总生存率28.6%。全组患者无进展生存曲线和总生存曲线见图 3。
|
| 图 3 全组患者无进展生存曲线(A)和总生存曲线(B) Figure 3 Progression-free survival(A) and overall survival (B) of all patients |
全组10例患者发生的主要不良反应共计13例次,分别为Ⅰ度口腔溃疡(1/13)、Ⅰ度骨髓抑制(3/13)、Ⅰ度胃肠道反应(3/13)、Ⅰ度药物性肝损伤(1/13)、Ⅱ度骨髓抑制(3/13)、Ⅱ度胃肠道反应(1/13)、Ⅲ度骨髓抑制(1/13),停药或对症处理后均恢复。其中Ⅰ级不良反应占61.5%(8/13),Ⅱ级不良反应占30.8%(4/13),Ⅲ级不良反应7.7%(1/13)。
3 讨论弥漫大B细胞淋巴瘤(DLBCL)是非霍奇金淋巴瘤(NHL)中最常见的病理类型,在我国约占NHL的40%,虽然一线R-CHOP方案可使60%DLBCL患者达到长期缓解,但仍有40%患者最终会转变成复发或难治性DLBCL,除了少部分患者经过挽救治疗及移植巩固达到治愈,20%~30%的患者目前仍缺乏有效的治疗手段[8-9]。原发性中枢神经系统淋巴瘤(PCNSL)是一种较少见的结外非霍奇金淋巴瘤,病理类型以弥漫大B细胞型为主,预后差,具有高度侵袭性,在诊断后的2年内有35%~60%患者出现治疗后复发,中位OS约8~18月[10-11],大剂量甲氨蝶呤由于能透过血脑屏障,是可选治疗方案之一,但不良反应严重,常需进行水化、碱化及叶酸解毒,应用繁琐,老年患者常难以耐受常规剂量治疗。因此,临床上需要寻找一个更加安全有效的治疗方案。
目前,PCNSL尚无标准治疗方案,但已有甲氨蝶呤、培美曲塞、替莫唑胺和利妥昔单抗等药物治疗PCNSL的初步报道。国外,Raizer等[12]采用大剂量培美曲塞(900 mg/m2)治疗复发难治性PCNSL 5周期后,6月疾病无进展生存率为45%,有效率(response rate, RR)为55%,疾病控制率(disease control rate, DCR)达91%,中位无进展生存期(progression-free survival, PFS)为5.7月,中位总生存期(overall survival, OS)为10.1月,有1例患者因3级血小板减少停止治疗。Han等[13]使用培美曲塞单药治疗12例老年PCNSL患者,4例CR,6例PR,2例PD,PFS为9月,OS为19.5月。国内也对培美曲塞的疗效及安全性进行了探索,王勇等[5]采用大剂量培美曲塞(900 mg/m2)治疗复发性PCNSL的总有效率为71.4%,无Ⅳ级不良反应。王勇等[14]采用大剂量培美曲塞联合替莫唑胺一线治疗9例PCNSL,6例CR,3例PR,不良反应主要为Ⅰ~Ⅲ度。另一方面,甲氨蝶呤、替莫唑胺和替莫唑胺联合利妥昔单抗的治疗效果及安全性皆不尽人意。Wong等[15]采用单药替莫唑胺治疗7例复发性PCNSL患者,无进展生存期为2月,总生存期为4月,有效率为14%。Nayak等[16]使用替莫唑胺联合利妥昔单抗治疗复发性PCNSL患者,完全缓解率为14%,中位无进展生存时间为7周。韩淑梅[17]回顾性分析了培美曲塞与大剂量甲氨蝶呤治疗PCNSL的疗效,结果显示培美曲塞治疗组RR为75.00%,DCR为75.00%,PFS为9月,OS为19.5月,1年和2年生存率分别为75.00%和43.75%;甲氨蝶呤组RR为69.30%,DCR为76.92%,PFS为9月,OS为13月,1年和2年生存率分别为69.23%和46.15%,两组间差异无统计学意义;甲氨蝶呤组的不良事件严重程度高于培美曲塞组。本研究中使用培美曲塞作为挽救方案治疗PCNSL,疾病控制时间长达22.5周,显示以培美曲塞为主的化疗方案治疗PCNSL具有较好的疗效和安全。
据文献报道,PNCSL即使达到CR,也有约50%患者会复发,选择不良反应小、能透过血脑屏障的药物将是挽救治疗的首选。而培美曲塞相比于指南推荐的甲氨蝶呤,不需要水化,不良反应也比较可控,临床已证明能透过血脑屏障,故培美曲塞可能是挽救治疗的可选方案之一。本组7例患者多次进展或复发后,挽救化疗应用培美曲塞治疗后,4例都取得一定时间的肿瘤缓解,复发后再次治疗仍能达到部分缓解,说明了培美曲塞对DLBCL患者可能具有一定的疗效。使用培美曲塞治疗DLBCL主要为Ⅰ~Ⅱ级不良反应。
本研究结果显示,以培美曲塞为主的化疗方案治疗弥漫大B细胞淋巴瘤患者,尤其是原发性中枢神经系统淋巴瘤,可能有一定的有效性,且安全性可控。培美曲塞为主的化疗方案治疗T细胞淋巴瘤是否有效需要进一步探讨。
作者贡献
温霆宇:收集病例数据,统计分析,论文撰写与修改
桂琳、靳君、张维、王婷:观察病例,收集数据
石远凯:指导论文修改,审核数据及统计分析结果
刘鹏:观察病例,收集数据,论文修改
| [1] |
郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28. [Zheng RS, Sun KX, Zhang SW, et al. Report of cancer epidemiology in China, 2015[J]. Zhonghua Zhong Liu Za Zhi, 2019, 41(1): 19-28.] |
| [2] |
Adjei AA. Pemetrexed (ALIMTA), a novel multitargeted antineoplastic agent[J]. Clin Cancer Res, 2004, 10(12 Pt 2): 4276s-4280s. |
| [3] |
Cohen MH, Johnson JR, Wang YC, et al. FDA drug approval summary: pemetrexed for injection (Alimta) for the treatment of non-small cell lung cancer[J]. Oncologist, 2005, 10(6): 363-368. |
| [4] |
Villano JL, Koshy M, Shaikh H, et al. Age, gender, and racial differences in incidence and survival in primary CNS lymphoma[J]. Br J Cancer, 2011, 105(9): 1414-1418. |
| [5] |
王勇, 王秀华, 赵玉娥, 等. 培美曲塞治疗原发性中枢神经系统淋巴瘤复发患者的疗效观察[J]. 中华血液学杂志, 2014, 35(1): 46-49. [Wang Y, Wang XH, Zhao YE, et al. Curative effect of pemetrexed on the treatment of relapsed primary central nervous system lymphoma[J]. Zhonghua Xue Ye Xue Za Zhi, 2014, 35(1): 46-49.] |
| [6] |
O'Connor OA, Pro B, Pinter-Brown L, et al. Pralatrexate in patients with relapsed or refractory peripheral T-cell lymphoma: results from the pivotal PROPEL study[J]. J Clin Oncol, 2011, 29(9): 1182-1189. |
| [7] |
Abrey LE, Batchelor TT, Ferreri AJ, et al. Report of an international workshop to standardize baseline evaluation and response criteria for primary CNS lymphoma[J]. J Clin Oncol, 2005, 23(22): 5034-5043. |
| [8] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7-30. |
| [9] |
Morton LM, Wang SS, Devesa SS, et al. Lymphoma incidence patterns by WHO subtype in the United States, 1992-2001[J]. Blood, 2006, 107(1): 265-276. |
| [10] |
Grommes C, DeAngelis LM. Primary CNS Lymphoma[J]. J Clin Oncol, 2017, 35(21): 2410-2418. |
| [11] |
Hoang-Xuan K, Bessell E, Bromberg J, et al. Diagnosis and treatment of primary CNS lymphoma in immunocompetent patients: guidelines from the European Association for Neuro-Oncology[J]. Lancet Oncol, 2015, 16(7): e322-e332. |
| [12] |
Raizer JJ, Rademaker A, Evens AM, et al. Pemetrexed in the treatment of relapsed/refractory primary central nervous system lymphoma[J]. Cancer, 2012, 118(15): 3743-3748. |
| [13] |
Han S, Wang M, Liu B, et al. Pemetrexed for primary central nervous system lymphoma in the elderly[J]. Clin Transl Oncol, 2016, 18(2): 138-143. |
| [14] |
王勇, 陶荣杰, 贺峭伟, 等. 大剂量培美曲塞联合替莫唑胺一线治疗九例原发中枢神经系统淋巴瘤的临床观察[J]. 中华血液学杂志, 2016, 37(3): 242-244. [Wang Y, Tao RJ, He QW, et al. High-dose pemetrexed in combination with temolozomide for the treatment of newly diagnosed primary central nervous system lymphoma[J]. Zhonghua Xue Ye Xue Za Zhi, 2016, 37(3): 242-244.] |
| [15] |
Wong SF, Gan HK, Cher L. A single centre study of the treatment of relapsed primary central nervous system lymphoma (PCNSL) with single agent temozolomide[J]. J Clin Neurosci, 2012, 19(11): 1501-1505. |
| [16] |
Nayak L, Abrey LE, Drappatz J, et al. Multicenter phase Ⅱ study of rituximab and temozolomide in recurrent primary central nervous system lymphoma[J]. Leuk Lymphoma, 2013, 54(1): 58-61. |
| [17] |
韩淑梅.培美曲塞治疗老年原发性中枢神经系统淋巴瘤临床及基因组学研究[D].山东大学, 2018. [Han SM. Clinical observation and genomics study in pemetrexed treatment for primary central nervous system lymphoma in the elderly[D]. Shandong university, 2018.]
|
 2020, Vol. 47
2020, Vol. 47


