文章信息
- 配比结构影响mPEG-PCL顺铂纳米粒子体外抗肿瘤的作用
- Cisplatin-loaded mPEG-PCL Nanoparticles: Relation of PEG-PCL/PCL Hybrid Proportions and Antitumor Activity in Vitro
- 肿瘤防治研究, 2020, 47(6): 411-415
- Cancer Research on Prevention and Treatment, 2020, 47(6): 411-415
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.0979
- 收稿日期: 2019-07-29
- 修回日期: 2020-01-16
顺铂(CDDP)是目前临床最常用的广谱抗肿瘤药物之一[1]。近几年,随着肿瘤靶向治疗和免疫治疗的发展,顺铂也成为化疗联合免疫检查点抑制剂治疗[2]和化疗联合表皮生长因子受体抑制剂治疗[3]中最常用的联合化疗药物之一,依旧是肿瘤全身治疗不可或缺的部分。顺铂引起的不良反应包括消化道毒性、肾毒性、骨髓抑制等。为了降低顺铂的毒性使它更好地发挥疗效,近年来,随着药物投递系统的发展,出现了一些负载顺铂的药物投递系统,如顺铂-白蛋白微球[4]、脂质体[5]、顺铂-PLGA微球[6]等。在众多的药物载体中,高分子纳米载体由于可以显著改变药物的分布和代谢,提高疗效、降低不良反应,受到越来越多的关注。但是,新型载体的相关研究仍不够深入细致,例如纳米载体的配比结构和药物投递系统性质关系的研究,目前少有报道[7]。
纳米载体的结构比例,尤其是它的相对分子质量和亲水/疏水比,已被认可为可以影响纳米载体的功能和性质[8]。传统上通过在开环聚合反应时控制PEG的分子量以及PEG和PCL的比例来合成各种不同亲水/疏水比例的纳米载体。我们前期采取了一种简单的方法,通过混合末端带有羟基的HO-PCL和已有的PEG-PCL,使HO-PCL进入纳米粒子的疏水内核达到近似增加PCL疏水链长度的目的,从而调整纳米粒子的亲水/疏水比。这种简单混合不涉及有机化学反应,替代了传统的高温、高能量、高有机污染的开环聚合反应,具有良好的应用前景[9]。本研究主要探讨5种配比型mPEG-PCL顺铂纳米粒子的生物相容性及其体外抗肿瘤作用,探讨载体结构与抗肿瘤疗效之间的关系。
1 材料与方法 1.1 材料和仪器85-2型恒温磁力搅拌器(常州国华仪器厂),核磁共振波谱仪(Bruker AM-300,德国),冷冻干燥机(FreeZone6型,Labconcon,美国),244型凝胶渗透色谱仪(Waters GPC244,美国),紫外分光光度计(UV3100,Shimadzu,日本),恒温槽(ELLY4,TOKYO Rikaaikai,日本),BI-90plus型激光粒度仪(Brookheaven,美国),酶标仪(ELX800 Biotek,美国),超声波细胞破碎仪(XL2000型,Misonix,美国),真空干燥箱(DZF-6020型,上海精宏实验设备有限公司)。
单甲氧基聚乙二醇(mPEG,相对分子质量4000)(威尔化工,南京),使用前50℃下真空干燥24 h;ε-己内酯(ε-CL)(Fluka,美国),使用前用CaH2干燥后减压蒸馏;顺铂(山东铂源化学有限公司),聚乙烯醇(PVA,醇解度88%,聚合度500,山东东仓国际贸易有限公司),胎牛血清、牛血清白蛋白、MTT(Amersen,美国),RPMI 1640培养液(Gibco,美国),辛酸亚锡(Sigma,美国);无水乙醚、乙醇、N,二氯甲烷(DCM),N-二甲基酰胺(DMF),氯化钠、甘露醇及其他分析纯试剂使用前均未作特殊处理。透析袋(截留分子量12000,Sorua,德国)。人胃癌细胞株BGC-823、SGC-7901均购自中国科学院上海细胞生物学研究所。
1.2 mPEG-PCL两嵌段聚合物及HO-PCL的制备参考文献[10],通过开环聚合法制备mPEG-PCL两嵌段共聚物,在装有适量mPEG的聚合管中加入0.1%(w/w)的辛酸亚锡以及计算量的ε-CL。在真空下封管置于130℃油浴反应48 h。反应得到的粗产物用二氯甲烷溶解后,沉淀于大量无水乙醚中以除去未反应的单体及其他低相对分子质量物质。收集沉淀并洗涤数次后减压干燥,得到mPEG-PCL两嵌段聚合物。用同样的方法,将少量水和ε-CL辛酸亚锡混合反应,得到HO-PCL聚合物。
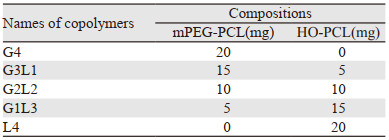
1.3 负载CDDP的纳米粒子的制备参考文献[9],采用改进的双乳剂法制备负载顺铂的载药纳米粒子。将含有顺铂5 mg/ml的水溶液200 μl作为内水相滴入1 ml DCM中(内含表 1所示不同比例的mPEG-PCL),形成的乳液加入3 ml 5%PVA溶液中,进行超声(17.5 W,30 s)乳化,将制成的w/o/w双乳进一步分散在8 ml含有0.9%NaCl和1%PVA的溶液中,室温下搅拌2 h,将得到的液体用慢速滤纸过滤后在纯水中透析2 h以除去未包裹的药物。空白粒子的制备,除内水相不加入药物外,其余方法同上。上述液体按3%(w/w)的比例加入甘露醇后,冷冻干燥72 h,避光贮存于4℃备用。
以CDCl3为溶剂,聚合物的相对分子质量以及化学组成通过1H-NMR图谱中对应于PCL和PEG上质子峰的积分强度计算得到。另外,聚合物的相对分子质量还通过GPC进行测定(30℃,溶剂为四氢呋喃,流速1 ml/min,以标准苯乙烯样品作为基准)。
1.4.2 载药量与载药效率测定采用SnCl2比色法测定载药粒子中顺铂的含量:取30 mg左右载药粒子冻干粉,溶于200 μl纯水并于80℃干燥,将残留物溶于200 μl DMF后,得到的溶液取100 μl,和等量的2 mmol/L盐酸混合,再加入2 mmol/L盐酸溶液、0.2 mmol/L的SnCl2共9.8 ml,反应1 h后,通过紫外分光光度法在403 nm处测定其吸光度值,并根据标准曲线求溶液中顺铂的含量。根据以下公式计算载药量和载药效率:
 |
 |
纳米粒子的粒径通过动态光散射法测定,BI-90plus型激光粒度仪测试均测3次结果取平均值。
1.5 负载CDDP纳米微球的体外细胞毒性实验分别检测顺铂单药、负载顺铂的纳米粒子以及空白纳米粒子对人胃癌细胞株BGC-823、SGC-7901的体外细胞毒作用。采用MTT法测定细胞的增殖。以5×103每孔的密度将细胞接种于96孔板内,培养液为含10%小牛血清的RPMI 1640。96孔板置于37℃、5%CO2的培养箱中全湿度培养24 h后,吸出培养液,按照2倍浓度梯度,每孔加入200 μl含顺铂单药、不同载药纳米粒子或空白微球的培养液,每种纳米微球设3个复孔。另设12个孔为空白,加入不含微球或药物的培养液200 μl。细胞置于37℃培养箱内培养48 h后每孔加入1 mg/ml MTT(3-(4, 5-dimethyl-2-thiazolyl)-2, 5-diphenyl-2-H-tetrazolium bromide, Thiazolyl Blue Tetrazolium Bromide)20 μl,继续培养4 h后弃去上清液,每孔加入DMSO 200 μl。置于振荡仪上充分混匀,采用酶标仪,490 nm为测试波长,620 nm为参考波长,测量各孔吸光度计算细胞生长抑制率,各组肿瘤细胞抑制率按下列公式计算。
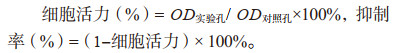 |
MTT法测定空白纳米粒子对BGC-823及SGC-7901细胞生长的抑制作用,以评估载体的毒性。具体步骤同1.5。
1.7 统计学方法采用SPSS25.0软件进行数据分析。计量资料以(x±s)表示,多组均数间比较采用单因素方差分析, 两两比较采用Dunnett-t检验,线性相关采用Pearson检验,P < 0.05为差异有统计学意义。
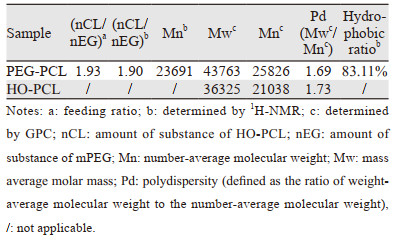
2 结果 2.1 mPEG-PCL两嵌段聚合物及HO-PCL的合成通过开环聚合,合成了mPEG-PCL两嵌段聚合物及末端含有羟基的PCL,聚合物及HO-PCL的表征参见文献[11]。凝胶渗透色谱(gel permeation chromatography, GPC)法测得mPEG-PCL聚合物相对分子质量为25 826 g/mol,HO-PCL相对分子质量为21 038 g/mol,见表 2。
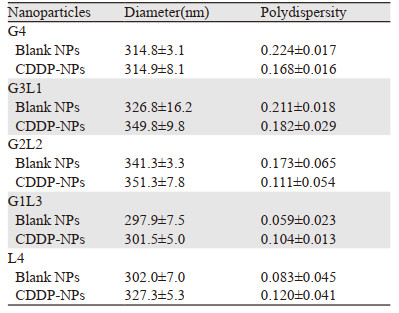
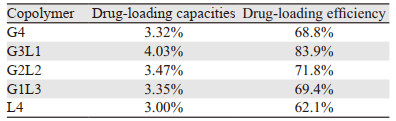
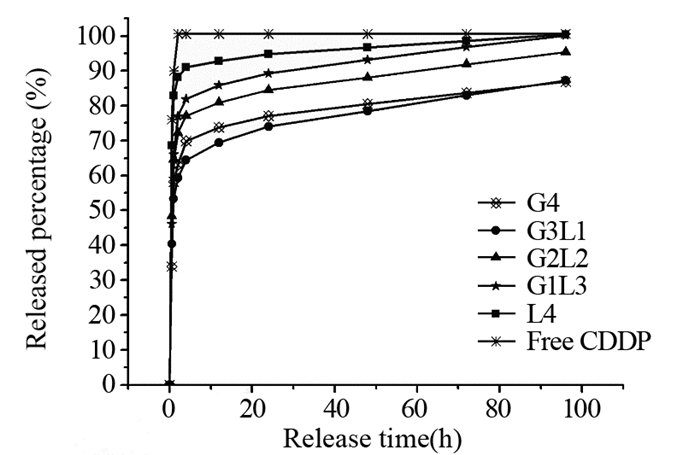
2.2 mPEG-PCL/PCL纳米微球的制备及表征通过双乳剂法制备了负载CDDP的纳米粒子,其粒径测定结果参见文献[9],见表 3,结果显示纳米粒子的直径在300~350 nm左右,差别并不显著。空白纳米微球中G3L1型和G2L2型粒径最大,G4型和G1L3型粒径受载药影响最小。5种纳米粒子的载药量和载药效率参见文献[9],见表 4。可见G3L1型的载药量和载药效率最高,L4型载药量和载药效率最低,其余三者无明显区别。体外释放实验显示5种纳米粒子和CDDP裸药相比均具有缓释特征,能延长CDDP的作用时间,在保证CDDP作用前提下减少给药剂量,减轻CDDP的不良反应,提高CDDP的稳定性,结果参见文献[9],见图 1。
纳米药物投递系统本身具有的EPR效应和长循环效应,在肿瘤靶向性、提高药物生物利用度、减轻不良反应方面具有明显优势。不同亲水/疏水比例会改变mPEG-PCL纳米粒子的结构,影响药物释放速率和纳米粒子摄取效率,最终可能影响抗肿瘤作用的差异[9, 12]。
结果显示,无论是CDDP裸药还是CDDP纳米粒子,其细胞毒性都随着药物浓度的增加而增长。低浓度时,CDDP纳米粒子和CDDP裸药的细胞毒作用相当或略弱于CDDP裸药,随着药物浓度的增高,CDDP纳米粒子显示出更强的作用,见图 2。

|
| 图 2 CDDP裸药和CDDP纳米粒子在不同浓度下对于BGC-823(A)和SGC-7901(B)细胞的毒性作用 Figure 2 Cytotoxicity of free CDDP and five CDDP-loaded NPs to BGC-823(A) and SGC-7901(B) cells at different concentrations in vitro |
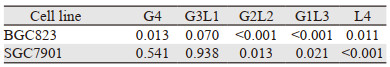
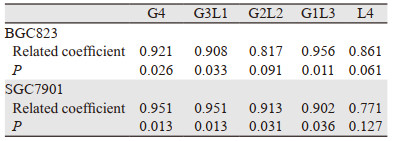
对比上述5种纳米粒子,其细胞毒性呈现一定的异质性,在CDDP浓度中等时这种异质性最为明显。5种纳米粒子对比CDDP裸药在两种不同肿瘤细胞中都表现出较好的细胞毒性,在BGC-823细胞株中除G3L1型外的表现均有统计学意义,在SGC-7901中仅G2L2、G1L3和L4型具有统计学意义,见表 5。其中G4、G3L1、G1L3型纳米粒子的体外细胞毒性与载药浓度呈较好的线性依赖关系,见表 6。
|
|
空白纳米粒子对不同细胞株均无明显的生长抑制作用,在纳米粒子浓度为400 μg/ml时,对细胞生长的抑制作用基本在20%左右,见图 3。提示5种配比的载体安全性和生物相容性都较好。比较各种载体对于细胞生长的抑制作用,可以发现,当纳米粒子浓度在200和400 μg/ml时,G2L2及L4的毒性总体略高于G1L3。

|
| 图 3 不同空白载体对BGC-823(A)和SGC-7901(B)细胞生长的影响 Figure 3 Impact of different NPs on viabilities of BGC- 823(A) and SGC-7901(B) cell lines |
本实验合成了带有羟基的PCL,将其和mPEG-PCL以一定比例混合后制备5种不同配比型的负载CDDP纳米粒子,考察粒径和载药效率,探讨其与CDDP裸药相比,对人胃癌细胞株BGC-823和SGC-7901的生物相容性以及体外抗肿瘤效果。可以看出,随着HO-PCL的比例不同,纳米粒子的各方面性质也存在差异。在细胞株BGC-823和SGC-7901中,不同配比型的纳米粒子的抗肿瘤活性也呈现出一定程度的异质性,表明纳米粒子的抗肿瘤活性与粒子本身的性质、结构有关,有关分子机制尚待进一步研究。比较上述结果,G1L3和G4型在粒径稳定性上具有优势,除L4型外均具有良好的载药量与载药效率,G2L2、G1L3、L4型具有较好的体外细胞毒性。综合来看,5种纳米粒子中G1L3型具有最佳的配比结构,与前期我们对于不同配比纳米粒子的各种表征性质以及不同纳米粒子在H22细胞系/肿瘤组织块上的一系列研究的结论基本一致,因此,后续我们将采用G1L3的配比作为载体进行进一步研究。
目前关于纳米药物投递系统的大部分研究并未深入探讨配比结构与功能的问题,我们探讨了mPEG-PCL顺铂纳米粒子的配比结构与体外抗肿瘤作用的关系,认为对于高分子嵌段共聚物纳米粒子而言,其配比结构对抗肿瘤作用具有重要影响,应初步研究找出最佳配比结构以利于后续进一步研究。
作者贡献
王春:细胞毒性、生物安全性实验及论文撰写
禹立霞:载药纳米粒子的制备及其表征工作
王立峰:部分实验设计及技术指导
钱汉清:材料及纳米粒子的合成与表征工作
严英慈:部分空白、载药纳米粒子的表征工作
王欣玥:技术指导
李茹恬:实验设计、论文写作指导及修改
| [1] |
Fennell DA, Summers Y, Cadranel J, et al. Cisplatin in the modern era: The backbone of first-line chemotherapy for non-small cell lung cancer[J]. Cancer Treat Rev, 2016, 44: 42-50. DOI:10.1016/j.ctrv.2016.01.003 |
| [2] |
Fang W, Yang Y, Ma Y, et al. Camrelizumab (SHR-1210) alone or in combination with gemcitabine plus cisplatin for nasopharyngeal carcinoma: results from two single-arm, phase 1 trials[J]. Lancet Oncol, 2018, 19(10): 1338-1350. DOI:10.1016/S1470-2045(18)30495-9 |
| [3] |
Quintero Aldana G, Salgado M, Candamio S, et al. First-line panitumumab plus docetaxel and cisplatin in advanced gastric and gastro-oesophageal junction adenocarcinoma: results of a phase Ⅱ trial[J]. Clin Transl Oncol, 2019.[Epub ahead of print].
|
| [4] |
Battogtokh G, Kang JH, Ko YT. Long-circulating self-assembled cholesteryl albumin nanoparticles enhance tumor accumulation of hydrophobic anticancer drug[J]. Eur J Pharm Biopharm, 2015, 96: 96-105. DOI:10.1016/j.ejpb.2015.07.013 |
| [5] |
Stras S, Holleran T, Howe A, et al. Interstitial Release of Cisplatin from Triggerable Liposomes Enhances Efficacy against Triple Negative Breast Cancer Solid Tumor Analogues[J]. Mol Pharm, 2016, 13(9): 3224-3233. DOI:10.1021/acs.molpharmaceut.6b00439 |
| [6] |
Alam N, Koul M, Mintoo MJ, et al. Development and characterization of hyaluronic acid modified PLGA based nanoparticles for improved efficacy of cisplatin in solid tumor[J]. Biomed Pharmacother, 2017, 95: 856-864. DOI:10.1016/j.biopha.2017.08.108 |
| [7] |
Gan M, Zhang W, Wei S, et al. The influence of mPEG-PCL and mPEG-PLGA on encapsulation efficiency and drug-loading of SN-38 NPs[J]. Artif Cells Nanomed Biotechnol, 2017, 45(2): 389-397. DOI:10.3109/21691401.2016.1167700 |
| [8] |
Phan QT, Le MH, Le TT, et al. Characteristics and cytotoxicity of folate-modified curcumin-loaded PLA-PEG micellar nano systems with various PLA: PEG ratios[J]. Int J Pharm, 2016, 507(1-2): 32-40. DOI:10.1016/j.ijpharm.2016.05.003 |
| [9] |
Li R, Yan J, Xie L, et al. Facile Optimization and Evaluation of PEG-PCL Block Copolymeric Nanoparticles for Anticancer Drug Delivery Using Copolymer Hybrids and Histoculture Drug Response Assays[J]. J Biomed Nanotechnol, 2018, 14(2): 321-330. DOI:10.1166/jbn.2018.2485 |
| [10] |
Zamani M, Shirinzadeh A, Aghajanzadeh M, et al. In vivo study of mPEG-PCL as a nanocarriers for anti-inflammatory drug delivery of simvastatin[J]. Pharm Dev Technol, 2019, 24(6): 663-670. DOI:10.1080/10837450.2018.1556689 |
| [11] |
龚丽萍, 李茹恬, 刘宝瑞. 新型顺铂纳米微球的制备及性质研究[J]. 现代肿瘤医学, 2010, 18(1): 1-4. [Gong LP, Li TR, Liu BR. Novel nanoparticles of cisplatin: Preparation and study of properties[J]. Xian Dai Zhong Liu Yi Xue, 2010, 18(1): 1-4. DOI:10.3969/j.issn.1672-4992.2010.01.001] |
| [12] |
Li R, Li X, Xie L, et al. Preparation and evaluation of PEG-PCL nanoparticles for local tetradrine delivery[J]. Int J Pharma, 2009, 379(1): 158-166. DOI:10.1016/j.ijpharm.2009.06.007 |
 2020, Vol. 47
2020, Vol. 47