文章信息
- 食管癌研究关键科学问题的认识和思考
- Understanding and Thinking About Key Scientific Issues in Esophageal Cancer Research
- 肿瘤防治研究, 2020, 47(2): 83-89
- Cancer Research on Prevention and Treatment, 2020, 47(2): 83-89
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.0964
- 收稿日期: 2019-07-24
- 修回日期: 2019-11-12
2019年6月,国家癌症中心和郑州大学等在林州举办河南林县食管癌高发现场防治研究六十年庆典暨肿瘤防治高峰论坛,旨在弘扬和传承河南三代食管癌研究学者的爱国、敬业、求实、创新、协作、献身的科学精神,总结和进一步推广60年食管癌防治经验,紧密围绕党中央“健康中国2030”规划纲要精神,加强和提高中国高发区食管癌防治研究水平,并对中国肿瘤防治起到引领和示范作用。2019年11月,国家科技部批准以郑州大学为依托单位,建设“省部共建食管癌防治国家重点实验室”,将对食管癌防治研究起到重要推动作用。本文基于河南食管癌防治60年和笔者从事食管癌变机制及防治34年研究实践和认识,重点阐述对中国人食管癌发生和发展的独特性、关键科学问题、重要研究方向等的理解和思考,为食管癌防治研究同道提供参考。
1 中国人食管癌独特性的认识和思考与西方国家相比,中国人食管癌的发生和发展有许多显著的独特性,主要表现在:
1.1 组织学类型和组织学发生模式中国人食管癌95%以上为鳞状细胞癌,而食管腺癌仅占1.5%。即使在占比很少的食管腺癌中,一半以上发生在食管的中段和上段,甚至颈段,并以混合型腺鳞癌为主(> 50%),与西方国家80%以上为食管腺癌、几乎均发生在食管下段、单纯腺癌为主等特征反差显著[2]。中国人食管上皮癌变的极早期变化是鳞状上皮增生异常,形态学上表现为基底细胞过度增生、不典型增生和原位癌,这些病变被认为是重要的食管癌前病变,并进一步发展为早期食管鳞状细胞癌。此外,食管固有腺各级导管上皮增生,进一步发展成不典型增生和早期癌,是中国人食管腺癌发生的主要组织学模式[3]。与此相反,西方人群是在食管鳞状上皮被柱状上皮所取代(肠上皮化生,又称Barrett食管)的基础上,进一步经不典型增生发展成早期食管腺癌[4]。
综上,中西方食管癌在发病模式和机制、主要危险因素和防治等方面存在巨大差异,导致中西方关注的科学问题和研究思路也明显不同,研究成果相互借鉴和共享困难,因此攻克食管癌是中国学者的责任和挑战。笔者课题组利用食管内镜和黏膜活检等方法,从1985年开始对河南食管癌高发区35岁以上无症状居民进行早期癌筛查,并对癌前病变患者进行长达34年的随访。结果发现:食管癌前病变存在明显的双向发展不稳定特性,45%的不典型增生患者在34年随访过程中发展成早期浸润癌,从不典型增生到早期浸润癌的间隔最长时间是30年。更为惊奇的是,笔者发现也有一定比例的原位癌患者在30年随访中未进一步发展,甚至经过15次色素内镜黏膜活检(间隔1~2年/连续20年内镜随访),再未发现原位癌病灶。很显然,食管癌前病变的存在,为食管癌的Ⅱ级预防(干预阻断)研究提供了重要科学基础,也为高危人群的界定提供了重要客观指标;同时,这种前瞻性随访所积累的食管癌变多阶段演进生物样本库和临床信息为进一步阐明食管癌变的分子机制,甄别导致食管癌前病变进展的关键分子标志物提供了重要条件和依据。
近年,西方国家将Barrett食管腺上皮和鳞状上皮不典型增生重新命名为食管上皮内瘤变,并依据不典型增生的程度,将上皮内瘤变分为高级别(重度不典型增生)和低级别(轻度和中度不典型增生)[5],并以此作为临床内镜下治疗的主要依据。中国学者60年前就将食管脱落细胞依据细胞形态分为单纯增生、轻度异型增生、重度异型增生和近癌等类型[6],随后依据食管鳞状上皮增生异常的程度,将上皮增生病变命名为基底细胞过度增生,轻度、中度和重度不典型增生和原位癌,这些命名已被国内外学者所接受。甚至在西方学者英文论文中,将这些名称用英文和中文汉语拼音同时标注[7]。此外,按照中国人的儒家传统文化,“上皮内瘤变”容易误解成“肿瘤已形成”,较“癌前病变”“不典型增生”更容易造成患者的恐慌和误解。食管癌前病变是指具有进一步发展成癌潜能的食管上皮病变,并不是癌,更不能肯定都能发展成癌。笔者认为,中国老一代食管癌研究学者的命名更适合中国人食管鳞状上皮癌变的真实情况,更能体现中国食管癌研究的历史和文化传承。中国学者60年高发现场研究成果应该得到尊重。
1.2 高发病率和死亡率、显著的地域性分布差异和明显的家族聚集现象全世界每年新发食管癌患者约50万例,一半以上发生在中国[8]。在中国,近半数发生在河南、河北和山西三省交界的太行山地区,其中河南林县是世界上食管癌发病率和死亡率最高的地区[9-10],比西方国家高百倍[1]。食管癌预后极差,中晚期食管癌患者5年生存率仅20%左右[11]。目前尚缺乏精准早期发现指标、有效的预防措施和靶向治疗方法。显著的地域性分布差异,导致界限明显的高、低发区,强烈提示环境因素在食管癌发生中起重要作用。林县地区家庭饲养的鸡也患食管癌,进一步提示环境因素的重要性[12]。此外,中国食管癌患者有明显家族聚集现象[13],近半数患者呈阳性食管癌家族史,提示遗传因素在食管癌发生中的作用不可忽视。近年发现的中国人食管癌易感基因和致病驱动基因变异提示“环境-遗传-基因互作”可能是食管癌发生的重要机制之一[2]。与此相反,西方人群食管癌无明显地域性分布差异和家族聚集发生的特征。
笔者研究小组对同卵双胞胎食管癌和癌前病变患者研究发现,同卵双胞胎成员同时发生食管癌和癌前病变者占27%(双发),而单发者占73%,提示环境因素对食管癌发生的影响高于遗传因素[14]。笔者课题组历20余年所积累的50万例食管癌和贲门癌队列研究发现,中国人食管癌90%以上来自农村和山区,这些特点与西方明显不同[15]。中国食管癌被认为是“穷病”,瘦人多见;相对而言,西方人群食管癌以胖人为主,是“富病”[2];无症状高危人群监测和干预及早期癌筛查是降低食管癌发病率和死亡率的关键[16]。
1.3 食管癌致病危险因素与西方国家肥胖、烟酒等导致反流性食管炎,进一步发展成Barrett食管和食管腺癌的致病危险因素不同,河南林县食管癌高发现场和实验室研究发现亚硝胺暴露(酸菜等食物中过量的亚硝酸盐等亚硝胺类前体物可在体内外与胺反应生成亚硝胺)、维生素(如核黄素、维生素A酸、叶酸等)和微量元素(锌、硒等)缺乏、霉菌毒素、HPV病毒感染和牙龈卟啉单胞菌(PG)感染[17]是中国人食管癌主要致病危险因素;提出了防霉、去胺等防控措施,有效降低了食管癌发生率。1972年,周恩来总理指示:“林县食管癌防治点要坚持办好,像林县这样的点全国应多办几个”[18]。随后,林县食管癌研究成果被作为林县模式,广泛用于中国其他食管高发区现场(陕豫鄂秦岭、鄂豫皖大别山、川北、闽粤和苏北高发区)以及胃癌、肝癌等高发现场防治研究并取得明显效果。近年来,由于易感基因的发现,食管癌的遗传危险因素受到重视。笔者课题组首次发现食管癌易感基因PLCE1和C20orf54,揭示食管癌环境和遗传因素交互作用的分子基础,为界定食管癌高危人群提供又一重要客观指标,同时还为食管癌个体化预防提供了新的思路和研究方向[19]。
综上,中西方食管癌致病危险因素存在巨大差异,阐明这些致病危险因素及其作用机制是实施食管癌Ⅰ级预防和个体化预防的关键。食管癌Ⅰ级预防需要政府的大力投入和指导。农村食管癌高发的特点与因病致贫和因病返贫密切相关,这正是国家关注的健康中国的核心内容之一,相信有党和政府的重视和投入,食管癌Ⅰ级预防会有重要突破。
2 食管癌自然发生和发展过程及关键科学问题的认识和思考 2.1 食管癌自然发生和发展过程阐明食管癌自然发生史依赖于对无症状健康人群长期队列随访和重复食管内镜和黏膜活检等病理学检查。笔者课题组从1985年开始连续对高发区农村35岁以上5.4万健康人群进行食管内镜和黏膜活检病理学检查及食管拉网细胞学检查,并长期随访。对部分不典型增生人群11年[20]、15年[21]和30年三个阶段的随访结果分析发现,从内镜检查和细胞学检查入组开始,最长30年发展成食管早期癌,最短1.5年发展成食管早期癌,平均8年发展成食管早期癌。但30年后,仍有55%的不典型增生人群没有进一步发展,甚至一部分不典型增生的人群在随访期间内镜和黏膜活检病理复查未再见到不典型增生病灶。在这些随访期间内镜复查发现的早期癌患者几乎均无特异症状,见图 1,食管上皮细胞增生过度是这些人群的极早期最突出的病理改变,特别是食管黏膜乳头区增生的细胞[22]。维生素缺乏,特别是核黄素,与食管早期癌发生关系明显,而吸烟、饮酒关系不密切。经随访复查发现的食管早期癌患者,多数经手术治疗预后良好,但也有部分食管早期癌患者术后很快发生大器官转移去世。这些长期随访结果提示食管癌发生和发展的复杂性,许多临床现象单纯从病理形态变化难以解释。
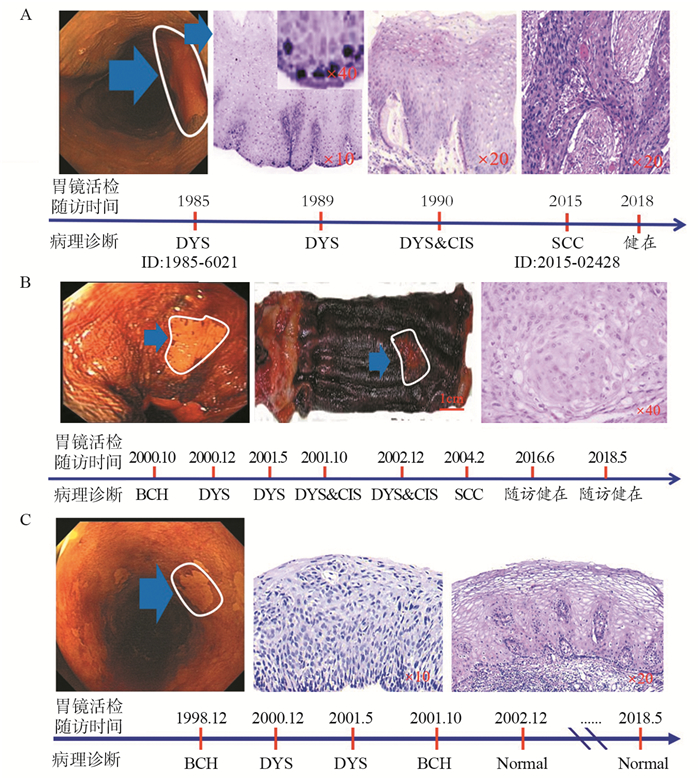
|
| DYS:dysplasia; CIS:carcinoma in situ; SCC:squamous cell carcinoma; BCH: base cell hyperplasia; A:atypical hyperplasia to carcinoma in situ in 30-year followup (1985-2015),ending as early stage of esophageal carcinoma in 2015; B:atypical hyperplasia in 4-year follow-up (2000-2004), progressed to early esophageal squamous carcinoma; C:atypical hyperplasia in 20-year follow-up (1998-2018),progressed to early esophageal squamous carcinoma. 图 1 长期随访典型患者信息 Figure 1 Information of typical patients in long-term follow-up |
如前所述,食管上皮不典型增生具有很高的癌变率(45%),并被确定为重度癌前病变,这些人群是食管癌高风险(高危)人群。筛查和甄别高危人群和无症状早期癌患者是食管癌研究中早期发现的主要内容。早期发现是降低食管癌发病率和死亡率的关键。阐明形态学相似的不典型增生发生不同转归的机制,进而建立高危人群诊断和防治技术体系,是目前食管癌研究亟待解决的关键科学问题。很显然,单纯从形态学角度难以揭示不典型增生的不同转归机制。分子差异可能是阐明这一问题的重要方法。阐明食管上皮癌变多阶段演进的分子机制,正是建立分子分型体系,实施高危人群精准诊断和防治的基础。目前尚无规范化的食管癌高危人群预警筛查早期发现和防治指南。建立高危人群客观评价标准是实施食管癌精准防治的关键。传统上,高发区、40岁以上、男性、吸烟、饮酒和家族史阳性的无症状人群被笼统界定为“高危或高风险人群”,也是早期食管癌主要筛查对象。由于色素内镜和活检病理及内镜下治疗技术的快速推广应用,传统的食管拉网脱落细胞学早期发现筛查手段已完全被色素内镜所取代。但是,需要特别指出的是,内镜检查需要有经验的专业人员、复杂的设备和程序,并且检查过程中的微创和不适不容易被大众接受、特别是高成本和低效率,例如常规高发区内镜筛查上述“高危人群”,食管早期癌的发现率仅2%左右,癌前病变10%左右,约90%的无症状“高危人群”均为“陪伴检查”等,这些局限性限制了内镜在无症状高危人群食管癌预警筛查和早期发现中的推广应用。因此,基于“环境-遗传-基因互作”食管癌变机制的新模式,建立界定高危人群的分子分型标准,确定用于预警筛查、早期发现、早期诊断和个体化防治的分子靶标,利用一滴血检测这些分子标签,确定高危人群,然后对这些高危人群进行色素内镜和活检病理检查,将极大提高食管早期癌和癌前病变患者的检出率,从而为最终降低食管癌发病率和死亡率提供重要技术支撑。笔者课题组2010年首次发现国人食管鳞癌易感基因PLCE1和C20orf54[23],2012年发现国人食管鳞癌致病基因NOTCH1[24],随后又发现数个易感基因和致病基因[25-27]。利用这些发现,结合上述思路,笔者课题组对食管癌高发区无症状1.1万例居民进行外周血易感基因位点、自身抗体等检测[28-29],确定660例高危人群,然后对这些高危人群进行色素内镜和黏膜活检病理检查,发现234例食管癌患者,较传统无症状人群内镜筛查食管早期癌的2%发现率(234/1.1万)提高了近14倍(234/660)。越来越多的组学(包括基因组学、蛋白质组学、转录组学、表观组学等)研究结果正在不断丰富“环境-遗传-基因互作”食管癌变机制的新模式。这些研究为进一步建立和完善规范化食管癌高危人群预警筛查早期发现和防治指南奠定重要基础。
2.3 食管癌主要研究方向食管癌变自然发生和发展大致可分为三个递进研究阶段:(1)病因学研究:重点阐明导致食管癌发生的关键致病因素及其作用机制;(2)食管上皮癌变多阶段演进的分子机制研究:食管癌细胞是在致病因素持续作用下,由增生旺盛的食管上皮细胞经各级癌前病变发展而来。阐明这一阶段组织细胞形态和关键分子变化及相互关系,揭示导致良性增生上皮细胞(可控)发展成恶性增生的癌细胞(相对失去机体控制)的关键分子机制和分子事件,是发病机制研究的主要内容;(3)临床诊疗研究:主要研究内容是发现针对食管癌患者高特异性、不良反应小和疗效稳定的治疗手段和方法。病因学研究的临床价值在于为食管癌的Ⅰ级(病因学预防)和Ⅱ级预防(发病学预防,主要是指食管癌前病变的干预阻断研究)提供重要的预防思路和方法,同时也为验证食管癌发病机制理论提供重要验证依据,反之亦然。分子病理学研究不仅阐明食管癌变关键分子事件,更重要的是为食管癌高危人群筛查和早期发现提供重要的客观指标和标准。与此同时,癌变分子机制的阐明和关键分子事件的确立也为食管癌的靶向治疗提供了重要理论依据和创新思路。在尽量保障生活质量的前提下,提高患者生存时间是食管癌临床治疗的最终目标,见图 2。基于食管癌发生自然规律和关键科学问题,结合60年食管癌高发现场防治研究经验,笔者认为食管癌研究重点应放在三个既相对独立又有一定关联的研究方向上,即,“方向一”:食管癌病因与干预;“方向二”:食管癌分子分型和早期发现;“方向三”:食管癌靶向药物研究和生物治疗。这三个方向的研究突出了食管癌早期预防、高危人群预警筛查、早期发现和精准防治的关键链条环节,对实现早防、早诊和早治,降低食管癌发病率和死亡率具有重要意义。三个方向分属食管癌自然发生和转归的三个阶段:“方向一”主要针对正常人群进行群体和个体化预防;“方向二”旨在建立食管癌分子分型,进一步实现高危人群预警筛查和早期发现;“方向三”重点研究和开发食管癌患者精准靶向药物和生物治疗。“方向二”的研究在三个方向中承上启下,所确定的食管癌变多阶段演进,特别是癌变早期多维组学特征谱和癌前病变进展相关的分子标志,一方面为“方向一”进一步甄别食管癌关键致病危险因素和作用机制研究提供新的研究思路和方向,同时还为“方向三”的靶向治疗和生物治疗提供新的候选靶标;“方向二”利用分子分型所确立的高危人群为“方向一”实施Ⅰ级预防(病因)的主要对象选择提供了重要依据。另外“方向三”所发现的食管癌靶向药物、新抗原及由此建立的疫苗系统极有可能用于“方向一”的食管癌预防研究。简而言之,“方向一”重点在于高发区正常人群的预防,“方向二”着重早期癌和癌前病变患者的早期发现,二者是实现早防、早诊、早治的关键,“方向三”着重对食管癌患者的精准治疗,见图 3。

|
| 图 2 食管癌发生和发展过程及关键科学问题 Figure 2 Progression of human esophageal carcinogenesis and the related key scientific issues |

|
| 图 3 食管癌主要研究方向、研究内容和突破点 Figure 3 Main research direction, research content and breakthrough point of esophageal cancer |
近年来,高通量技术发展迅速,积累了基因组、表观组及转录组等多种组学生物医学数据。现有生物医学数据库越来越多,包括Cancer Genome Atlas(CGA)数据库(http://cancergenome.nih.gov)、美国国家生物技术中心数据库(http://www.ncbi.nlm.nih.gov)、蛋白质相互作用数据库以及生物代谢途径数据库(http://dip.doe-mbi.ucla.edu/dip.)等。如此海量数据为深入了解癌症的发生发展机制及生物学过程等提供了条件和基础。生物计算是以生物技术实现信息处理的一个新兴研究领域,具有分布式、离散性、算法性、可扩展性、易读性以及并行性等许多适合用于生物系统建模仿真的优点,已受到生物医学界的广泛关注。目前,生物计算作为生物技术、计算机科学以及临床医学等技术的交叉研究领域,致力于发展高性能计算模型和算法,是探索癌症诊疗研究的重要工具。
基于食管癌多阶段演进分子机制研究所积累的多维组学大数据库和临床诊疗、病理和随访信息库的关联分析,利用生物计算建立预测癌前病变进展,分子分型和放化疗敏感度,靶向药物设计和生物免疫治疗靶点等模型,进一步用于临床实践,就是食管癌防治智能医学研究的核心内容。传统的食管癌预测模型主要因为基于生物计算的数据量不够,忽略了肿瘤异质性;二是预测模型多基于线性模型及决策树模型,难以体现疾病发生发展的动态过程。基于食管癌的高通量数据,构建反映食管癌发生发展特征的系统模型,综合生活环境、饮食习惯、年龄、性别等多因素建立个性化、系统化的食管癌早期预测模型是早期准确预测食管癌发生发展,提高食管癌患者生存率的关键。随着高通量技术发展所积累的大数据,为利用生物计算方法开展食管癌发病预测研究提供了可能。
3 结语和展望 3.1 河南连续三代学者60年坚持食管癌高发现场和实验研究的认识早防、早诊和早治是降低食管癌发病率和死亡率的关键;阐明食管癌发生的分子机制,建立高危人群分子分型体系,是实现早期发现必须解决的关键科学问题;液体活检确定高危人群,再进行色素内镜和靶向黏膜活检是目前实现无症状人群早期发现的最佳技术;揭示食管癌主要致病危险因素,阐明其致癌作用的关键分子机制,是实现食管癌个体化早期预防的重要研究策略[17]。
3.2 “高发区人群-实验室-高发区人群”的循环研究策略食管癌未来的研究将充分利用我国食管癌病例的资源优势,以解决临床重大科学问题为主体(癌前病变进展精准预测、复发转移、放化疗敏感度和预后关键分子标志物),采用多维组学整合并与临床表型大数据关联分析等技术,获得癌前病变进展及食管癌组学特征谱,进行多中心规模化验证,获得可用于精准预测食管癌前病变进展、复发转移和放化疗敏感度及预后的关键分子标志物和预测模型(智能医学),这将为食管癌精准诊疗提供重要的技术支撑,组学和临床流行病学大数据的积累将为实现食管癌精准医学(防治)奠定重要基础,也是未来中国食管癌研究有望取得重大突破的主要领域。
作者贡献
王立东:论文构思及撰写
韩文莉、胡守佳、杨苗苗:论文参考文献的筛选和整理
宋昕、赵学科、王盼盼:论文修改
| [1] |
王立东, 宋昕, 赵学科, 等. 河南省食管癌高发现场防治和实验室研究60年回顾与展望[J]. 郑州大学学报(医学版), 2019, 54(2): 149-160. [Wang LD, Song X, Zhao XK, et al. Retrospect and prospect of 60 years of prevention and treatment of esophageal cancer in Henan Province[J]. Zhengzhou Da Xue Xue Bao(Yi Xue Ban), 2019, 54(2): 149-160.] |
| [2] |
王立东, 宋昕, 赵学科, 等. 食管癌环境和遗传危险因素交互作用的分子基础和精准预防[J]. 中国肿瘤临床, 2016, 43(12): 515-520. [Wang LD, Song X, Zhao XK, et al. Molecular basis and precision medicine for interactions of genetic and environmental risk factors in esophageal cancer[J]. Zhongguo Zhong Liu Lin Chuang, 2016, 43(12): 515-520. DOI:10.3969/j.issn.1000-8179.2016.12.028] |
| [3] |
王立东, 周胜理, 李吉林, 等. 河南食管癌高发区食管固有腺的组织学与组织化学特征[J]. 郑州大学学报(医学版), 2009, 44(1): 20-23. [Wang LD, Zhou SL, Li JL, et al. Characteristic in histology and histochemistry of esophageal glands at high-incidence area in Henan[J]. Zhengzhou Da Xue Xue Bao(Yi Xue Ban), 2009, 44(1): 20-23. DOI:10.3969/j.issn.1671-6825.2009.01.007] |
| [4] |
王立东, 胡守佳, 吕双, 等. 食管癌基础研究进展及临床应用前景[J]. 河南医学研究, 2016, 25(8): 1345-1347. [Wang LD, Hu SJ, Lv S, et al. Basic research progress and clinical application prospect of esophageal cancer[J]. He'nan Yi Xue Yan Jiu, 2016, 25(8): 1345-1347. DOI:10.3969/j.issn.1004-437X.2016.08.001] |
| [5] |
Wang LD, Zheng S, Zheng ZY, et al. Primary adenocarcinomas of lower esophagus, esophagogastric junction and gastric cardia: in special reference to China[J]. World J Gastroenterol, 2003, 9(6): 1156-1164. DOI:10.3748/wjg.v9.i6.1156 |
| [6] |
Wang LD, Yang HH, Fan ZM, et al. Cytological screening and 15 years' follow-up (1986-2001) for early esophageal squamous cell carcinoma and precancerous lesions in a high-risk population in Anyang County, Henan Province, Northern China[J]. Cancer Detect Prev, 2005, 29(4): 317-322. DOI:10.1016/j.cdp.2005.06.004 |
| [7] |
Liu SF, Shen Q, Dawsey SM, et al. Esophageal balloon cytology and subsequent risk of esophageal and gastric-cardia cancer in a high-risk Chinese population[J]. Int J Cancer, 1994, 57(6): 775-780. DOI:10.1002/ijc.2910570603 |
| [8] |
Bray F, Ferlay J, Soerjomataram I. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [9] |
Lin Y, Totsuka Y, He Y, et al. Epidemiology of esophageal cancer in Japan and China[J]. J Epidemiol, 2013, 23(4): 233-242. DOI:10.2188/jea.JE20120162 |
| [10] |
Lin Y, Totsuka Y, Shan B, et al. Esophageal cancer in high-risk areas of China: research progress and challenges[J]. Ann Epidemiol, 2017, 27(3): 215-221. DOI:10.1016/j.annepidem.2016.11.004 |
| [11] |
Lagergren J, Smyth E, Cunningham D, et al. Oesophageal cancer[J]. Lancet, 2017, 390(10110): 2383-2396. DOI:10.1016/S0140-6736(17)31462-9 |
| [12] |
Yang CS. Research on esophageal cancer in China: a review[J]. Cancer Res, 1980, 40(8 Pt 1): 2633-2644. |
| [13] |
Song X, Li WQ, Hu N, et al. GWAS follow-up study of esophageal squamous cell carcinoma identifies potential genetic loci associated with family history of upper gastrointestinal cancer[J]. Sci Rep, 2017, 7(1): 4642. |
| [14] |
王立东, 樊慧, 焦新英, 等. 河南食管癌高发区95对单卵双胞胎疾病谱和2323例食管癌患者家族史调查[J]. 中华肿瘤防治杂志, 2006, 13(20): 1521-1524. [Wang LD, Fan H, Jiao XY, et al. Disease patterns in 95 pairs of Homozygous twins and familial history of 2 323 esophageal cancer patients in a high incidence area in He' nan, China[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2006, 13(20): 1521-1524. DOI:10.3969/j.issn.1673-5269.2006.20.001] |
| [15] |
胡守佳, 宋昕, 赵学科, 等. 农村和城市食管鳞癌患者生存影响因素对比分析[J]. 中国肿瘤临床, 2017, 44(15): 773-777. [Hu SJ, Song X, Zhao XK, et al. Comparative analysis on survival of the patients with esophageal squamous cell carcinoma from rural and urban regions[J]. Zhongguo Zhong Liu Lin Chuang, 2017, 44(15): 773-777. DOI:10.3969/j.issn.1000-8179.2017.15.135] |
| [16] |
王立东, 杜丹凤, 宋昕, 等. 食管癌"环境-遗传-基因互作"组学研究:核黄素、核黄素转运基因2和NOTCH1-P53-Rb互作关系[J]. 郑州大学学报(医学版), 2018, 53(1): 1-5. [Wang LD, Du DF, Song X, et al. Study on "Environmental-genetic-gene interaction" in esophageal carcinoma: the relationship between riboflavin, Riboflavin transporter Gene 2 and NOTCH1-P53-Rb[J]. Zhengzhou Da Xue Xue Bao(Yi Xue Ban), 2018, 53(1): 1-5.] |
| [17] |
Gao S, Li S, Ma Z, et al. Presence of porphyromonas gingivalis in esophagus and its association with the clinicopathological characteristics and survival in patients with esophageal squamous cell carcinoma[J]. Infect Agents Cancer, 2016, 11: 3. DOI:10.1186/s13027-016-0049-x |
| [18] |
杨增和, 郝建生. 周恩来关心林县地方病防治、红旗渠建设和干部的成长[J]. 党的文献, 1998, 11(1): 37-39. [Yang ZH, Hao JS. Zhou Enlai is concerned about the prevention and control of local diseases in Linxian, the construction of red flag canals and the growth of cadres[J]. Dang De Wen Xian, 1998, 11(1): 37-39.] |
| [19] |
Wang LD, Zhou FY, Li XM, et al. Genome-wide association study of esophageal squamous cell carcinoma in Chinese subjects identifies susceptibility loci at PLCE1 and C20orf54[J]. Nat Genet, 2010, 42(9): 759-763. DOI:10.1038/ng.648 |
| [20] |
Wang LD, Zhou Q, Feng CW, et al. Intervention and follow-up on human esophageal precancerous lesions in Henan, northern China, a high-incidence area for esophageal cancer[J]. Gan To Kagaku Ryoho, 2002, 29(Suppl 1): 159-172. |
| [21] |
Wang LD, Yang HH, Fan ZM, et al. Cytological screening and 15 years' follow-up (1986-2001) for early esophageal squamous cell carcinoma and precancerous lesions in a high-risk population in Anyang County, Henan Province, Northern China[J]. Cancer Detect Prev, 2005, 29(4): 317-322. DOI:10.1016/j.cdp.2005.06.004 |
| [22] |
Wang LD, Hong JY, Qiu SL, et al. Accumulation of p53 protein in human esophageal precancerous lesions: a possible early biomarker for carcinogenesis[J]. Cancer Res, 1993, 53(8): 1783-1787. |
| [23] |
Wang LD, Zhou FY, Li XM, et al. Genome-wide association study of esophageal squamous cell carcinoma in Chinese subjects identifies susceptibility loci at PLCE1 and C20orf54[J]. Nat Genet, 2010, 42(9): 759-763. DOI:10.1038/ng.648 |
| [24] |
Agrawal N, Jiao Y, Bettegowda C, et al. Comparative genomic analysis of esophageal adenocarcinoma and squamous cell carcinoma[J]. Cancer Discov, 2012, 2(10): 899-905. DOI:10.1158/2159-8290.CD-12-0189 |
| [25] |
Hu N, Wang Z, Song X, et al. Genome-wide association study of gastric adenocarcinoma in Asia: a comparison of associations between cardia and non-cardia tumours[J]. Gut, 2016, 65(10): 1611-1618. DOI:10.1136/gutjnl-2015-309340 |
| [26] |
Zhao XK, Mao YM, Meng H, et al. Shared susceptibility loci at 2q33 region for lung and esophageal cancers in high-incidence areas of esophageal cancer in northern China[J]. PLoS One, 2017, 12(5): e0177504. DOI:10.1371/journal.pone.0177504 |
| [27] |
Song X, Li WQ, Hu N, et al. GWAS follow-up study of esophageal squamous cell carcinoma identifies potential genetic loci associated with family history of upper gastrointestinal cancer[J]. Sci Rep, 2017, 7(1): 4642. |
| [28] |
Zhou SL, Yue WB, Fan ZM. Autoantibody detection to tumor-associated antigens of P53, IMP1, P16, cyclin B1, P62, C-myc, Survivn, and Koc for the screening of high-risk subjects and early detection of esophageal squamous cell carcinoma[J]. Dis Esophagus, 2014, 27(8): 790-797. DOI:10.1111/dote.12145 |
| [29] |
Zhou SL, Ku JW, Fan ZM, et al. Detection of autoantibodies to a panel of tumor-associated antigens for the diagnosis values of gastric cardia adenocarcinoma[J]. Dis Esophagus, 2015, 28(4): 371-379. DOI:10.1111/dote.12206 |
 2020, Vol. 47
2020, Vol. 47
