文章信息
- PD-1和PD-L1与胃癌患者预后相关性的Meta分析
- Prognostic Role of PD-1 and PD-L1 Expression in Gastric Cancer Patients: A Meta-analysis
- 肿瘤防治研究, 2020, 47(5): 346-352
- Cancer Research on Prevention and Treatment, 2020, 47(5): 346-352
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.0950
- 收稿日期: 2019-07-24
- 修回日期: 2020-02-25
2. 730000 兰州,兰州大学第一医院普外科
2. Department of General Surgery, The First Hospital of Lanzhou University, Lanzhou 730000, China
胃癌是全球第五大常见的恶性肿瘤,2018年新增病例超过100万例,是全球所有癌症相关死亡的第三大原因,每年大约有78.3万人死于胃癌[1-2]。早期预警症状的缺乏导致胃癌患者诊断和治疗延迟,预后较差。此外,目前也没有可靠的生物标志物来筛选特异的靶基因进行靶向治疗和预测晚期胃癌患者预后[3-5]。尽管在多模式治疗方面取得了进展,但晚期胃癌患者的5年生存率仅为20%~30%[6-7]。近年来,免疫治疗,特别是免疫检查点抑制治疗,对患者而言已经成为一种新的重要的治疗方法。
程序性细胞死亡蛋白1(PD-1, CD279)是参与免疫调节的免疫球蛋白超家族B7/CD28的成员,是一种免疫抑制受体,由活化的T淋巴细胞(包括细胞毒性T细胞、B细胞和巨噬细胞)组成表达。PD-1也表达于肿瘤浸润淋巴细胞(TILs)和其他免疫细胞上。PD-1与其配体程序性细胞死亡配体1(PD-L1, B7-H1, CD274)的相互作用诱导T细胞受体信号的抑制,导致免疫应答下调,从而促进肿瘤细胞逃避免疫破坏或免疫监视。PD-L1在肿瘤和周围组织间质中均有表达,包括免疫细胞和非免疫细胞。此外,PD-1与PD-L1结合导致活化T细胞凋亡或衰竭[4-9]。有研究指出,PD-L1在胃癌等不同肿瘤类型中均有表达,在肺癌、膀胱癌、卵巢癌、肾细胞癌(RCC)等多种恶性肿瘤中,PD-L1在肿瘤或TILs上的表达表明宿主免疫应答减弱,预后不良[10-13]。越来越多的证据表明PD-L1表达与各种肿瘤的不良预后有关,PD-L1或PD-1的靶向抑制剂可能改善多种肿瘤的临床预后,包括恶性黑色素瘤、肺癌、肾细胞癌和胃癌。此外,PD-1/PD-L1通路抑制剂可能显示出潜在的临床效果,已批准用于包括胃癌在内的实体肿瘤的治疗[14-15]。
然而,PD-1和PD-L1与胃癌患者预后的相关性仍不明确,一些研究报告的结果相互矛盾。因此,我们对PD-1/PD-L1在胃癌患者中表达的预后意义进行了系统评价和Meta分析。
1 资料与方法 1.1 检索策略和数据源对PubMed、Web of Science、Cochrane Library、中国生物医药数据库(CBM)、Embase、中国知网(CNKI)等电子数据库进行了PD-1/PD-L1表达与胃癌患者预后关系的队列研究的文献检索。检索时间均为建库至2019年1月。结合MeSH-terms和关键词策略,英文检索词:(gastric cancer* OR gastric carcinoma* OR stomach cancer* OR stomach carcinoma* OR stomach neoplasm* OR gastric neoplasm* OR esophagogastric junction cancer* OR gastroesophageal junction cancer* OR esophagogastric junction carcinoma* OR gastroesophageal junction carcinoma* OR esophagogastric junction neoplasm* OR gastroesophageal junction neoplasm*)AND PD-1 AND PD-L1。中文检索词:(胃癌* OR胃肿瘤* OR食管胃结合部肿瘤* OR食管胃结合部癌*)AND PD-1 AND PD-L1。另手动检索所选文章和评论的参考文献,以获得所有可能相关的研究。所有检索文献不限语种。
1.2 纳入与排除标准纳入文献均为PD-1/PD-L1表达与胃癌患者预后关系的队列研究。纳入标准:(1)研究对象为胃癌患者; (2)仅通过队列研究分析PD-1和PD-L1的表达情况; (3)主要结果为总生存期(OS)。排除标准:非原创性研究(如Meta分析或综述)、重复研究、无法提取PD-1/PD-L1表达与胃癌关系数据的研究、数据不完整或无法检索全文的研究。
1.3 数据提取与文献质量评价提取以下数据:第一作者姓名、发表年份、国家、研究设计、样本量、年龄、性别、随访时间、危险度(HRs)、95%置信区间(95%CI)、总生存期(OS)以及研究中包含的其他混杂因素。采用纽卡斯尔-渥太华质量评价量表(NOS)对纳入研究的质量进行评价,评分范围为0(最差)~9(最好)分。NOS评估包括三个质量参数:研究人群选择、组间的可比性和结果测量。得分为6分或更高的研究被认为是高质量的研究,而低于6分的研究被认为是低质量的研究。所有文献的检索与数据提取均由两名人员独立评估完成,有分歧部分通过协商讨论解决。
1.4 统计学方法采用合并分析HRs和95%CIs来评价PD-1和PD-L1表达对胃癌预后的影响。主要结果评估指标为OS,Meta分析采用RevMan 5.3分析软件进行。利用反向方差模型和随机效应模型,加权并合并HRs。结合OR和95%CI,分析PD-1、PD-L1表达与临床病理特征的相关性。所有检验均为双侧检验,P < 0.05为差异有统计学意义。采用Cochran Q和I2统计量确定研究间的异质性。
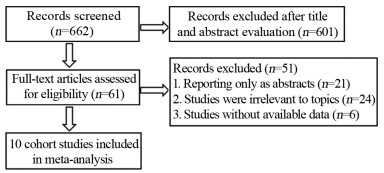
2 结果 2.1 文献检索和筛选结果剔除重复研究后,共确定662项相关研究。根据纳入和排除标准,对61篇文章进行了全文阅读评估。最终共有10项队列研究符合入选标准。检索和研究筛选过程见图 1。
|
| 图 1 纳入研究筛选过程流程图 Figure 1 Flow chart of screening of included studies |
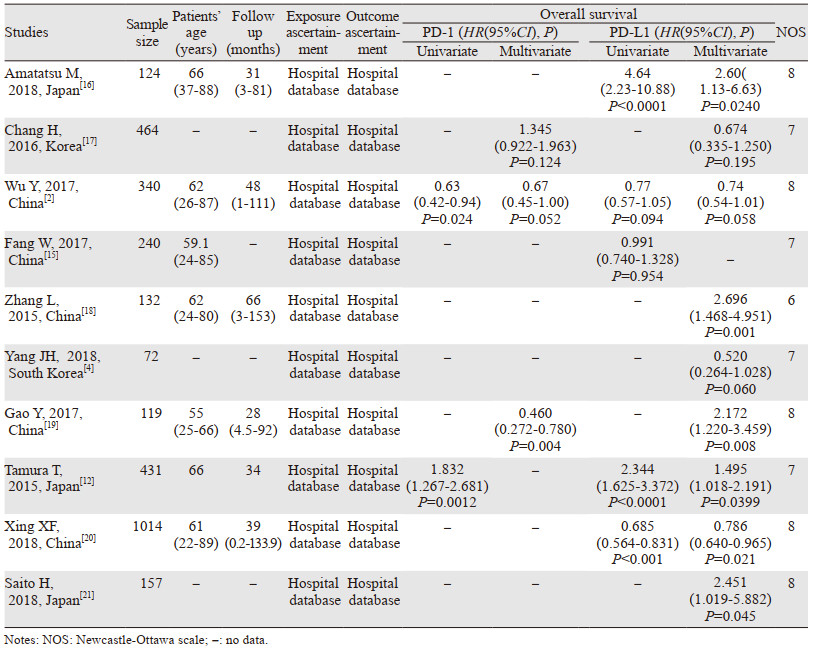
本Meta分析总共纳入3 093例胃癌患者,年龄22~89岁。这些研究发表于2015—2018年间,所有队列研究报告都来自亚洲,日本4项,韩国2项,中国4项。相关基线特征见表 1。
五项研究的质量分数为8分,四项为7分,一项为6分,均为高质量研究,见表 1。得分超过80%的项目包括“暴露组的选择”、“非暴露组的选择”、“结果评估”和“随访时间更长”。得分少于20%的研究项目是“设计和统计分析时考虑暴露组和未暴露组的可比性”。
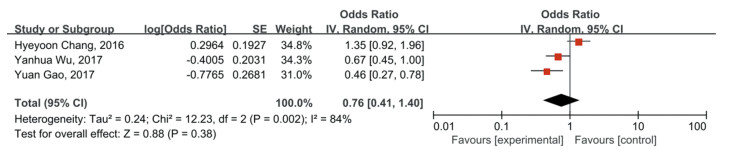
2.4 Meta分析结果 2.4.1 PD-1含1 014例胃癌患者的四项研究为OS提供了HRs,并纳入分析。单因素分析(HR=1.08, 95%CI: 0.38~3.07, P > 0.05)和多因素分析(HR=0.76, 95%CI: 0.41~1.40, P > 0.05)均未发现OS合并HR与PD-1阳性表达之间存在显著相关性,见图 2~3。

|
| 图 2 单变量分析PD-1表达对胃癌患者OS的影响 Figure 2 Effect of PD-1 expression on OS of gastric cancer patients: univariate analysis |
|
| 图 3 多变量分析PD-1表达对胃癌患者OS的影响 Figure 3 Effect of PD-1 expression on OS of gastric cancer patients: multivariate analysis |
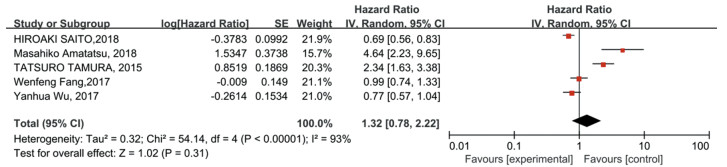
包含3 093例胃癌患者的10项研究为OS提供了HRs。单因素分析(HR=1.32, 95%CI: 0.78~2.22, P > 0.05)和多因素分析(HR=1.25, 95%CI: 0.86~1.81, P > 0.05)均未发现OS合并HR与PD-L1阳性表达存在显著相关性,见图 4~5。
|
| 图 4 单变量分析PD-L1表达对胃癌患者OS的影响 Figure 4 Effect of PD-L1 expression on OS of gastric cancer patients: univariate analysis |
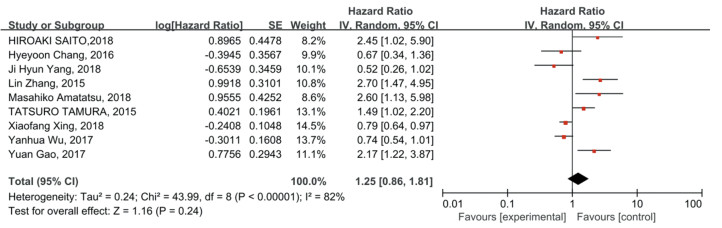
|
| 图 5 多变量分析PD-L1表达对胃癌患者OS的影响 Figure 5 Effect of PD-L1 expression on OS of gastric cancer patients: multivariate analysis |
不同性别间PD-1(OR=0.90, 95%CI: 0.52~1.54, P > 0.05)和PD-L1(OR=0.86, 95%CI: 0.71~1.05, P > 0.05)的表达水平差异无统计学意义,见图 6A、7A。非侵袭性(T1-2)和侵袭性(T3-4)胃癌中PD-1(OR=0.74, 95%CI: 0.36~1.55, P > 0.05)和PD-L1(OR=0.40, 95%CI: 0.12~1.39, P > 0.05)的表达差异无统计学意义,见图 6B、7C。有淋巴结转移的胃癌患者PD-1表达水平明显高于无淋巴结转移的胃癌患者(OR=0.60, 95%CI: 0.47~0.77, P < 0.05),见图 6C;两组间PD-L1表达水平差异无统计学意义(OR=0.50, 95%CI: 0.18~1.41, P > 0.05),见图 7D。年龄与PD-L1表达无显著相关性(OR=1.13, 95%CI: 0.78~1.65, P > 0.05),见图 7B。肿瘤分化与PD-L1表达水平无显著相关性(OR=1.00, 95%CI: 0.75~1.33, P > 0.05),见图 7E。合并OR值显示肿瘤分期与PD-L1表达之间存在显著相关性。晚期(Ⅲ~Ⅳ)胃癌患者PD-L1表达水平明显高于早期胃癌患者(OR=0.41, 95%CI: 0.23~0.72, P < 0.05),见图 7F。
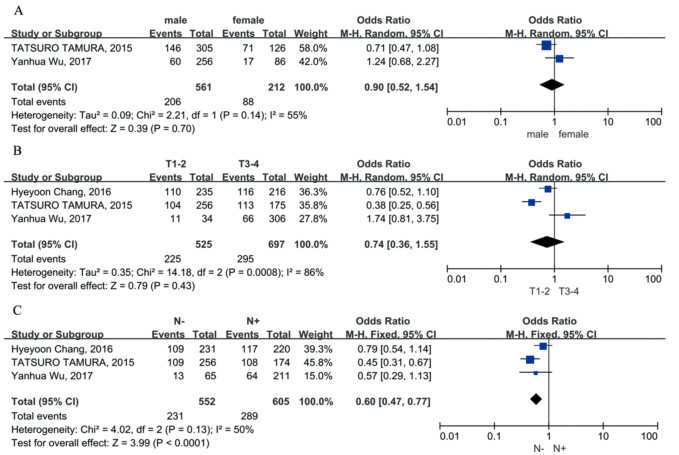
|
| A: gender; B: invasion depth; C: lymph node metastasis. 图 6 PD-1表达与胃癌患者临床病理特征的关系森林图 Figure 6 Forest plot of correlation between PD-1 expression and clinicopathological features of gastric cancer patients |
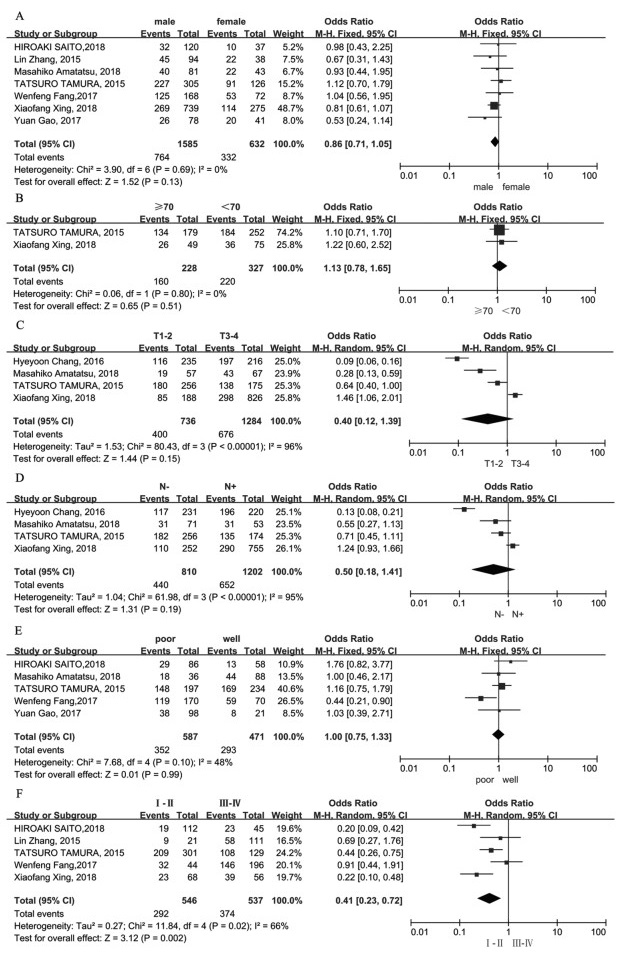
|
| A: gender; B: age; C: invasion depth; D: lymph node metastasis; E: differentiation; F: stage. 图 7 PD-L1表达与胃癌患者临床病理特征的关系森林图 Figure 7 Forest plot of correlation between PD-L1 expression and clinicopathological features of gastric cancer patients |
PD-L1表达对OS影响的多元分析漏斗图,见图 8。OS漏斗图呈对称分布,没有发表偏倚的证据。然而,由于纳入的研究相对较少,无法将漏斗图扩展到探讨其他因素分析中的发表偏倚。
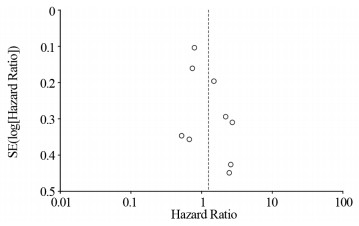
|
| 图 8 发表偏倚分析漏斗图 Figure 8 Funnel chart of publication bias |
本研究单因素和多因素分析显示,PD-1和PD-L1在胃癌患者中的表达与预后无明显相关性。此外,我们还评估了PD-L1表达与胃癌患者临床病理特征之间的关系,结果显示PD-1表达与淋巴结转移有显著相关性。有淋巴结转移(N+)的胃癌患者PD-1表达高于无淋巴结转移的胃癌患者。PD-L1的表达与胃癌患者的分期显著相关,其中晚期(Ⅲ~Ⅳ)患者PD-L1的表达水平明显高于早期胃癌患者。
由于证据的质量对每个主要结果都有显著影响,因此本Meta分析纳入的研究类型仅为队列研究。此外,本研究严格进行NOS质量评价,以确保纳入研究的质量。纳入的10项研究得分在6分以上,均被认为是高质量的研究,但纳入文献在组间可比性方面仍需关注和改进。组间缺乏可比性可能会影响Meta分析结果的整体可靠性。因此,对结果的解释必须谨慎。
此外,随访率低于60%的研究有效性有限。如果失访的原因与暴露状态和结果相关,即使20%的失访也会引起显著偏差。一般来说,长期随访80%~90%样本的大型前瞻性队列研究是非常可靠的。此外,我们认为研究者必须对纳入的文章作者采取盲法,以避免研究人员和患者主观性影响数据收集和结果分析。
本Meta分析对10项研究中的3 093例胃癌患者进行了相对较大的样本量分析,结果显示PD-1和PD-L1表达与胃癌预后无显著相关性。然而,仅有两项研究[2, 12]进行了PD-1表达数据的单变量分析,而且从基础研究获得的数据是不够的。因此,需要进一步的研究来验证PD-1表达与胃癌预后的相关性。之前的Meta分析[3]结果显示PD-L1的表达与GC3患者预后不良有显著的相关性,而本Meta分析并未发现PD-L1的表达与胃癌预后有相关性。因此,需要更多的队列研究来阐明PD-L1表达与胃癌预后的关系。性别、年龄、肿瘤浸润深度、分化程度等临床病理特征与PD-1、PD-L1表达无相关性。然而,患者的临床病理特征及PD-1、PD-L1表达对胃癌预后的影响尚不清楚。
临床中检测PD-1和PD-L1的方法和标准不尽相同,关于PD-1、PD-L1表达与胃癌预后关系的研究报道较多。然而,这些研究的结论并不一致,特别是PD-1表达与胃癌预后的关系,目前研究较少。多项研究表明PD-L1阳性表达与OS较差明显有关[22-26],但也有研究未能证实这一发现[27-28]。此外,生物标志物驱动的免疫治疗应答者的选择显著提高了治疗效果,并将不必要的暴露最小化。最近有研究表明,PD-1/PD-L1靶向治疗不同癌症类型的患者,PD-L1的高表达与较高的临床活性有关[29]。
PD-1表达对胃癌预后的影响缺乏系统综述或Meta分析。2016年发表的Meta分析报告显示PD-L1表达与胃癌预后呈正相关[3],而本Meta分析显示PD-1和PD-L1表达与胃癌预后无相关性,这可能是由于两次Meta分析研究选择的差异或人群偏倚造成的。总的来说,根据目前Meta分析的结果,我们认为PD-1和PD-L1的阳性表达并不是胃癌的预后预测因子。
本研究的局限性有以下几点:首先,纳入研究的文献仅为英文文献,未纳入中文以及其他语言文献,但是纳入研究的样本量相对较大,而且,我们制定并遵循严格的检索策略,以确保纳入的研究具有代表性; 其次,关于PD-1表达的原始研究较少; 此外,因数据不充分,亚组分析存在一定的不足。
综上,本系统评价和Meta分析纳入了10项队列研究,尚无证据表明PD-1和PD-L1的表达与胃癌的预后有关,但PD-L1的高表达与胃癌分期晚(Ⅲ~Ⅳ)有显著相关性,PD-1的高表达与淋巴结转移有显著的相关性。但仍需要进一步的大规模的队列研究来验证这些发现。
作者贡献
王玉丰:选题、文献检索及论文撰写
姚南:指导选题、论文质控及审核
王军:数据分析、文献筛选
闵光涛:文献检索、文献筛选
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. DOI:10.3322/caac.21551 |
| [2] |
Wu Y, Cao D, Qu L, et al. PD-1 and PD-L1 co-expression predicts favorable prognosis in gastric cancer[J]. Oncotarget, 2017, 8(38): 64066-64082. DOI:10.18632/oncotarget.19318 |
| [3] |
Zhang M, Dong Y, Liu H, et al. The clinicopathological and prognostic significance of pd-l1 expression in gastric cancer: A meta-analysis of 10 studies with 1, 901 patients[J]. Sci Rep, 2016, 6: 37933. DOI:10.1038/srep37933 |
| [4] |
Yang JH, Kim H, Roh SY, et al. Discordancy and changes in the pattern of programmed death ligand 1 expression before and after platinum-based chemotherapy in metastatic gastric cancer[J]. Gastric Cancer, 2019, 22(1): 147-154. DOI:10.1007/s10120-018-0842-x |
| [5] |
Yazici O, Sendur MA, Ozdemir N, et al. Targeted therapies in gastric cancer and future perspectives[J]. World J Gastroenterol, 2016, 22(2): 471-489. DOI:10.3748/wjg.v22.i2.471 |
| [6] |
Wilke H, Muro K, Van Cutsem E, et al. Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (rainbow): A double-blind, randomised phase 3 trial[J]. Lancet Oncol, 2014, 15(11): 1224-1235. DOI:10.1016/S1470-2045(14)70420-6 |
| [7] |
Zou W, Chen L. Inhibitory B7-family molecules in the tumour microenvironment[J]. Nat Rev Immunol, 2008, 8(6): 467-477. DOI:10.1038/nri2326 |
| [8] |
Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy[J]. Nat Rev Cancer, 2012, 12(4): 252-264. DOI:10.1038/nrc3239 |
| [9] |
Hino R, Kabashima K, Kato Y, et al. Tumor cell expression of programmed cell death-1 ligand 1 is a prognostic factor for malignant melanoma[J]. Cancer, 2010, 116(7): 1757-1766. |
| [10] |
Ishii H, Azuma K, Kawahara A, et al. Significance of programmed cell death-ligand 1 expression and its association with survival in patients with small cell lung cancer[J]. J Thorac Oncol, 2015, 10(3): 426-430. DOI:10.1097/JTO.0000000000000414 |
| [11] |
Bellmunt J, Mullane SA, Werner L, et al. Association of PD-L1 expression on tumor-infiltrating mononuclear cells and overall survival in patients with urothelial carcinoma[J]. Ann Oncol, 2015, 26(4): 812-817. DOI:10.1093/annonc/mdv009 |
| [12] |
Tamura T, Ohira M, Tanaka H, et al. Programmed death-1 ligand-1 (PD-L1) expression is associated with the prognosis of patients with stage ii/iii gastric cancer[J]. Anticancer Res, 2015, 35(10): 5369-5376. |
| [13] |
Alsaab HO, Sau S, Alzhrani R, et al. PD-1 and PD-L1 checkpoint signaling inhibition for cancer immunotherapy: Mechanism, combinations, and clinical outcome[J]. Front Pharmacol, 2017, 8: 561. DOI:10.3389/fphar.2017.00561 |
| [14] |
Lote H, Cafferkey C, Chau I. PD-1 and PD-L1 blockade in gastrointestinal malignancies[J]. Cancer Treat Rev, 2015, 41(10): 893-903. DOI:10.1016/j.ctrv.2015.09.004 |
| [15] |
Fang W, Chen Y, Sheng J, et al. Association between pd-l1 expression on tumour-infiltrating lymphocytes and overall survival in patients with gastric cancer[J]. J Cancer, 2017, 8(9): 1579-1585. DOI:10.7150/jca.18729 |
| [16] |
Amatatsu M, Arigami T, Uenosono Y, et al. Programmed death-ligand 1 is a promising blood marker for predicting tumor progression and prognosis in patients with gastric cancer[J]. Cancer Sci, 2018, 109(3): 814-820. DOI:10.1111/cas.13508 |
| [17] |
Chang H, Jung WY, Kang Y, et al. Programmed death-ligand 1 expression in gastric adenocarcinoma is a poor prognostic factor in a high CD8+ tumor infiltrating lymphocytes group[J]. Oncotarget, 2016, 7(49): 80426-80434. DOI:10.18632/oncotarget.12603 |
| [18] |
Zhang L, Qiu M, Jin Y, et al. Programmed cell death ligand 1 (PD-L1) expression on gastric cancer and its relationship with clinicopathologic factors[J]. Int J Clin Exp Pathol, 2015, 8(9): 11084-11091. |
| [19] |
Gao Y, Li S, Xu DZ, et al. Prognostic value of programmed death-1, programmed death-ligand 1, programmed death-ligand 2 expression, and CD8(+) T cell density in primary tumors and metastatic lymph nodes from patients with stage T1-4N+M0 gastric adenocarcinoma[J]. Chin J Cancer, 2017, 36(1): 61. DOI:10.1186/s40880-017-0226-3 |
| [20] |
Xing XF, Guo JP, Ding GY, et al. Analysis of PD1, PDL1, PDL2 expression and T cells infiltration in 1014 gastric cancer patients[J]. Oncoimmunology, 2017, 7(3): e1356144. |
| [21] |
Saito H, Ko no, Murakami Y, et al. Highly Activated PD-1/PD-L1 Pathway in Gastric Cancer with PD-L1 Expression[J]. Anticancer Res, 2018, 38(1): 107-112. |
| [22] |
Wu C, Zhu Y, Jiang J, et al. Immunohistochemical localization of programmed death-1 ligand-1 (pd-l1) in gastric carcinoma and its clinical significance[J]. Acta Histochem, 2006, 108(1): 19-24. DOI:10.1016/j.acthis.2006.01.003 |
| [23] |
Geng Y, Wang H, Lu C, et al. Expression of costimulatory molecules B7-H1, B7-H4 and Foxp3(+) Tregs in gastric cancer and its clinical significance[J]. Int J Clin Oncol, 2015, 20(2): 273-281. DOI:10.1007/s10147-014-0701-7 |
| [24] |
Hou J, Yu Z, Xiang R, et al. Correlation between infiltration of FOXP3+ regulatory T cells and expression of B7-H1 in the tumor tissues of gastric cancer[J]. Exp Mol Pathol, 2014, 96(3): 284-291. DOI:10.1016/j.yexmp.2014.03.005 |
| [25] |
Qing Y, Li Q, Ren T, et al. Upregulation of PD-L1 and APE1 is associated with tumorigenesis and poor prognosis of gastric cancer[J]. Drug Des Devel Ther, 2015, 9: 901-909. |
| [26] |
Wang LA, Wei X, Li Q, et al. The prediction of survival of patients with gastric cancer with PD-L1 expression using contrast-enhanced ultrasonography[J]. Tumor Biol, 2016, 37(6): 7327-7332. DOI:10.1007/s13277-015-4600-y |
| [27] |
Kim JW, Nam KH, Ahn SH, et al. Prognostic implications of immunosuppressive protein expression in tumors as well as immune cell infiltration within the tumor microenvironment in gastric cancer[J]. Gastric Cancer, 2016, 19(1): 42-52. DOI:10.1007/s10120-014-0440-5 |
| [28] |
Boger C, Behrens HM, Mathiak M, et al. PD-L1 is an independent prognostic predictor in gastric cancer of Western patients[J]. Oncotarget, 2016, 7(17): 24269-24283. DOI:10.18632/oncotarget.8169 |
| [29] |
Meng X, Huang Z, Teng F, et al. Predictive biomarkers in PD-1/PD-L1 checkpoint blockade immunotherapy[J]. Cancer Treat Rev, 2015, 41(10): 868-876. DOI:10.1016/j.ctrv.2015.11.001 |
 2020, Vol. 47
2020, Vol. 47