文章信息
- CA3诱导肝癌HepG2细胞凋亡及其机制
- CA3 Induces Apoptosis of Hepatocellular Carcinoma HepG2 Cells and Related Mechanism
- 肿瘤防治研究, 2020, 47(5): 330-334
- Cancer Research on Prevention and Treatment, 2020, 47(5): 330-334
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.0948
- 收稿日期: 2019-07-24
- 修回日期: 2019-12-12
2. 121000 锦州,锦州医科大学附属第一医院消化内科;
3. 121000 锦州,锦州医科大学老年病与慢性病研究所,辽宁省糖尿病感知功能障碍重点实验室
2. Department of Gastroenterology, First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121000, China;
3. Liaoning Province Key Laboratory of Diabetic Cognitive Dysfunction, Institute of Geriatrics and Chronic Diseases, Jinzhou Medical University, Jinzhou 121000, China
原发性肝癌是全球第六大常见癌症,也是癌症死亡的第二大常见原因[1]。据统计,2018年,全球约增加84.1万新病例,约78.2万人死亡[2]。目前,外科手术仍是传统的治疗方法。由于其高侵袭性,大多数病例在确诊时已进展到中晚期,错过了最佳手术时机[3]。肝癌死亡率与发病率之比为0.95,说明预后极差[4]。因此,开发新的抗癌药物是研究的热点。
CA3又称CIL56,是一种新的YAP1(yes相关蛋白1)靶向抑制剂,CA3对YAP1转录活性的明显抑制,使其能够抑制增殖、诱导凋亡、减少肿瘤球的形成[5]。现已证明,CA3可以在相对较低的浓度下抑制食管腺癌[5]和胃腺癌细胞[6]的生长,诱导细胞凋亡,且无明显毒性。目前关于CA3在肝癌中的作用机制仍未得到充分研究,因此本实验以肝癌HepG2细胞为研究对象,探讨CA3对肝癌细胞增殖、凋亡的作用及其机制。
1 材料与方法 1.1 实验材料肝癌HepG2细胞由锦州医科大学分子生物学实验室保存; CA3购自上海蓝木化工有限公司; RPMI1640培养基购自美国Gibco公司; 胎牛血清购自杭州四季青生物工程公司; 增强型CCK-8试剂盒购自上海尚宝生物科技有限公司; Annexin V-FITC/PI双染细胞凋亡试剂盒购自南京碧波生物科技有限公司; 活性氧检测试剂盒购自上海碧云天生物技术有限公司; YAP1抗体购自沈阳万类生物公司; Bcl-2、Bax、Caspase-3抗体、辣根过氧化物酶(horseradish peroxidase, HRP)标记的山羊抗小鼠IgG、HRP标记的山羊抗兔IgG购自美国Proteintech公司。
仪器:细胞成像微孔板检测系统(Cytation5,美国BioTek公司),流式细胞仪(NovoCyte,美国ACEA公司)。
1.2 方法 1.2.1 细胞培养用含10%胎牛血清的RPMI1640培养基培养HepG2细胞,置于37℃、5%CO2饱和湿度的培养箱中进行培养,每2~3 d传代一次并观察细胞的变化。
1.2.2 增强型CCK-8试剂盒检测HepG2细胞的增殖取对数生长期的HepG2细胞,经胰蛋白酶消化后,分别以每孔1×104个接种于96孔板中,每孔100 μl,细胞培养24 h后加入药物。使CA3终浓度为0、0.25、0.5、1.0、2.0和4.0 mmol/L,每个浓度设置5个复孔,加药后分别培养24和48 h。每孔加入10 μl增强型CCK-8试剂,放入培养箱孵育1~4 h,于490 nm处测定OD值。细胞活力(%)=(OD加药细胞-OD空白)/(OD对照细胞-OD空白)×100%。
1.2.3 流式细胞术检测CA3对HepG2细胞凋亡的影响分别收集0、0.5、1.0和2.0 mmol/L CA3作用48 h的HepG2细胞,取1×105个细胞,按说明处理细胞:PBS洗涤细胞2次; 加入500 µl Binding Buffer重悬细胞; 分别加入5 µl Annexin V-FITC和PI室温避光染色10 min,进行流式细胞仪检测,分析细胞凋亡率,同一实验平行重复3次。
1.2.4 活性氧(ROS)含量检测用无血清培养液按1:1 000稀释DCFH-DA,使终浓度为10 mmol/L。取0、0.5、1.0和2.0 mmol/L CA3作用48 h的HepG2细胞,吸去培养液,加入适量的DCFH-DA,充分盖住细胞,37℃培养箱孵育20 min,用无血清培养基洗涤3次,于488 nm激发波长和525 nm发射波长,采用细胞成像微孔板检测系统检测细胞内活性氧含量,放大倍数4倍。同一实验平行重复3次。
1.2.5 Western blot法检测YAP1、Bcl-2、Bax和Caspase-3蛋白水平用0.5、1.0和2.0 mmol/L的CA3处理细胞48 h,胰酶消化细胞后收集适量细胞。提取蛋白后,BCA蛋白浓度定量。经电泳、转模、BSA封闭2 h后加一抗,于4℃孵育过夜。TBST洗3次,5分钟/次,加二抗,室温孵育1 h,ECL显影。同一实验平行重复3次,Image-J软件分析条带结果。
1.3 统计学方法使用SPSS19.0软件对实验数据进行统计分析,多组样本之间的比较采用单因素方差分析,两组间比较采用两独立样本t检验,P < 0.05为差异有统计学意义。
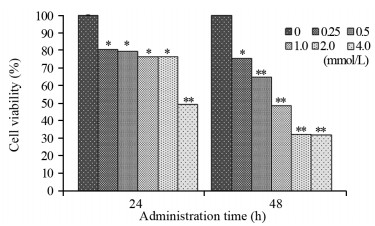
2 结果 2.1 不同浓度CA3对HepG2细胞增殖的影响CA3对细胞作用相同时间后,随着药物浓度增加,细胞增殖率下降。0.25、0.5、1.0、2.0和4.0 mmol/L的CA3作用HepG2细胞24 h后,细胞增殖率分别为(80.5±0.3)%、(79.4±0.2)%、(76.2±0.2)%、(76.4±0.1)%和(49.3±0.4)%; 作用48 h后,细胞增殖率分别为(75.3±0.2)%、(64.8±0.3)%、(48.4±0.2)%、(32.2±0.4)%和(31.9±0.2)%。2.0 mmol/L CA3作用细胞24和48 h后,与0 mmol/L组比较,细胞增殖率差异均有统计学意义(P=0.034, P=0.000),见图 1。图中显示,CA3作用48 h后,组内差异显著,为进一步探讨其机制,选择0.5、1.0和2.0 mmol/L三个浓度进行后续研究。
|
| *: P < 0.05; **: P < 0.01, compared with the 0 mmol/L CA3 group. 图 1 不同浓度CA3作用24和48h后对HepG2细胞增殖率的影响 Figure 1 Proliferation rate of HepG2 cells after different concentrations of CA3 treatment for 24 and 48h |
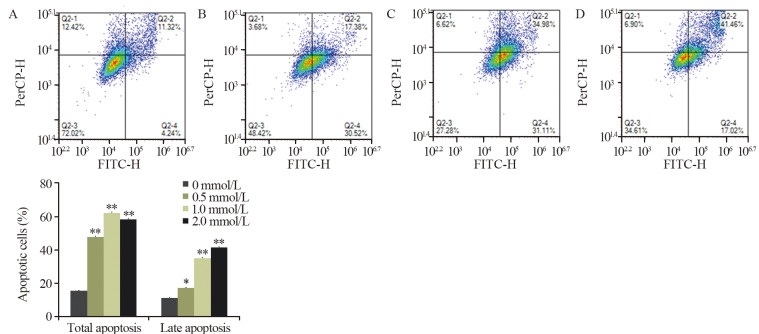
不同浓度CA3作用HepG2细胞48 h后,随着药物浓度的增加细胞凋亡率增加,见图 2。2.0 mmol/L CA3作用HepG2细胞48 h后,凋亡率由0 mmol/L的15.56%增加到2.0 mmol/L的58.48%,两组相比差异有统计学意义(P=0.000); 其中晚期凋亡率由0 mmol/L的11.32%增加到2.0 mmol/L的41.46%,两组相比,差异有统计学意义(P=0.000)。
|
| *: P < 0.05; **: P < 0.01, compared with the 0 mmol/L CA3 group; A: 0 mmol/L CA3 group; B: 0.5 mmol/L CA3 group; C: 1.0 mmol/L CA3 group; D: 2.0 mmol/L CA3 group. 图 2 不同浓度CA3作用HepG2细胞48h后对细胞凋亡率的影响 Figure 2 Apoptosis of HepG2 cells after different concentrations of CA3 treatment for 48h |
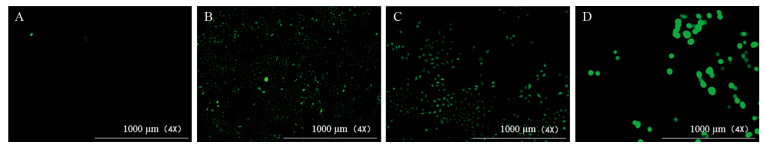
不同浓度CA3作用HepG2细胞48 h后,随着CA3药物浓度增加,细胞内ROS的含量明显增加。结果表明,与0 mmol/L组相比,CA3能促进肝癌HepG2细胞发生氧化应激,见图 3。
|
| A: 0 mmol/L CA3 group; B: 0.5 mmol/L CA3 group; C: 1.0 mmol/L CA3 group; D: 2.0 mmol/L CA3 group. 图 3 不同浓度CA3作用HepG2细胞48h后细胞内活性氧含量的变化 Figure 3 Content of intracellular reactive oxygen species(ROS) in HepG2 cells after different concentrations of CA3 treatment for 48 h |
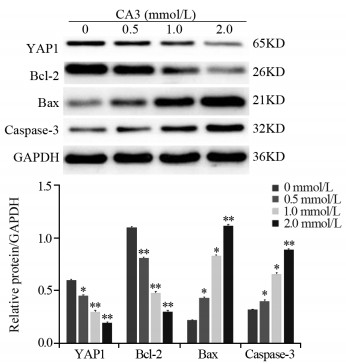
2.0 mmol/L的CA3作用HepG2细胞48 h后,Western blot法检测结果显示,与0 mmol/L组相比,YAP1(P=0.007)、Bcl-2(P=0.000)表达降低,Bax(P=0.000)、Caspase-3(P=0.000)表达升高,差异有统计学意义(均P < 0.05),见图 4。
|
| *: P < 0.05; **: P < 0.01, compared with the 0 mmol/L CA3 group. 图 4 不同浓度CA3作用HepG2细胞48h后,YAP1、Bcl-2、Bax和Caspase-3蛋白表达变化 Figure 4 Expression of YAP1, Bcl-2, Bax and Caspase-3 protein in HepG2 cells after different concentrations of CA3 treatment for 48 h |
现如今,如何通过药物诱导肿瘤细胞凋亡成为药物研发的热点,细胞凋亡机制也将成为恶性肿瘤治疗及预后的研究重点。由于大多数抗癌药物在血液循环中的半衰期短,水溶性较差,化疗效果并不如预期理想[7],因此,寻找改善预后及降低不良反应的新型药物对于肝癌治疗研究有着极为重要的意义。
目前抗肝癌药物研究中,脂联素通过调控硫氧还蛋白表达诱导肝癌细胞凋亡[8],而吴茱萸碱可通过抑制肝癌细胞中的Akt信号通路来诱导凋亡[9],华蟾毒它灵则是通过产生神经酰胺诱导肝癌细胞的凋亡[10]。与上述药物相比,在Li等[11]的研究中发现,YAP1抑制剂CA3在相对较低浓度下即对食管癌细胞表现出较强的抗肿瘤作用,且毒性较小。当CA3和CDK6抑制剂LEE001联合应用时,效果更佳。本实验通过增强型CCK-8检测显示,CA3在较低的浓度下对肝癌细胞的增殖也表现出较强的抑制作用且其毒性较小。流式细胞术结果显示,随着CA3浓度增加,其凋亡率也明显增加。
Hippo通路是一种保守的、参与组织发育和再生的进化信号通路,可调节细胞增殖和凋亡[12]。YES相关蛋白1(YAP1)是Hippo通路中最具特征的核心效应蛋白[13],在多种癌细胞中广泛而频繁地过表达,具有调控细胞增殖并抑制细胞凋亡的作用[14]。YAP1的过表达与非小细胞肺癌、乳腺癌、肝癌、食管癌和胃癌患者预后不良相关[15]。研究证实,YAP1已成为一种新的生物标志物,是一种潜在的肝癌治疗靶点。在Zhang等[16]的研究中发现,YAP1在肝癌组织中的表达明显高于其正常组织,YAP1的下调使肝癌细胞增殖减少,凋亡增加。这与本研究结果一致,CA3通过抑制YAP1的表达可抑制肝癌的增殖,促进其凋亡。
YAP1还被证明可以介导许多致癌信号通路,如PI3K-mTOR[17]、KRAS/EGFR[18]、g蛋白偶联受体[19]和Wnt/β-catenin[20]等。Bcl-2家族蛋白是研究细胞凋亡通路时最常见的蛋白之一,大量实验已证明它可调控细胞的凋亡。Bcl-2家族可分为抗凋亡的Bcl-2、Bcl-xL、Mcl-1和促凋亡的Bax、Bak、Bad蛋白。Bcl-2家族蛋白,可以通过控制线粒体膜的通透性,促进细胞色素c释放到细胞质中,启动Caspase参与的凋亡[21]。Caspase-3是外源性和内源性凋亡途径的中心节点,驱动细胞凋亡的最终形成[22]。细胞凋亡过程中,Bax可进入线粒体,形成通道使细胞色素c释放到细胞质中,激活Caspase-3从而发挥其促凋亡作用[23]。而抗凋亡Bcl-2和Bcl-xL蛋白可通过维持线粒体膜的完整性阻止Caspase-3的激活[24]。因此,抑制Bcl-2、促进Bax、Caspase-3的表达,可使肿瘤细胞发生凋亡。为探究CA3是否影响Bcl-2、Bax和Caspase-3的表达,本实验用Western blot法检测发现,随着CA3浓度的增加,Bcl-2的表达降低,Bax和Caspase-3的表达升高,最终肝癌细胞发生凋亡,证实了CA3的抗肿瘤作用。
在癌细胞内,ROS的适度增加促进细胞的生长和增殖,而高水平的ROS诱导细胞凋亡[25]。有研究证明,ROS浓度升高可促进肝癌细胞[26]、膀胱癌细胞[27]、胶质瘤细胞[28]的凋亡,ROS的增加也可促进Caspase-3的激活,从而参与诱导凋亡[28]。因此,促进细胞内ROS的生成,是一种潜在的癌症治疗方法。通过本实验发现,当CA3的浓度增加时,细胞内ROS的含量也明显增加,肝癌细胞发生凋亡,进一步证实了CA3的抗肿瘤作用。
综上所述,CA3可抑制肝癌HepG2细胞的增殖,诱导其凋亡,其机制可能与抑制YAP1及调控Bcl-2蛋白家族的表达,使YAP1、Bcl-2蛋白表达降低、Bax和Caspase-3的表达升高有关,同时ROS的升高也可能参与细胞凋亡。本研究旨在证明CA3可能是潜在有价值的肝癌治疗药物,未来可进一步研究其在体内对肝癌细胞的影响,并探讨CA3与其他药物联合应用的疗效。
作者贡献
张舒文:实验设计、实施,数据整理及论文撰写
李晓飞:协助实验实施及数据整理
于洪丹:实验数据及结果分析
郭莲怡:指导实验设计及论文修改
| [1] |
Valery PC, Laversanne M, Clark PJ, et al. Projections of Primary Liver Cancer to 2030 in 30 Countries Worldwide[J]. Hepatology, 2018, 67(2): 600-611. |
| [2] |
Bray F, Ferlay J, Soerjomataram I, et al. Global Cancer Statistics 2018: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [3] |
Li MF, Guan H, Zhang DD. Effect of overexpression of PTEN on apoptosis of liver cancer cells[J]. Genet Mol Res, 2016, 15(2). |
| [4] |
Petrick JL, Braunlin M, Laversanne M, et al. International trends in liver cancer incidence, overall and by histologic subtype, 1978-2007[J]. Int J Cancer, 2016, 139(7): 1534-1545. DOI:10.1002/ijc.30211 |
| [5] |
Song S, Xie M, Scott AW, et al. A Novel YAP1 Inhibitor targets CSC-Enriched Radiation- Resistant Cells and Exerts Strong Antitumor Activity in Esophageal Adenocarcinoma[J]. Mol Cancer Ther, 2018, 17(2): 443-454. |
| [6] |
Ajani JA, Estrella JS, Chen Q, et al. Galectin-3 expression is prognostic in diffuse type gastric adenocarcinoma, confers aggressive phenotype, and can be targeted by YAP1/BET inhibitors[J]. Br J Cancer, 2018, 118(1): 52-61. |
| [7] |
Zhu B, Li Y, Lin Z, et al. Silver Nanoparticles Induce HePG-2 Cells Apoptosis Through ROS-Mediated Signaling Pathways[J]. Nanoscale Res Lett, 2016, 11(1): 198. DOI:10.1186/s11671-016-1419-4 |
| [8] |
Xing SQ, Zhang CG, Yuan JF, et al. Adiponectin induces apoptosis in hepatocellular carcinoma through differential modulation of thioredoxin proteins[J]. Biochem Pharmacol, 2015, 93(2): 221-231. |
| [9] |
Yang F, Shi L, Liang T, et al. Anti-tumor effect of evodiamine by inducing Akt-mediated apoptosis in hepatocellular carcinoma[J]. Biochem Biophys Res Commun, 2017, 485(1): 54-61. |
| [10] |
Cheng L, Chen YZ, Peng Y, et al. Ceramide production mediates cinobufotalin-induced growth inhibition and apoptosis in cultured hepatocellular carcinoma cells[J]. Tumour Biol, 2015, 36(8): 5763-5771. DOI:10.1007/s13277-015-3245-1 |
| [11] |
Li F, Xu Y, Liu B, et al. YAP1-mediated CDK6 Activation Confers Radiation Resistance in Esophageal Cancer[J]. Clin Cancer Res, 2019, 25(7): 2264-2277. DOI:10.1158/1078-0432.CCR-18-1029 |
| [12] |
Guichet PO, Masliantsev K, Tachon G, et al. Fatal correlation between YAP1 expression and glioma aggressiveness: clinical and molecular evidence[J]. J Pathol, 2018, 246(2): 205-216. |
| [13] |
Kodaka M, Hata Y. The mammalian Hippo pathway: regulation and function of YAP1 and TAZ[J]. Cell Mol Life Sci, 2015, 72(2): 285-306. DOI:10.1007/s00018-014-1742-9 |
| [14] |
Li YW, Guo J, Shen H, et al. Phosphorylation of Tyr188 in the WW domain of YAP1 plays an essential role in YAP1-induced cellular transformation[J]. Cell Cycle, 2016, 15(18): 2497-2505. DOI:10.1080/15384101.2016.1207836 |
| [15] |
Zanconato F, Cordenonsi M, Piccolo S. YAP/TAZ at the roots of cancer[J]. Cancer Cell, 2016, 29(6): 783-803. |
| [16] |
Zhang L, Yu Z, Xian Y, et al. microRNA-497 inhibits cell proliferation and induces apoptosis by targeting YAP1 in human hepatocellular carcinoma[J]. FEBS Open Bio, 2016, 6(2): 155-164. DOI:10.1002/2211-5463.12032 |
| [17] |
Hao J, Zhang Y, Jing D, et al. Role of Hippo signaling in cancer stem cells[J]. J Cell Physiol, 2014, 229(3): 266-270. DOI:10.1002/jcp.24455 |
| [18] |
Kapoor A, Yao W, Ying H, et al. Yap1 Activation Enables Bypass of Oncogenic Kras Addiction in Pancreatic Cancer[J]. Cell, 2014, 158(1): 185-197. |
| [19] |
Zhou X, Wang S, Wang Z, et al. Estrogen regulates Hippo signaling via GPER in breast cancer[J]. J Clin Invest, 2015, 125(5): 2123-2135. DOI:10.1172/JCI79573 |
| [20] |
Azzolin L, Panciera T, Soligo S, et al. YAP/TAZ Incorporation in the β-Catenin Destruction Complex Orchestrates the Wnt Response[J]. Cell, 2014, 158(1): 157-170. |
| [21] |
Chaabane W, User SD, ElGazzah M, et al. Autophagy, Apoptosis, Mitoptosis and Necrosis: Interdependence Between Those Pathways and Effects on Cancer[J]. Arch Immunol Ther Exp(Warsz), 2013, 61(1): 43-58. |
| [22] |
Ashkenazi A, Fairbrother WJ, Leverson JD, et al. From basic apoptosis discoveries to advanced selective BCL-2 family inhibitors[J]. Nat Rev Drug Discov, 2017, 16(4): 273-284. |
| [23] |
Aluvila S, Mandal T, Hustedt E, et al. Organization of the mitochondrial apoptotic BAK pore: oligomerization of the BAK homodimers[J]. J Biol Chem, 2014, 289(5): 2537-2551. DOI:10.1074/jbc.M113.526806 |
| [24] |
Zhang Z, Zhang H, Chen S, et al. Dihydromyricetin induces mitochondria-mediated apoptosis in HepG2 cells through down-regulation of the Akt/Bad pathway[J]. Nutr Res, 2017, 38: 27-33. DOI:10.1016/j.nutres.2017.01.003 |
| [25] |
Dharmaraja AT. Role of Reactive Oxygen Species (ROS) in Therapeutics and Drug Resistance in Cancer and Bacteria[J]. J Med Chem, 2017, 60(8): 3221-3240. DOI:10.1021/acs.jmedchem.6b01243 |
| [26] |
Wu CL, Geng XP, Wan SY, et al. Cecropin-P17, an analog of Cecropin B, inhibits human hepatocellular carcinoma cell HepG-2 proliferation via regulation of ROS, Caspase, Bax, and Bcl-2[J]. J Pept Sci, 2015, 21(8): 661-668. DOI:10.1002/psc.2786 |
| [27] |
Jeong JW, Lee WS, Go SI, et al. Pachymic Acid Induces Apoptosis of EJ Bladder Cancer Cells by DR5 Up-Regulation, ROS Generation, Modulation of Bcl-2 and IAP Family Members[J]. Phytother Res, 2015, 29(10): 1516-1524. DOI:10.1002/ptr.5402 |
| [28] |
Jia G, Wang Q, Wang R, et al. Tubeimoside-1 induces glioma apoptosis through regulation of Bax/Bcl-2 and the ROS/CytochromeC/Caspase-3 pathway[J]. Onco Targets Ther, 2015, 8: 303-311. DOI:10.2147/OTT.S76063 |
 2020, Vol. 47
2020, Vol. 47


