文章信息
- 单中心非转移性男性乳腺癌临床病理特征和生存分析
- Clinicopathological Characteristics and Outcomes of Male Patients with Resected Distant Metastasis-Free Breast Cancer in A Single Center
- 肿瘤防治研究, 2020, 47(2): 97-101
- Cancer Research on Prevention and Treatment, 2020, 47(2): 97-101
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.0946
- 收稿日期: 2019-07-24
- 修回日期: 2019-12-31
2. 310022 杭州,浙江省肿瘤医院乳腺外科;
3. 310022 杭州,浙江省肿瘤医院病理科
2. epartment of Breast Surgery, Zhejiang Cancer Hospital, Hangzhou 310022, China;
3. Department of Pathology, Zhejiang Cancer Hospital, Hangzhou 310022, China
男性乳腺癌(male breast cancer, MBC)约占乳腺癌的1%,临床少见。近年来发病率有上升趋势,2010年Anderson等对SEER数据库统计发现男性乳腺癌的发病率已上升至1.19%[1]。由于男性乳腺癌的低发病率,在乳腺癌的大型临床研究中通常不作为研究对象。其流行病学特征、治疗策略及预后情况等目前尚缺乏随机临床研究,更无临床指南或共识,治疗均参照女性乳腺癌的研究结果。但越来越多的临床回顾性研究证实男性乳腺癌有其特有的临床病理特点及预后,如缺乏小叶结构,病理类型通常以浸润性导管癌为主,浸润性小叶癌罕见[2-3],激素受体阳性率高,BRCA突变率较女性乳腺癌高等[4]。
本研究拟通过回顾性分析本中心152例非转移性成年男性乳腺癌的临床病理特征及诊治情况,探讨其预后相关因素,为临床诊治提供一定参考。
1 资料与方法 1.1 临床资料收集浙江省肿瘤医院1986年1月—2018年12月收治的男性乳腺癌患者172例,占同期总乳腺癌病例的1%。其中5例为Ⅳ期,13例因手术禁忌证或其他原因未行手术治疗,2例为儿童分泌性乳腺癌,最终本研究共入组成年非转移性男性乳腺癌手术病例152例。所有病例均有明确的病理结果和完整的病历资料。所有分期参照AJCC分期第7版。
1.2 免疫组织化学指标及标准所有入组乳腺癌病理及免疫组织化学资料均由病理科医生复片。免疫组织化学指标根据2010版美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)和美国病理学家学会(College of American Pathologists, CAP)指南[5]判定:雌激素受体(estrogen receptor, ER)/孕激素受体(progesterone receptor, PR)阳性定义为≥1%肿瘤细胞核着色,阴性定义为在有阳性内部对照的情况下 < 1%的肿瘤细胞核着色。人表皮生长因子受体(human epidermal growth factor receptor 2, HER2)阳性定义为免疫组织化学检测+++或免疫荧光检测(fluorescence in-situ hybridization, FISH)阳性者。
1.3 前哨淋巴结显像及活检采用蓝染料法进行前哨淋巴结显像。用1%亚甲蓝注射液2 ml在乳晕或原发肿瘤周围皮下或皮内注射,10~15 min后于腋窝处沿蓝染淋巴管探查前哨淋巴结,将蓝染和触诊可疑的肿大、质硬的淋巴结一并切除,术中行冰冻快速病理诊断。前哨淋巴结(sentinel lymph node, SLN)冰剩组织及腋窝非前哨淋巴结(non-sentinel lymph node, NSLN)行常规病理组织学检测,逐层切片HE染色。
1.4 随访方法通过病历系统随访资料和电话回访的方式进行随访,记录复发转移的时间和部位。总生存期(overall survival, OS)定义为从手术至任何原因的死亡。无病生存时间(disease free survival, DFS)定义为手术至疾病复发(包括局部或远处转移)或死亡。
1.5 统计学方法应用SPSS22.0软件进行统计学分析,一般资料用描述性统计,OS和DFS均采用Kaplan-Meier法计算生存率、绘制生存曲线,并运用单因素方差分析OS和DFS的影响因素,P < 0.05为差异有统计学意义。
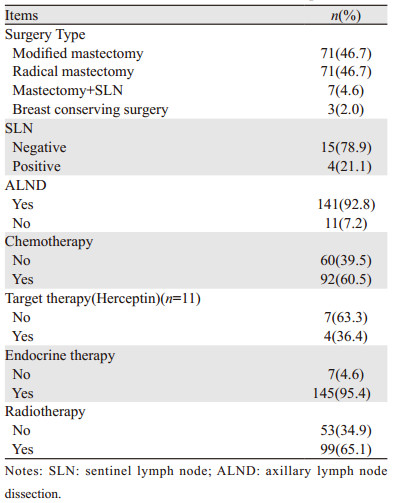
2 结果 2.1 人口学特征本研究共入组152例成年男性乳腺癌,均行手术治疗,中位发病年龄为58岁(24~84岁),40岁以下5例。多为单侧乳腺癌,仅1例为双侧乳腺癌。首发症状以乳房肿块为主,占93.4%,个别患者表现为乳头溢液、局部皮肤破溃及腋窝肿物等,71.7%肿块位于乳晕区。5例患者同时合并其他恶性肿瘤,其中2例合并肺癌,2例合并胃癌,1例合并前列腺癌。
2.2 临床病理学特征入组152例中,4例为原位癌(1例派杰氏病、3例导管原位癌)、浸润性导管癌132例(86.8%)、黏液腺癌6例、髓样癌4例、浸润性乳头状瘤3例、浸润性筛状癌1例、分泌性癌1例和包裹性乳头状癌1例。肿瘤中位大小约20.0 mm(95%CI: 18.0~21.0),根据AJCC分期,0期4例(2.6%)、Ⅰ期53例(34.9%)、Ⅱ期57例(37.5%)、Ⅲ期38(25.0%)、淋巴结累及率44.1%(67/152),其中淋巴结累及4个以上达50.7%(34/67)。14例(9.2%)患者伴脉管瘤栓。148例浸润癌中,ER阳性者139例(93.9%),HER2阳性者11例(7.4%),见表 1。
|
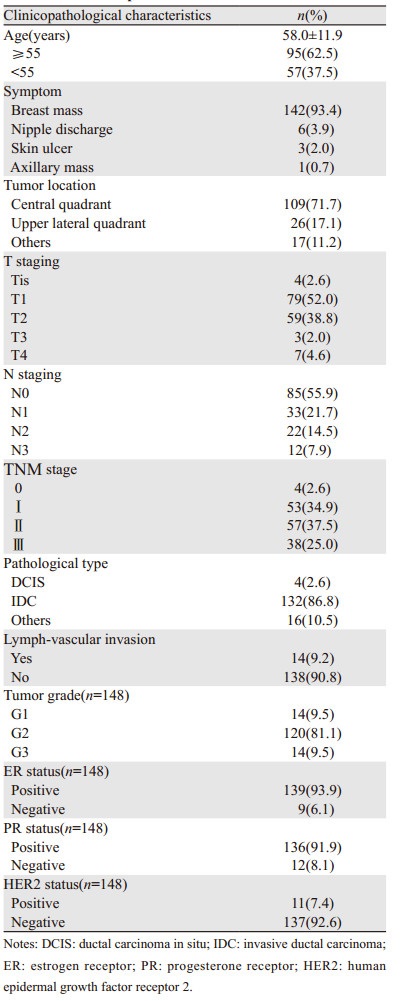
男性乳腺癌患者手术以全乳切除为主(n=149, 98.0%),保乳少见(n=3, 2.0%),无重建病例。2000年前大部分行传统根治术,切除胸大小肌,2010年后早期患者以改良根治术为主。2014年前无论是原位癌还是浸润性癌,常规行腋窝淋巴结清扫(axillary lymph node dissection, ALND),2014后开展前哨淋巴结(sentinel lymph node, SLN)活检。 19例SLN活检中,4例提示转移行ALND,15例SLN阴性中8例行常规ALND,7例免除ALND。23例局部进展期男性乳腺癌患者行新辅助治疗,1例80岁ⅢB患者行新辅助内分泌治疗达PR后,再行手术,余均行新辅助化疗,有效率(SD+PR+CR)达87%。术后60.5%(92/152)的患者接受了辅助化疗。99例(65.1%)患者术后接受了胸壁及锁骨上下区放疗。ER/PR阳性患者除1名患者拒绝服用外,有99.3%的患者行内分泌治疗,132例(86.8%)服用他莫昔芬,5例(3.3%)服用芳香化酶抑制剂,8例(5.3%)给予戈舍瑞林联合芳香化酶抑制剂。11例HER2阳性患者,因经济原因,只有4例患者联合赫赛汀予靶向治疗。入组患者具体治疗情况,见表 2。
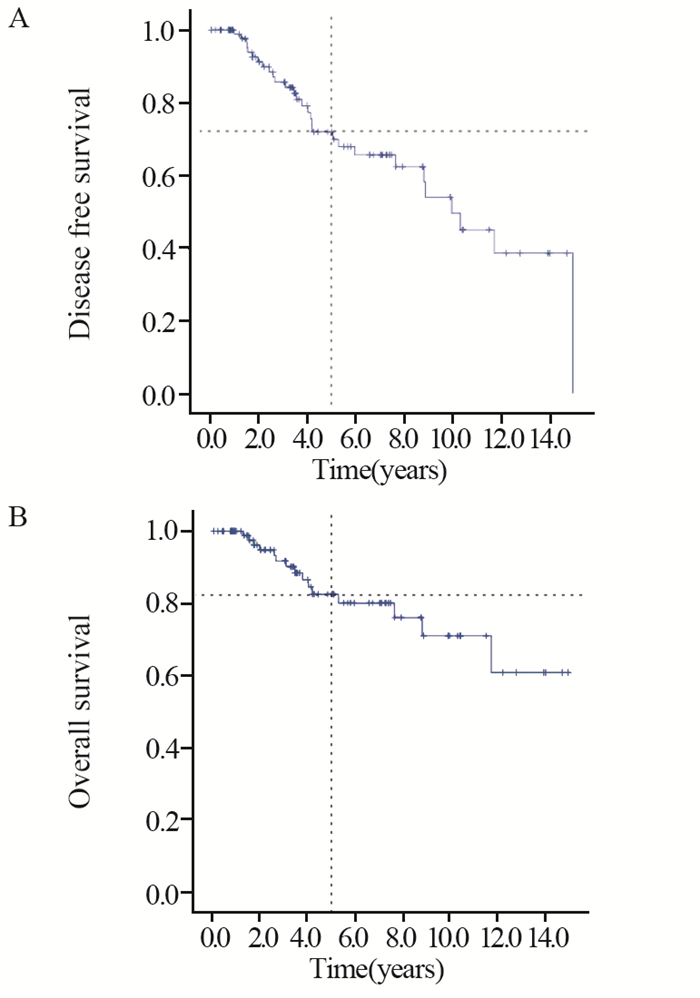
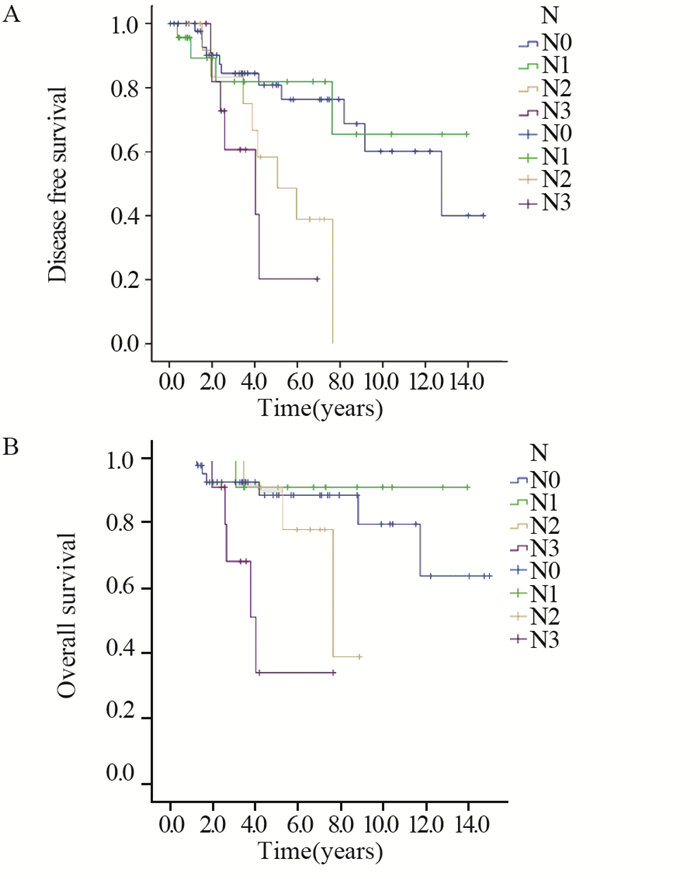
本研究排除Ⅳ期患者,Ⅰ~Ⅱ期患者占72.4%。中位随访时间42.7(2~179.5)月。5年总生存率为82.4%,5年无病生存率为69.9%,生存曲线见图 1。2例同侧胸壁复发,4例同侧腋窝复发。远处转移以肺转移多见(9例),其次为骨转移(6例),1例出现后腹膜转移。对年龄、肿瘤大小,淋巴结状态,HR/HER2状态进行单因素生存分析,发现仅淋巴结转移数与无病生存时间(P=0.012)和总生存时间(P=0.023)明显相关,其余均无关。提示淋巴结转移越多,累积风险越高,无病生存时间和总生存时间越短,见图 2。
|
| 图 1 总体人群的无病生存(A)和总生存(B)Kaplan-Meier生存曲线 Figure 1 Disease free survival(A) and overall survival(B) Kaplan-Meier survival curves of included patients |
|
| 图 2 不同淋巴结状态(N)患者的无病生存(A)和总生存曲线(B) Figure 2 Disease free survival(A) and overall survival(B) Kaplan-Meier survival curves of included patients with different axillary lymph node status |
男性乳腺癌发病率较低,只占乳腺癌的1%左右。发病年龄一般较女性乳腺癌晚5~10年,欧美发病高峰年龄为68~71岁[6],中东和东亚地区相对较早,印度57~62岁[7],日本63岁[8]。我国女性乳腺癌(female breast cancer, FBC)的发病年龄在45~54岁[9],本研究男性乳腺癌中位年龄为58岁,发病较女性乳腺癌迟5~8年。男性乳腺癌未引起足够重视,没有及时进行乳腺常规检查,导致延迟就诊。因男性乳腺腺体较少,多集中在乳晕区,就诊时多表现为中央区肿块,若重视一般能早期触及就诊,本研究0~Ⅱ期患者占75.0%,较女性乳腺癌易早期发现。同时因缺乏足够的屏障,也易出现淋巴结转移,本研究淋巴结累及率44.1%(67/152),其中4个以上淋巴结累及率达50.7%(34/67)。
传统观念认为根治术是男性乳腺癌的主要手术方式[6],切除全乳、胸大小肌及腋窝淋巴结。随着女性乳腺癌患者保乳率的增加及临床研究的深入[10],认为若不侵及胸肌,行保留胸大小肌的改良根治术可获得与根治术类似的总生存和局部控制率[11]。近年来,前哨淋巴结在女性乳腺癌中广泛开展,使用SLN技术替代ALND可减少上肢水肿等并发症,提高生活质量,2003年Albo等提出男性乳腺癌行SLN替代ALND也是安全的[12],Fentiman等[13]总结了美国2006—2014年6项男性乳腺癌行SLN的研究结果,单用美兰或联合核素行SLN,符合率达90%~100%,认为临床是可行的。本研究2014—2018年共19例患者行SLN,前期因对男性SLN假阴性高的顾虑,若SLN阴性研究前期仍行ALND,随诊经验的累积,后期逐步替代ALND,也证明了SLN在男性乳腺癌中的安全性,减少了因ALND引起的上肢水肿及功能障碍。男乳体积小,外观美学要求没有女性高,故保乳比例低[14],本研究只有3例(2.0%)行保乳术,没有Ⅰ期重建术病例。
对于局部晚期男性乳腺癌也可行新辅助治疗,包括新辅助化疗和新辅助内分泌治疗,新辅助内分泌因起效慢并没有广泛开展,但是对于高龄无法耐受化疗者可考虑应用。本研究1例新辅助内分泌患者即80岁局部晚期患者,新辅助治疗后得到了有效的根治性手术。新辅助治疗总体有效率(SD+PR+CR)达87%。新辅助及辅助化疗方案均参照女性乳腺癌推荐方案。高危者常规给予辅助化疗[15],但男性乳腺癌发病年龄大,伴随疾病多,对化疗耐受性差。术后放疗标准亦参照女性乳腺癌治疗。
本研究男性乳腺癌ER阳性率高达93.9%。内分泌治疗在男性乳腺癌治疗中占重要地位,也是唯一有别于女性乳腺癌治疗的手段。目前他莫昔芬仍是男性乳腺癌标准的内分泌治疗手段[16],它作为一线药物的地位持续至今,治疗时间为5~10年。一部分观点认为男性乳腺癌治疗类似于绝经后乳腺癌,可常规应用芳香化酶抑制剂,但研究有限[17]。男性体内雌激素80%来自睾丸、肾上腺等产生的雌激素的芳香化,余20%直接来自睾丸,由于反馈机制的存在,芳香化酶抑制剂的应用可能导致黄体生成素、卵泡刺激素增加,继而增加芳香化作用,故单一应用芳香化酶抑制剂可能是不够的,联合戈舍瑞林等药物去势可能或获得更好的效果[18]。本研究132例(86.8%)应用他莫昔芬,5例(3.3%)应用芳香化酶抑制剂,8例(5.3%)给予戈舍瑞林+芳香化酶抑制剂。5例单纯给予芳香化酶抑制剂可能欠妥。男性乳腺癌中HER2阳性比例低,若阳性则常规给予靶向,即曲妥珠单抗治疗。本研究中HER2阳性者11例(7.2%),因经济等原因,只有4例行曲妥珠单抗治疗。至于是否可联合帕妥珠单抗行双靶治疗,目前尚缺乏相关研究。
以往研究认为,男性乳腺癌预后较女性乳腺癌差。但男性乳腺癌发病年龄普遍晚女性乳腺癌8~10岁,若按年龄进行队列分析,也有研究者认为[19]男性乳腺癌与女性乳腺癌预后相当。本研究结果5年总生存率为82.4%,5年无病生存率为69.9%,略高于日本报道的5年总生存率(71.1%)[8],原因在于本研究研究对象对非转移性男性乳腺癌。随访发现同侧胸壁复发2例,同侧腋窝复发4例,远处转移以肺转移多见(9例),其次为骨转移(6例)。对年龄、肿瘤大小、淋巴结状态、HR/HER2状态进行单因素生存分析,提示淋巴结转移越多,累积风险越高,无病生存时间和总生存时间越短(P < 0.05)。提示淋巴结状态是男性乳腺癌独立的预后因素。
本研究样本量少,时间跨度大,治疗中也存在一定的缺陷。男性乳腺癌总体发病率低,目前仍没有前瞻性随机研究,期望通过对本中心的男性乳腺癌诊治经验及生存情况的总结和分析,给男性乳腺癌的治疗提供一定的参考。
作者贡献
莫文菊:资料收集、数据分析及文稿撰写
丁小文:数据分析
郭振英:病理资料复核
赵帅、丁雨钦:资料收集
陈益定:数据分析和指导论文撰写
| [1] |
Anderson WF, Jatoi I, Tse J, et al. Male breast cancer: a population-based comparison with female breast cancer[J]. J Clin Oncol, 2010, 28(2): 232-239. DOI:10.1200/JCO.2009.23.8162 |
| [2] |
Vermeulen MA, Slaets L, Cardoso F, et al. Pathological characterisation of male breast cancer: Results of the EORTC 10085/TBCRC/BIG/NABCG International Male Breast Cancer Program[J]. Eur J Cancer, 2017, 82: 219-227. DOI:10.1016/j.ejca.2017.01.034 |
| [3] |
Giordano SH. Breast Cancer in Men[J]. N Engl J Med, 2018, 378(24): 2311-2320. DOI:10.1056/NEJMra1707939 |
| [4] |
Gucalp A, Traina TA, Eisner JR, et al. Male breast cancer: a disease distinct from female breast cancer[J]. Breast Cancer Res Treat, 2019, 173(1): 37-48. |
| [5] |
Hammond ME, Hayes DF, Dowsett M, et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer (unabridged version)[J]. Arch Pathol Lab Med, 2010, 134(7): e48-e72. |
| [6] |
Johansen Taber KA, Morisy LR, Osbahr AJ 3rd, et al. Male breast cancer: risk factors, diagnosis, and management (Review)[J]. Oncol Rep, 2010, 24(5): 1115-1120. |
| [7] |
Ram D, Rajappa SK, Selvakumar VP, et al. Male breast cancer: A retrospective review of clinical profile from a tertiary cancer care center of India[J]. South Asian J Cancer, 2017, 6(4): 141-143. DOI:10.4103/sajc.sajc_2_17 |
| [8] |
Ioka A, Tsukuma H, Ajiki W, et al. Survival of male breast cancer patients: a population-based study in Osaka, Japan[J]. Jpn J Clin Oncol, 2006, 36(11): 699-703. DOI:10.1093/jjco/hyl095 |
| [9] |
Fan L, Strasser-Weippl K, Li JJ, et al. Breast cancer in China[J]. Lancet Oncol, 2014, 15(7): e279-289. DOI:10.1016/S1470-2045(13)70567-9 |
| [10] |
Abd-Elhay FA, Elhusseiny KM, Kamel MG, et al. Negative Lymph Node Count and Lymph Node Ratio Are Associated With Survival in Male Breast Cancer[J]. Clin Breast Cancer, 2018, 18(6): e1293-e1310. DOI:10.1016/j.clbc.2018.07.003 |
| [11] |
Zhou FF, Xia LP, Guo GF, et al. Changes in therapeutic strategies in Chinese male patients with breast cancer: 40 years of experience in a single institute[J]. Breast, 2010, 19(6): 450-455. DOI:10.1016/j.breast.2010.04.007 |
| [12] |
Maráz R, Boross G, Pap-Szekeres J, et al. The role of sentinel node biopsy in male breast cancer[J]. Breast Cancer, 2016, 23(1): 85-91. |
| [13] |
Fentiman IS. Surgical options for male breast cancer[J]. Breast Cancer Res Treat, 2018, 172(3): 539-544. DOI:10.1007/s10549-018-4952-2 |
| [14] |
Zaenger D, Rabatic BM, Dasher B, et al. Is Breast Conserving Therapy a Safe Modality for Early-Stage Male Breast Cancer?[J]. Clin Breast Cancer, 2016, 16(2): 101-104. |
| [15] |
Walshe JM, Berman AW, Vatas U, et al. A prospective study of adjuvant CMF in males with node positive breast cancer: 20-year follow-up[J]. Breast Cancer Res Treat, 2007, 103(2): 177-183. |
| [16] |
Eggemann H, Ignatov A, Smith BJ, et al. Adjuvant therapy with tamoxifen compared to aromatase inhibitors for 257 male breast cancer patients[J]. Breast Cancer Res Treat, 2013, 137(2): 465-470. |
| [17] |
Kuba S, Ishida M, Oikawa M, et al. Aromatase inhibitors with or without luteinizing hormone-releasing hormone agonist for metastatic male breast cancer: report of four cases and review of the literature[J]. Breast Cancer, 2016, 23(6): 945-949. DOI:10.1007/s12282-016-0679-2 |
| [18] |
Zagouri F, Sergentanis TN, Azim HA Jr, et al. Aromatase inhibitors in male breast cancer: a pooled analysis[J]. Breast Cancer Res Treat, 2015, 151(1): 141-147. |
| [19] |
Sun W, Cheng M, Zhou H, et al. Nomogram Predicting Cause-Specific Mortality in Nonmetastatic Male Breast Cancer: A Competing Risk Analysis[J]. J Cancer, 2019, 10(3): 583-593. DOI:10.7150/jca.28991 |
 2020, Vol. 47
2020, Vol. 47