文章信息
- PD-1/PD-L1抑制剂在恶性黑色素瘤(新)辅助治疗中的研究进展
- Research Progress of PD-1/PD-L1 Checkpoint Inhibitors in (Neo) Adjuvant Therapy for Malignant Melanoma
- 肿瘤防治研究, 2020, 47(2): 141-146
- Cancer Research on Prevention and Treatment, 2020, 47(2): 141-146
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.0945
- 收稿日期: 2019-07-24
- 修回日期: 2019-11-25
恶性黑色素瘤(malignant melanoma, MM)是临床上第三常见的皮肤恶性肿瘤,具有较高的发病率及死亡率;2017年美国约有8.7万新发病例,1万例死亡病例[1]。我国的恶性黑色素瘤年增长率约为3%~5%,每年约有2万新发病例[2]。早期恶性黑色素瘤可通过外科切除的方式治愈并获得较长的生存,中晚期黑色素瘤患者单纯手术切除的效果并不好。肿瘤厚度大于4 mm(T4N0M0, AJCC分期ⅡB~C期),或有区域淋巴结转移或途中转移(T1-4N1-3M0,AJCC分期Ⅲ期)的患者即便接受了完整的外科切除也会有60%~75%的复发率,5年生存率仅为30%~70%[3-4]。这些患者迫切需要在手术后接受辅助治疗来降低复发或死亡的风险。
1 恶性黑色素瘤(新)辅助治疗现状在上世纪90年代前的很长时间里,达卡巴嗪(Dacarbazine, DTIC)及替莫唑胺(Temozolomide, MTIC)化疗是治疗转移性恶性黑色素瘤的标准治疗方案,然而有效反应率仅13.4%,中位生存时间5.6~11月[5]。在一项1982年的研究中,Ⅱ期与Ⅲ期黑色素瘤患者术后辅助达卡巴嗪化疗与观察组进行对比,发现3年生存率并没有改善[6]。由于没有证据表明达卡巴嗪或替莫唑胺术后辅助化疗能改善中晚期黑色素瘤患者的生存预后,因此并没有进一步相关研究。
1995年,由ECOG(Eastern Cooperative Oncology Group)依据一项大型随机对照试验E1684的结果首次将大剂量干扰素-α(interferon-α, IFN-α)推荐为中晚期黑色素瘤的辅助治疗。E1684试验共纳入了280名样本,研究结果发现IFN-α能显著改善中期黑色素瘤患者的无复发生存率(relapse-free survival, RFS)和总生存率(overall survival, OS)[7]。尽管后续许多大型随机对照研究和Meta分析都表明IFN-α无法提高患者的无远处转移生存率(distance metastasis free survival, DMFS)和总生存率[8-10],并且IFN-α存在严重的剂量-毒性相关不良反应[11-12],直到目前大剂量IFN-α术后辅助治疗仍是临床治疗ⅡB~Ⅲ期黑色素瘤的主要手段。2015年,一种新型CTLA-4(细胞毒性T淋巴细胞相关抗原4)抗体Ipilimumab获批用于黑色素瘤的术后辅助治疗。CTLA-4是一种抑制性免疫相关抗原,当其与抗原呈递细胞(antigen-presenting cell, APC)结合后会抑制T细胞的活性并降低宿主的自身免疫反应。Ipilimumab通过与CTLA-4的结合从而阻断其与配体(CD80/CD86)的相互作用,从而促进T细胞的活化与增殖[13]。在一项Ⅲ期临床研究中(EORTC-18071),Ipilimumab用于ⅢA~C期黑色素瘤术后辅助治疗与安慰剂组进行对比,结果显示Ipilimumab组的5年无复发生存率和5年总生存率与安慰剂组相比都有显著提高[14]。然而值得注意的是Ipilimumab组3~4级不良反应发生率高达54.1%,因不良反应治疗中断的比例为49%,严重的不良反应包括胃肠道、肝脏以及内分泌反应[15]。正因为Ipilimumab严重的不良反应发生率限制了其在临床上的应用,因此亟需研究新的辅助治疗手段。PD-1/PD-L1信号通路是参与肿瘤免疫逃逸的重要途径,针对该通路的抗体近些年已经在治疗晚期恶性黑色素瘤中表现出不俗的成绩,最具代表的包括Pembrolizumab、nivolumab、Atezolizumab等多种PD-1/PD-L1抑制剂已经进行了多项针对Ⅱ/Ⅲ期可切除的高危恶性黑色素瘤患者的(新)辅助治疗的临床研究。
2 PD-1/PD-L1信号通路与PD-1/PD-L1抑制剂程序性死亡受体-1/程序性死亡配体-1(programmed death-1/programmed death-ligand 1, PD-1/PD-L1)于1992年由Ishida等正式提出,最初是在凋亡的T细胞杂交瘤中得到,一种广泛存在于活化的T淋巴细胞、B淋巴细胞和巨噬细胞表面的受体,由于其与细胞凋亡相关而得名。PD-1是免疫球蛋白B7-CD28家族成员之一,由268个氨基酸组成的Ⅰ型跨膜蛋白,包含跨膜、胞质以及IgG V类似三个结构域[16]。PD-1包括两个配体:PD-L1(B7-H1, CD274)和PD-L2(B7-DC, CD273),PD-L1是PD-1的主要配体,在PD-1与PD-L1结合后,PD-1中的ITSM结构域发生磷酸化并募集蛋白络氨酸磷酸酶SHP-2,使下游的脾络氨酸激酶(spleen tyrosine kinase, SyK)和磷脂酰肌醇3-激酶(phosphoinositide3-kinase, PI3K)发生去极化,可抑制葡萄糖的消耗、细胞因子的产生和T细胞生存,从而抑制抗原细胞[17]。另外,PD-1与PD-L1结合可抑制多种细胞因子(IFN-γ、IL-2和TNF-α)的产生,通过抑制存活因子Bcl-xl促进T细胞凋亡[18]。恶性黑色素瘤发生时,其细胞高表达的PD-L1与T细胞表面的PD-1结合后,介导负反馈调节,下调或抑制T细胞功能,从而抑制肿瘤的免疫应答,导致肿瘤细胞发生免疫逃逸[19]。
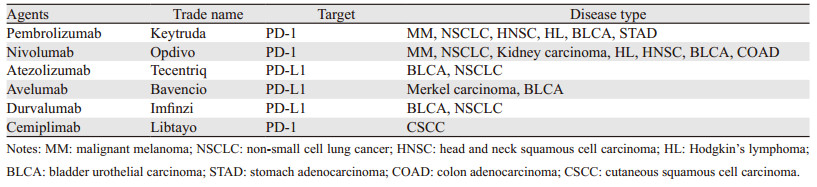
PD-1/PD-L1抑制剂的根本目的在于阻断PD-1与PD/L1的结合,阻断负向调控机制,重新激活T细胞对肿瘤的免疫应答效应从而达到抗肿瘤的作用。2014年美国食品及药物管理局先后批准了PD-1抑制剂Nivolumab(OPDIVO, BMS)和Pembrolizumab(Keytruda, MSD)用于晚期不可切除或转移性恶性黑色素瘤的治疗。短短几年内,FDA批准了包括Atezolizumab(Tecentriq)、Avelumab(Bavencio)、Durvalumab(Imfinzi)在内的6种PD-1/PD-L1抑制剂上市并用于黑色素瘤、非小细胞肺癌、膀胱上皮癌、淋巴瘤等实体肿瘤的治疗及临床研究,见表 1。一项Ⅲ期临床研究CheckMate 066[20]共招募418名未经治疗的BRAF野生型晚期恶性黑色素瘤患者,比较Nivo- lumab(3 mg/kg, 每2周一次)与传统化疗药物达卡巴嗪(1 000 mg/m2, 每3周一次)的疗效与安全性,结果显示Nivolumab组中位PFS(5.1月vs. 2.2月,HR=0.43)、1年生存率(72.9% vs. 42.1%, HR=0.42)以及客观缓解率(40% vs. 13.9%, OR=4.06)都显著优于达卡巴嗪组,同时3~4级不良反应发生率(11.7% vs.17.6%)更低。另一项针对Pembrolizumab的Ⅱ期随机对照临床研究KEYNOTE-002[21]共纳入了540例晚期Ipilimumab耐药黑色素瘤患者,随机分为Pembrolizumab 2 mg/kg,每3周一次或Pembrolizumab 10 mg/kg,每3周一次及传统化疗组,中位随访时间28月,结果显示与传统化疗组相比Pembrolizumab组虽然没有总生存时间的显著延长,但无进展生存期和客观缓解率等都有显著提高。PFS分别为34%(Pembrolizumab 2 mg/kg, HR=0.57)、38%(Pembrolizumab 10 mg/kg, HR=0.50)和16%(化疗组)。同时3~4级不良反应发生率也更低(13.5% vs. 16.8% vs. 26.3%)。在另一项Ⅲ期随机对照KEYNOTE-006[22]研究中,Pembrolizumab(10 mg/kg,每2周一次或每3周一次)与Ipilimumab对照组晚期黑色素瘤患者的PFS和OS均有显著提高。
|
PD-L1抑制剂也在一些早期临床研究中显示出抗肿瘤活性。一项2012年的Ⅰ期临床研究中,207例晚期实体肿瘤患者(包括55例黑色素瘤患者)接受了PD-L1抑制剂(BMS-936559)的治疗,结果显示在52例可进行评估的黑色素瘤患者中,客观缓解率为17.3%,其中有3例患者达到了完全缓解。全部患者中39%发生了治疗相关的不良反应,其中3~4级不良反应发生率为9%[25]。
PD-L1抑制剂在黑色素瘤辅助治疗中的应用正处于起步阶段,目前唯一一项正在进行的Ⅱ期临床试验是Atezolizumab联合cobimetinib(考比替尼)±vemurafenib(维莫非尼)在高危Ⅲ期黑色素瘤患者术前新辅助治疗的研究(NCT03554083)。研究共计划纳入30名Ⅲ期高危黑色素瘤患者,A组(BRAF突变组)术前接受vemurafenib+cobimetinib+Atezolizumab 联合化疗3周期,术后继续Atezolizumab 辅助治疗8周期;B组(BRAF野生型组)术前接受cobimetinib+Atezolizumab 联合化疗3周期,术后同样接受Atezolizumab 辅助治疗8周期。主要研究目标为两组的病理缓解率以及无复发生存时间。研究预计将于2023年结束。
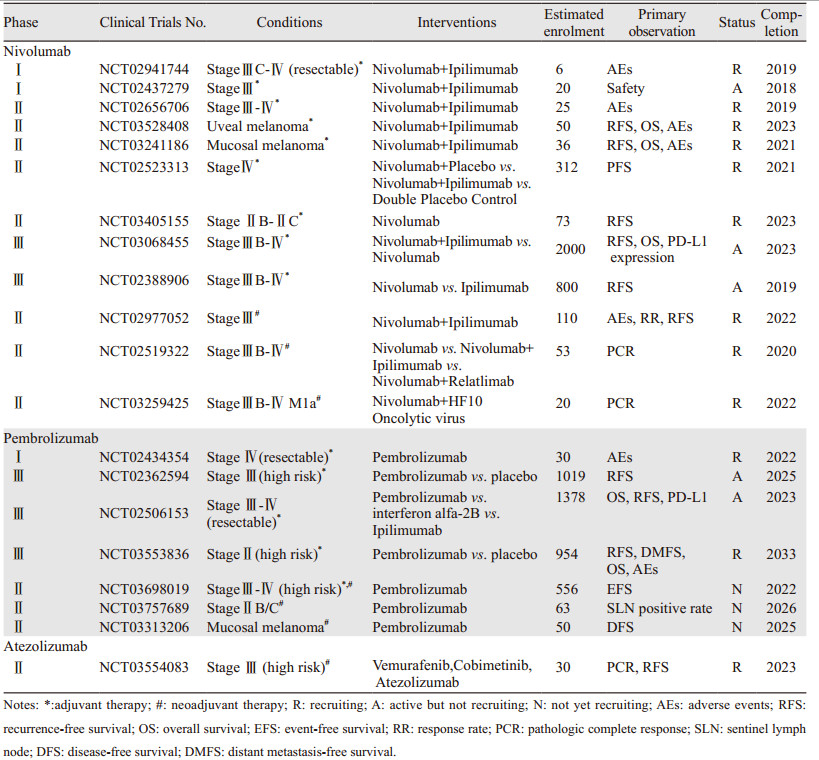
4 PD-1/PD-L1抑制剂在黑色素瘤(新)辅助治疗中的研究PD-1/PD-L1抑制剂在治疗晚期恶性黑色素瘤展现出确切的疗效,从2015年开始,数十项针对可切除黑色素瘤患者(新)辅助治疗的Ⅱ/Ⅲ期临床研究陆续开展,见表 2。
|
抗PD-1抑制剂Nivolumab(OPDIVO,BMS-936558, ONO-4538, MDX-1106)是全人源化免疫球蛋白G4蛋白单克隆单克隆抗体,最早开展于2015年3月的CheckMate-238[23]临床研究为随机对照双盲Ⅲ期临床试验,对比Nivolumab(3 mg/kg,每2周一次)与Ipilimumab组(10 mg/kg,每3周一次,4周期)在可切除的ⅢB/C期或Ⅳ期黑色素瘤术后辅助治疗中的疗效。研究共纳入了906名患者,按1:1进行配对,结果显示Nivolumab组的12月无复发生存率RFS为70.5%(95%CI 66.1~74.5),Ipilimumab组为60.8%(95%CI 56.0~65.2),风险比HR=0.65(97.56% CI 0.51~0.83),P < 0.001。分层研究后发现,在PD-L1表达水平 < 5%的患者中,Nivolumab组和Ipilimumab组无复发生存率(RFS)分别为64.3%和53.7%,HR=0.71(95%CI 0.56~0.91);在PD-L1表达水平 > 5%的患者中,Nivolumab组和Ipilimumab组RFS分别为81.9%和73.8%,HR=0.5(95%CI: 0.32~0.78)。3~4级不良反应发生率Nivolumab组为14.4% vs.Ipilimumab组45.9%,因为不良事件导致的治疗中断率Nivolumab组为9.7% vs.Ipilimumab组为42.6%。Ipilimumab组有2例因药物不良反应死亡的案例。在另一项Ⅱ期临床试验BrUOG-324中,研究者观察25例Ⅲ/Ⅳ期可切除的黑色素瘤患者接受Nivolumab(3 mg/kg,每2周一次)加小剂量Ipilimumab(1 mg/kg,每6周一次)术后辅助治疗的不良反应和RFS,初步的结论发现3~4级化疗相关不良反应发生率为35%(NCT02656706)。去年,一项大型随机、对照、双盲、多中心的Ⅲ期临床研究研究已经启动(CheckMate 915),研究计划纳入2 000名完全切除原发病灶的ⅢB~Ⅳ期恶性黑色素瘤患者,对比Nivolumab联合Ipilimumab与Nivolumab单用的疗效评估,主要研究终点为RFS,次要研究终点为OS和PD-L1的表达情况,研究预计将在2020年结束(NCT03068455)。此外,还有多项Nivolumab单药或联合Ipilimumab等其他药物的Ⅱ/Ⅲ期临床研究正在进行,见表 2。
Nivolumab在黑色素瘤新辅助治疗的研究也正在进行。一项随机、开放Ⅱ期临床研究中,53例ⅢB/C期或Ⅳ期(寡转移)的黑色素瘤患者被分为3组,第一组接受Nivolumab,3 mg/kg,每2周一次,共4周期,第二组接受Nivolumab,1 mg/kg以及Ipilimumab,3 mg/kg,每3周一次,3周期,第三组接受Nivolumab,480 mg及Relatlimab,160 mg,每4周一次,2周期,三组患者均在第8周接受手术。术后,前两组患者继续Nivolumab 3 mg/kg,每2周一次,12周期,第三组Nivolumab 480 mg及Relatlimab 160 mg,每4周一次,10周期,直到疾病进展或出现不可耐受的药物毒性。研究的主要终点为患者接受新辅助治疗后出现病理改变的比例,研究的次要终点为客观有效率(OR)、RFS、OS。研究的结果预计将在2019年公布(NCT02519322)。
4.2 PembrolizumabPembrolizumab(Keytruda,MK-3475, lambrolizumab)是美国默沙东公司生产的人源IgG4-kappa单克隆抗体,是首个被FDA批准上市的PD-1靶向治疗药物。在最早开始于2015年的大型随机双盲对照Ⅲ期临床试验KEYNOTE-054[24](NCT02362594)中,1 019例Ⅲ期术后黑色素瘤患者被随机分为Pembrolizumab组(514例)和安慰剂组(505例),其中Pembrolizumab组有5例退出,最终509例接受治疗,安慰剂组有3例退出,最终502例接受治疗,Pembrolizumab组接受200 mg,每3周一次,持续1年直到肿瘤复发或出现无法耐受的不良反应。初步的结果显示,中位随访时间15月,Pembrolizumab组和安慰剂组的1年RFS分别为75.4%(95%CI 71.3~78.9)vs. 61.0%(95%CI 56.5~65.1),HR=0.57(98.4%CI 0.43~0.74, P < 0.001)。在亚组分析中PD-L1表达阳性的患者共853例,Pembrolizumab组和安慰剂组的1年RFS分别77.1%(95%CI 72.7~80.9)vs. 62.6%(95%CI 57.7~67.0),HR=0.54(95%CI 0.42~0.69, P < 0.001)。3~5级不良反应发生率Pembrolizumab组为14.7%,安慰剂组为3.4%[24]。Pembrolizumab与大剂量干扰时和Ipilimumab的比较也正在进行,一项由美国国家癌症研究所(NCI)发起的大型随机对照双盲Ⅲ期临床研究中,共招募了1 378名Ⅲ~Ⅳ期皮肤黑色素瘤患者,在术后分别接受大剂量干扰素alfa-2B、Ipilimumab以及Pembrolizumab的治疗,主要研究OS、RFS及PD-L1表达的差异。研究预计将于2023年给出结论(NCT02506153)。在这些试验的基础上,另一项随机双盲对照Ⅲ期临床研究KEYNOTE-716(NCT03553836)也开始了招募工作,研究主要针对ⅡB/C期高危术后黑色素瘤患者,计划招募954名患者,试验分为2部分,第一部分Pembrolizumab组接受最多17周期200 mg Pembrolizumab的注射治疗,每3周1次,同时安慰剂组接受最多17周期的0.9%氯化钠溶液注射治疗,直到疾病复发或出现不可耐受的不良反应。第二部分试验,两组中接受了全部17周期并且出现肿瘤复发或转移的患者,若为局部或远处复发,则在二次术后接受至多17周期的Pembrolizumab治疗(200 mg,静脉注射,每3周一次),若为远处转移或不能手术切除的,则直接接受至多34周期的Pembrolizumab治疗。主要研究目标为各组的RFS、DMFS、OS、不良事件(AEs)。研究预计将于2022年公布结果(NCT03553836)。
Pembrolizumab[24]在黑色素瘤术前新辅助治疗的研究大都处于Ⅱ期临床试验阶段,2018年12月,NCI发起一项Ⅱ期临床试验,旨在对比在Ⅲ~Ⅳ期可切除高危黑色素瘤患者中,单独接受术后Pembrolizumab辅助治疗18周期与术前先接受3周期Pembrolizumab新辅助治疗,术后再接受15周期Pembrolizumab辅助治疗的无事件生存(EFS)、总生存时间、疾病控制率、局部复发率、病理缓解率之间的差异。研究计划纳入556名黑色素瘤患者,预计将在2022年初步得出结论(NCT03698019)。
5 总结与展望中晚期恶性黑色素瘤单纯手术治疗的效果并不理想,由于缺乏有效的辅助治疗手段,部分患者会在短期内复发或转移。近些年来随着多种PD-1/PD-L1抑制剂在晚期恶性黑色素瘤治疗中表现出确切的疗效,与之相关的(新)辅助治疗的研究也陆续开展起来。目前主要的研究方向集中在PD-1抑制剂单药或联合Ipilimumab用于ⅡB~Ⅲ期高危黑色素瘤的术(前)后(新)辅助治疗。尽管许多Ⅲ期临床试验还在进行中,但从目前的结果PD-1抑制剂用于中晚期可切除的黑色素瘤术后辅助治疗能够显著延长患者的RFS,并且3~4级不良反应发生率与Ipilimumab相比更低[23]。PD-L1表达水平高的患者更有可能从PD-1抑制剂的辅助治疗中获益,PD-L1的表达水平也许是一种潜在的预测治疗反应的生物学指标。
在今后的研究中,我们在关注RFS与OS的同时,也要考虑到PD-1/PD-L1抑制剂潜在的不良反应以及对生活质量(QSL)的影响。并且由于辅助治疗并没有合适病灶进行疗效评估,加之高昂的治疗费用,找到合适的生物学标志进行筛选,为合适的患者选择合适的治疗方案也是后续研究的重点。总而言之,PD-1/PD-L1抑制剂的出现为黑色素瘤的治疗带来了新的选择与挑战。我们希望PD-1/PD-L1抑制剂在高危黑色素瘤(新)辅助治疗中也能起到关键的作用,通过相关临床研究为外科医生提供准确的治疗方案,提高患者生存质量,改善疾病预后。
作者贡献
邹瀚辉:资料收集、数据整理、撰写
李涛:思路提供及审核
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7-30. |
| [2] |
Guo J, Qin S, Liang J, et al. Chinese Guidelines on the Diagnosis and Treatment of Melanoma (2015 Edition)[J]. Chin Clin Oncol, 2016, 5(4): 57. DOI:10.21037/cco.2015.12.02 |
| [3] |
Keung EZ, Gershenwald JE. The eighth edition American Joint Committee on Cancer (AJCC) melanoma staging system: implications for melanoma treatment and care[J]. Expert Rev Anticancer Ther, 2018, 18(8): 775-784. DOI:10.1080/14737140.2018.1489246 |
| [4] |
Enninga EAL, Moser JC, Weaver AL, et al. Survival of cutaneous melanoma based on sex, age, and stage in the United States, 1992-2011[J]. Cancer Med, 2017, 6(10): 2203-2212. DOI:10.1002/cam4.1152 |
| [5] |
Yang AS, Chapman PB. The history and future of chemotherapy for melanoma[J]. Hematol Oncol Clin North Am, 2009, 23(3): 583-597. DOI:10.1016/j.hoc.2009.03.006 |
| [6] |
Veronesi U, Adamus J, Aubert C, et al. A randomized trial of adjuvant chemotherapy and immunotherapy in cutaneous melanoma[J]. N Engl J Med, 1982, 307(15): 913-916. DOI:10.1056/NEJM198210073071503 |
| [7] |
Kirkwood JM, Strawderman MH, Ernstoff MS, et al. Interferon alfa-2b adjuvant therapy of high-risk resected cutaneous melanoma: the Eastern Cooperative Oncology Group Trial EST 1684[J]. J Clin Oncol, 1996, 14(1): 7-17. DOI:10.1200/JCO.1996.14.1.7 |
| [8] |
Eggermont AM, Suciu S, MacKie R, et al. Post-surgery adjuvant therapy with intermediate doses of interferon alfa 2b versus observation in patients with stage Ⅱb/Ⅲ melanoma (EORTC 18952): randomised controlled trial[J]. Lancet, 2005, 366(9492): 1189-1196. DOI:10.1016/S0140-6736(05)67482-X |
| [9] |
Hauschild A, Weichenthal M, Balda BR, et al. Prospective randomized trial of interferon alfa-2b and interleukin-2 as adjuvant treatment for resected intermediate- and high-risk primary melanoma without clinically detectable node metastasis[J]. J Clin Oncol, 2003, 21(15): 2883-2888. DOI:10.1200/JCO.2003.07.116 |
| [10] |
Agha A, Tarhini AA. Adjuvant Therapy for Melanoma[J]. Curr Oncol Rep, 2017, 19(5): 36. DOI:10.1007/s11912-017-0594-5 |
| [11] |
Chiarion-Sileni V, Del Bianco P, Romanini A, et al. Tolerability of intensified intravenous interferon alfa-2b versus the ECOG 1684 schedule as adjuvant therapy for stage Ⅲ melanoma: a randomized phase Ⅲ Italian Melanoma Inter-group trial (IMI - Mel.A.)[ISRCTN75125874][J]. BMC Cancer, 2006, 6: 44. DOI:10.1186/1471-2407-6-44 |
| [12] |
Mohr P, Hauschild A, Trefzer U, et al. Quality of life in patients receiving high-dose interferon alfa-2b after resected high-risk melanoma[J]. J Clin Oncol, 2009, 27(24): e70; author reply e71.
|
| [13] |
Hao C, Tian J, Liu H, et al. Efficacy and safety of anti-PD-1 and anti-PD-1 combined with anti-CTLA-4 immunotherapy to advanced melanoma: A systematic review and meta-analysis of randomized controlled trials[J]. Medicine (Baltimore), 2017, 96(26): e7325. DOI:10.1097/MD.0000000000007325 |
| [14] |
Eggermont AM, Chiarion-Sileni V, Grob JJ, et al. Prolonged Survival in Stage Ⅲ Melanoma with Ipilimumab Adjuvant Therapy[J]. N Engl J Med, 2016, 375(19): 1845-1855. DOI:10.1056/NEJMoa1611299 |
| [15] |
Eggermont AM, Chiarion-Sileni V, Grob JJ, et al. Adjuvant ipilimumab versus placebo after complete resection of high-risk stage Ⅲ melanoma (EORTC 18071): a randomised, double-blind, phase 3 trial[J]. Lancet Oncol, 2015, 16(5): 522-530. DOI:10.1016/S1470-2045(15)70122-1 |
| [16] |
Muenst S, Soysal SD, Tzankov A, et al. The PD-1/PD-L1 pathway: biological background and clinical relevance of an emerging treatment target in immunotherapy[J]. Expert Opin Ther Targets, 2015, 19(2): 201-211. DOI:10.1517/14728222.2014.980235 |
| [17] |
Rotte A, Jin JY, Lemaire V. Mechanistic overview of immune checkpoints to support the rational design of their combinations in cancer immunotherapy[J]. Ann Oncol, 2018, 29(1): 71-83. DOI:10.1093/annonc/mdx686 |
| [18] |
Cha JH, Chan LC, Li CW, et al. Mechanisms Controlling PD-L1 Expression in Cancer[J]. Mol Cell, 2019, 76(3): 359-370. DOI:10.1016/j.molcel.2019.09.030 |
| [19] |
Kyi C, Postow MA. Checkpoint blocking antibodies in cancer immunotherapy[J]. FEBS Lett, 2014, 588(2): 368-376. DOI:10.1016/j.febslet.2013.10.015 |
| [20] |
Robert C, Long GV, Brady B, et al. Nivolumab in previously untreated melanoma without BRAF mutation[J]. N Engl J Med, 2015, 372(4): 320-330. DOI:10.1056/NEJMoa1412082 |
| [21] |
Hamid O, Puzanov I, Dummer R, et al. Final analysis of a randomised trial comparing pembrolizumab versus investigator-choice chemotherapy for ipilimumab-refractory advanced melanoma[J]. Eur J Cancer, 2017, 86: 37-45. DOI:10.1016/j.ejca.2017.07.022 |
| [22] |
Petrella TM, Robert C, Richtig E, et al. Patient-reported outcomes in KEYNOTE-006, a randomised study of pembrolizumab versus ipilimumab in patients with advanced melanoma[J]. Eur J Cancer, 2017, 86: 115-124. DOI:10.1016/j.ejca.2017.08.032 |
| [23] |
Weber J, Mandala M, Del Vecchio M, et al. Adjuvant Nivolumab versus Ipilimumab in Resected Stage Ⅲ or Ⅳ Melanoma[J]. N Engl J Med, 2017, 377(19): 1824-1835. DOI:10.1056/NEJMoa1709030 |
| [24] |
Eggermont AMM, Blank CU, Mandala M, et al. Adjuvant Pembrolizumab versus Placebo in Resected Stage Ⅲ Melanoma[J]. N Engl J Med, 2018, 378(19): 1789-1801. DOI:10.1056/NEJMoa1802357 |
| [25] |
Brahmer JR, Tykodi SS, Chow LQ, et al. Safety and activity of anti-PD-L1 antibody in patients with advanced cancer[J]. N Engl J Med, 2012, 366(26): 2455-2465. DOI:10.1056/NEJMoa1200694 |
 2020, Vol. 47
2020, Vol. 47


