文章信息
- MiRNA let-7a对人喉鳞癌细胞增殖的抑制作用
- Inhibitory Effect of miRNA let-7a on Proliferation of Human Laryngeal Squamous Cell Carcinoma
- 肿瘤防治研究, 2020, 47(3): 159-163
- Cancer Research on Prevention and Treatment, 2020, 47(3): 159-163
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.0929
- 收稿日期: 2019-07-22
- 修回日期: 2019-12-25
2. 410005 长沙,湖南省人民医院,湖南省急救医学研究所,急危重症代谢组学湖南省重点实验室
2. Hu'nan Provincial Institute of Emergency Medicine, Hu'nan Provincial People's Hospital, Hu'nan Provincial Key Laboratory of Emergency and Critical Care Metabonomics, Changsha 410005, China
喉鳞状细胞癌为耳鼻喉科常见的恶性肿瘤,主要治疗手段为手术、放疗及辅助化疗等,但总体生存率不高[1]。探索喉癌发生、发展过程中的分子机制,寻找有效的分子标志物进行靶向诊断与治疗,提高喉癌患者的生存率是肿瘤基础与临床研究的重要内容。高迁移率族蛋白2(high-mobility group A2, HMGA2)为一种新的癌基因,在多种肿瘤中高表达,与肿瘤患者的预后紧密相关[2]。miRNA let-7a可与原癌基因c-MYC[3]、HMGA2[4]和RAS[5]等的3'非编码翻译区结合从而抑制靶基因的转录或翻译,进一步调控其表达。目前关于let-7a调控HMGA2在喉癌的发生及侵袭转移中的机制研究报道甚少,本课题组前期在人喉癌组织中的研究发现[6],let-7a和HMGA2与喉癌的增殖及侵袭转移关系紧密。本研究中,我们在细胞水平和体内试验证实let-7a通过负性调控HMGA2的表达从而影响喉癌细胞的增殖,为进一步研究喉癌的侵袭转移及分子靶向治疗提供新思路。
1 材料与方法 1.1 材料人喉鳞癌细胞株TU212购自中科院上海细胞所。BALB/C雄性裸鼠(4~6周龄,体质量10~20 g)18只,购自南京大学-南京生物医药研究院,饲养于湖南师范大学动物实验中心、恒温18℃~22℃、恒湿度(50%~80%)的SPF级环境。随机分为三组:空白对照组(blank control组)、let-7a NC组及let-7a mimics组,每组各6只。let-7a mimics由上海吉玛制药公司合成;转染试剂脂质体LipofectamineTM2000来自上海索宝生物科技有限公司;Ⅰ抗HMGA2兔抗人抗体、Ⅱ抗羊抗兔HRP(辣根过氧化物酶)抗体及内参β-actin均购自美国Proteintech公司;DMED培养液、胰酶、胎牛血清购自上海依科赛生物公司;实时荧光定量PCR二步法试剂盒及DAB试剂盒购自北京中杉金桥生物公司;反转录试剂盒及miRNA反转录试剂盒购自北京康为世纪生物公司;SYBGREEN PCR Mix购自美国Invitrogen公司。
1.2 细胞培养TU212细胞置于含10%胎牛血清、100 u/ml青霉素和100 mg/ml链霉素的RPMI 1640培养基中常规培养(37℃、5%CO2)。
1.3 细胞转染根据试剂盒说明书进行转染,采用阳离子脂质体LipofectamineTM2000转染细胞。对转染效率超过50%的细胞进行传代培养。
1.4 细胞增殖实验取培养好的细胞,三组均设4个复孔,MTT法检测细胞活力,分别在培养12、24、48、72 h于Bio-Tek酶标仪分析490 nm处吸光度(OD)值,取均值并绘制生长曲线。EdU增殖实验:接种空白对照、let-7a阴性对照(NC)和转染let-7a mimics的喉癌细胞TU212于24孔板中,每组细胞设置3个复孔,待细胞生长至对数生长期时加入50 μmol/L EdU试剂,培养2 h,4%多聚甲醛固定,0.25%Triton X破膜,Apollo染色和Hoechst染核,显微镜下拍照,并随机挑选显微镜下视野,计数200个细胞,记录EdU阳性细胞的比例,实验重复3次,并进行统计学分析。
1.5 建立荷瘤裸鼠动物模型分别取转染后生长良好的TU212细胞,抽取0.2 ml(含5×106个细胞)悬浮液对裸鼠进行右侧背部皮下注射,let-7a mimics组注射TU212-let-7a mimics细胞,let-7a NC组注射TU212-let-7a mimics NC细胞,空白对照组注射TU212细胞,建立人喉癌细胞裸鼠皮下移植瘤模型。自接种日起,每日观察并记录移植瘤发生时间、裸鼠的健康和成瘤情况。成瘤后根据公式V=ab2/2计算肿瘤体积,观察终点设为30天,绘制生长曲线图。第30 d处死各组裸鼠终止实验,切除瘤体电子秤称重,测量质量和大小,计算抑瘤率。抑瘤率(%)=(1-实验组平均瘤重/对照组平均瘤重)×100%。
1.6 实时荧光定量PCR检测HMGA2的mRNA和let-7a miRNA的表达按相关试剂盒说明书的步骤操作,以多聚A加尾法对目的基因进行反转录,反转录产物加入let-7a与U6、HMGA2与β-actin的基因引物及荧光染料,进行RT-qPCR反应。采用2-ΔΔCt法进行相对定量。U6的引物序列为5’-GCTTCGGCAGCACATATACTAAAAT-3;let-7a的引物序列为5’-CTATACAACCTACTGCCTTCCC-3’;HMGA2的上游引物序列为5’-CAGCCCAGGGACAACCT-3’,下游引物序列为5’-CTGCCTCTTGGCCGTTT-3’;β-actin的上游引物序列为5’- ATCCTGCGTCTGGACCTGG-3’,下游引物序列为5’-TAATGTCACGCACGATTTCC-3’。
1.7 Western blot法检测HMGA2蛋白的表达提取组织总蛋白,根据BCA蛋白定量试剂盒说明书操作测定蛋白浓度。Ⅰ抗HMGA2的稀释浓度为1:1 000,β-actin(稀释浓度1:4 000)为内参。
1.8 统计学方法采用SPSS23.0处理数据,计量资料用均数±标准差(x±s)表示,符合正态分布、方差齐性的资料采取方差分析,各组间比较采用SNK-q检验。检验水准α=0.05,P < 0.05为差异有统计学意义。
2 结果 2.1 let-7a抑制喉癌细胞TU212的增殖RT-qPCR检测结果显示,与空白对照组和let-7a NC组比,转染let-7a mimics的喉癌细胞中let-7a的表达水平显著增加,见图 1A,证实喉癌细胞中let-7a过表达成功。MTT实验结果提示,与空白对照组和let-7a NC组相比,在转染let-7a mimics后,喉癌TU212细胞的增殖能力受到抑制,72 h时增殖能力显著降低(P=0.023),见图 1B,提示上调let-7a的表达可抑制喉癌TU212细胞的生长。

|
| *: P=0.023, **: P < 0.001, compared with blank control group or let-7a NC group. 图 1 let-7a在喉癌细胞的表达及在EdU细胞增殖实验中的增殖情况 Figure 1 Expression of let-7a miRNA in laryngeal carcinoma cells and its proliferation in EdU cell proliferation experiment |
采用EdU细胞增殖实验检测了空白对照组、let-7a NC组和let-7a mimics组中的S期细胞的比例,见图 1C~D,过表达let-7a的喉癌细胞TU212相对于空白对照组和let-7a NC组,S期细胞数的比例明显减少,进一步证实let-7a抑制喉癌细胞TU212的增殖。
2.2 let-7a下调TU212细胞中HMGA2的表达空白对照组、let-7a NC组和let-7a mimics组HMGA2 mRNA相对表达量分别为1.274±0.055、1.289±0.051、0.624±0.087;提示在TU212细胞中过表达let-7a可降低HMGA2的转录水平,见图 2A。Western blot实验结果同样证实与空白对照组和let-7a NC组相比,let-7a异常表达的TU212细胞中HMGA2的蛋白表达降低,见图 2B~C。

|
| **: P < 0.001, compared with blank control group or let-7a NC group; 1: Blank control; 2: let-7a NC; 3: let-7a mimics. 图 2 HMGA2在喉癌细胞中的表达情况 Figure 2 HMGA2 expression in laryngeal carcinoma cells |
空白对照组、let-7a NC组、let-7a mimics组TU212细胞成瘤体积,见图 3A~B,相对于空白对照组和let-7a NC组,let-7a过表达的TU212细胞的成瘤组织体积明显降低,提示let-7a抑制喉癌的增殖。在TU212细胞的裸鼠成瘤实验中,空白对照组、let-7a NC组和let-7a mimics组TU212细胞的成瘤组织中let-7a mRNA的相对表达水平分别为1.519±0.717、1.485±0.438、2.490±0.526,提示转染let-7a mimics的TU212细胞的成瘤组织中let-7a成功过表达,见图 3C。
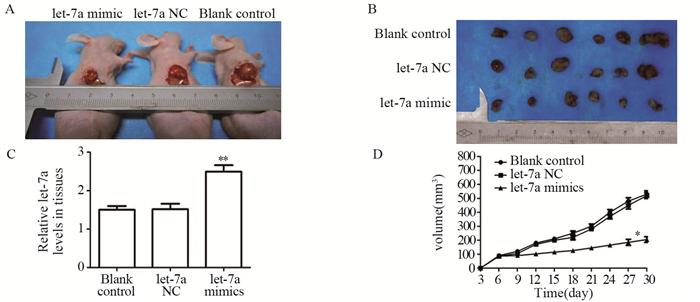
|
| *: P=0.002, **: P=0.001, compared with blank control group or let-7a NC group. 图 3 裸鼠移植瘤的成瘤情况及let-7a在裸鼠移植瘤组织中的表达 Figure 3 Formation of xenograft in nude mice and let-7a expression in xenograft tissues |
绘制成瘤组织的体积生长曲线发现,let-7a过表达的TU212细胞的成瘤组织的体积增长水平明显低于对应时间点的空白对照组和let-7a NC组,差异有统计学意义(P=0.002),见图 3D。
2.4 let-7a过表达的TU212成瘤组织中HMGA2的mRNA和蛋白水平降低RT-qPCR和Western blot实验结果提示,与空白对照组和let-7a NC组比较,let-7a mimic组中HMGA2的转录和翻译水平显著下调,见图 4。
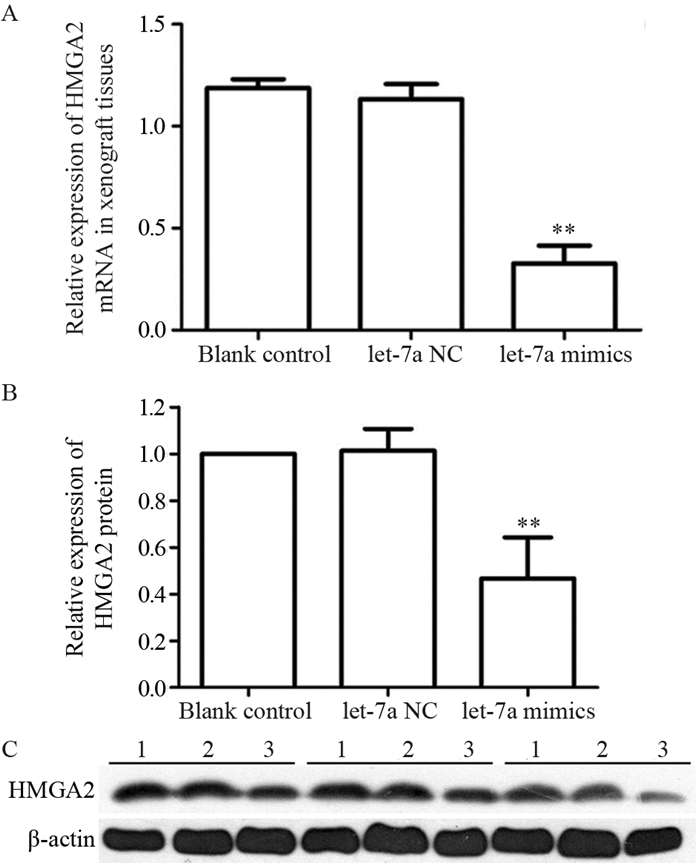
|
| **: P=0.002, compared with blank control group or let-7a NC group; 1: Blank control; 2: let-7a NC; 3: let-7a mimics. 图 4 HMGA2在裸鼠移植瘤组织中的表达情况 Figure 4 HMGA2 expression in xenograft tissues in nude mice |
喉癌的发病率在耳鼻喉科恶性肿瘤中居第三位,且呈逐年上升趋势[7]。目前已知喉癌的病因与遗传、环境及不良习惯等诸多因素密切相关,但具体发病机制尚未阐明[8]。深入探讨喉癌发生发展与侵袭转移的发病机制,寻找有效的阻断靶点并较好地应用于该病的预防、诊断及分子靶向治疗是我们亟待解决的问题。
let-7是目前研究较为广泛的miRNA之一,最早在线虫中发现,其序列、表达模式、调控功能均具有高度保守性。最新研究证明let-7a可以抑制肿瘤周围微血管的形成,造成肿瘤组织内的乏氧状态及肿瘤微环境的破坏,从而抑制肿瘤的生长和转移[9]。HMGA2是一种非组蛋白染色体蛋白,能通过与染色质结合而改变染色质的结构,被公认为是一种新的癌基因,可能与调节肿瘤相关基因的转录以及破坏DNA修复系统等相关[10]。研究报道在食管癌[11]、口腔鳞癌[12]、头颈鳞癌[13]等肿瘤中均发现let-7靶向负调控HMGA2的表达,并与恶性肿瘤的侵袭密切相关。Kuma等[14]在肺癌的实验中通过制作一系列HMGA2的表达结构,验证了HMGA2的3'UTR可作为TGF-β的ceRNA,通过竞争性结合抑瘤性miRNA let-7,增强TGF-β信号通路,最终促进肺癌细胞的增殖、转移。但关于let-7a调控HMGA2对喉癌增殖、侵袭的影响及其机制研究鲜见相关报道。
本研究MTT法检测结果发现let-7a可明显抑制细胞的活力。RT-qPCR法检测TU212细胞内let-7a和HMGA2 mRNA的表达情况发现,1et-7a mimics组中let-7a的表达量明显高于let-7a NC组和空白对照组,而HMGA2 mRNA的表达受到抑制;Western blot法检测细胞中HMGA2蛋白的表达,其结果与mRNA的结果一致,这表明let-7a可有效抑制细胞中HMGA2的转录和翻译。在TU212细胞株的体外成瘤实验中,1et-7a mimics组裸鼠皮下肿瘤生长速度较其他两组明显减慢,且瘤体体积均显著小于其他两组,提示let-7a对裸鼠皮下移植瘤的生长有明显抑制作用,进一步证实let-7a抑制喉癌的增殖。RT-qPCR和Western blot法检测成瘤组织中HMGA2的表达水平,与细胞实验结果完全一致,进一步提示let-7a能够负向调控HMGA2的表达,抑制肿瘤的生长。研究发现let-7a能够靶向调控HMGA2的表达机制是HMGA2基因重排过程中丢失了包括3’端的非翻译区(3’UTR)在内的酸性羧基尾端,从而使1et-7a对HMGA2失去靶向抑制功能和沉默作用,进而使HMGA2异常激活,促进肿瘤的侵袭性生长[15]。
综上所述,本研究通过瞬时转染技术构建了喉癌TU212细胞内let-7a高表达的状态,在细胞水平证实let-7a负向调控HMGA2基因的表达,抑制喉癌TU212细胞的增殖;成功构建了人喉癌TU212细胞裸鼠移植瘤模型,证实let-7a靶向调控HMGA2蛋白的表达,从而抑制了喉癌细胞的生长,为进一步探讨喉癌的增殖影响机制及分子靶向治疗提供了理论依据。
作者贡献
马丽娟:实验设计、实施及文章撰写
周恩、邹联洪:实验设计及实施
尹娟:实验实施
肖旭平:实验评估及文章审校
| [1] |
Wang Q, Liu Y, Hu G, et al. The survival rate and larynx preservation in elderly cancer patients who received surgical operation: A retrospective cohort study[J]. Int J Surg, 2016, 36(Pt A): 342-346. |
| [2] |
Zhao XP, Zhang H, Jiao JY, et al. Overexpression of HMGA2 promotes tongue cancer metastasis through EMT pathway[J]. J Transl Med, 2016, 14: 26. DOI:10.1186/s12967-016-0777-0 |
| [3] |
Li Y, Liu H, Lai C, et al. The Lin28/let-7a/c-Myc pathway plays a role in non-muscle invasive bladder cancer[J]. Cell Tissue Res, 2013, 354(2): 533-541. DOI:10.1007/s00441-013-1715-6 |
| [4] |
Xu C, Sun X, Qin S, et al. Let-7a regulates mammosphere formation capacity through Ras/NF-κB and Ras/MAPK/ERK pathway in breast cancer stem cells[J]. Cell Cycle, 2015, 14(11): 1686-1697. DOI:10.1080/15384101.2015.1030547 |
| [5] |
Wang YY, Ren T, Cai YY, et al. MicroRNA let-7a inhibits the proliferation and invasion of nonsmall cell lung cancer cell line 95D by regulating K-Ras and HMGA2 gene expression[J]. Cancer Biother Radiopharm, 2013, 28(2): 131-137. DOI:10.1089/cbr.2012.1307 |
| [6] |
马丽娟, 刘金华, 肖旭平. 喉癌组织miRNAlet-7a和HMGA2表达临床意义研究[J]. 中华肿瘤防治杂志, 2016, 23(2): 74-78. [Ma LJ, Liu JH, Xiao XP. Clinical significance of expression of microRNAlet-7a and HMGA2 in laryngeal cancer[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2016, 23(2): 74-78.] |
| [7] |
段传新. 白皮杉醇增强顺铂杀伤喉癌Hep-2细胞的作用及其机制[J]. 肿瘤防治研究, 2018, 45(6): 367-370. [Duan CX. Mechanism about how piceatannol enhances anti-tumor effect of cisplatin on laryngeal cancer Hep-2 cells[J]. Zhong Liu Fang Zhi Yan Jiu, 2018, 45(6): 367-370. DOI:10.3971/j.issn.1000-8578.2018.17.1241] |
| [8] |
Pereira da Silva A, Feliciano T, Vaz Freitas S, et al. Quality of life in patients submitted to total laryngectomy[J]. J Voice, 2015, 29(3): 382-388. DOI:10.1016/j.jvoice.2014.09.002 |
| [9] |
Lee H, Han S, Kwon CS, et al. Biogenesis and regulation of the let-7 miRNAs and their functional implication[J]. Protein Cell, 2016, 7(2): 100-113. DOI:10.1007/s13238-015-0212-y |
| [10] |
Ma C, Nong K, Zhu H, et al. H19 promotes pancreatic cancer metastasis by derepressing let-7's suppression on its target HMGA2-mediated EMT[J]. Tumour Biol, 2014, 35(9): 9163-9169. DOI:10.1007/s13277-014-2185-5 |
| [11] |
Liu Q, Lv GD, Qin X, et al. Role of microRNA let-7 and effect to HMGA2 in esophageal squamous cell carcinoma[J]. Mol Biol Rep, 2012, 39(2): 1239-1246. DOI:10.1007/s11033-011-0854-7 |
| [12] |
Sterenczak KA, Eckardt A, Kampmann A, et al. HMGA 1 and HMGA2 expression and comparative analyses of HMGA2, Lin28 and let-7 miRNAs in oral squamous cell carcinoma[J]. BMC Cancer, 2014, 14: 694. DOI:10.1186/1471-2407-14-694 |
| [13] |
Yamazaki H, Mori T, Yazawa M, et al. Stem cell self-renewal factors Bmi l and HMGA2 in head and neck squamous cell carcinoma: clues for diagnosis[J]. Lab Invest, 2013, 93(12): 1331-1338. DOI:10.1038/labinvest.2013.120 |
| [14] |
Kumar MS, Armenteros-Monterroso E, East P, et al. HMGA2 functions as a competing endogenous RNA to promote lung cancer progression[J]. Nature, 2014, 505(7482): 212-217. DOI:10.1038/nature12785 |
| [15] |
Erkul E, Yilmaz I, Gungor A, et al. MicroRNA-21 in laryngeal squamous cell carcinoma:Diagnostic and prognostic features[J]. Laryngoscope, 2017, 127(2): E62-E66. DOI:10.1002/lary.26226 |
 2020, Vol. 47
2020, Vol. 47


