文章信息
- PDFF和OP/IP对胸、腰椎多发性骨髓瘤骨病的诊断价值
- Diagnostic Value of PDFF and OP/IP for Multiple Myeloma Bone Disease of Thoracic and Lumbar Spine
- 肿瘤防治研究, 2020, 47(2): 115-118
- Cancer Research on Prevention and Treatment, 2020, 47(2): 115-118
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.0906
- 收稿日期: 2019-07-15
- 修回日期: 2019-10-10
多发性骨髓瘤(multiple myeloma, MM)是第二常见的血液系统恶性肿瘤,由浆细胞的单克隆增生引起,多见于中老年人[1]。多发性骨髓瘤骨病(multiple myeloma bone diseases, MMBD)是以破骨细胞活性增强、成骨细胞功能受抑制及一系列细胞因子、蛋白通路等导致的骨吸收和骨形成平衡失调,引起的广泛性溶骨性改变。临床以骨质疏松、病理性骨折、骨痛为常见表现,见于70%以上的初诊MM患者,85%的MM患者在复诊过程中伴随不同程度的MMBD进展[2]。MMBD可累及全身各骨,颅骨、胸肋骨、脊柱及骨盆是常见的受累骨。
磁共振成像(magnetic resonance imaging, MRI)能比较敏锐地发现骨髓病变。化学位移水脂磁共振成像(chemical shift-encoding based water-fat MRI)基于mDxion技术,是一种水和脂肪分离技术,经过一次扫描能够产生水相、脂肪相、同相位、反相位四种对比,mDxion quant技术能进行脂肪含量的定量测量,即质子密度脂肪分数(proton density fat fraction, PDFF)成像。同、反相位成像(out of phase/in phase, OP/IP),即同相位信号与反相位信号的比值,能反映水和脂肪成分的改变。两种技术均广泛应用于骨骼肌肉系统病变诊断,尤其是椎体良恶性占位的鉴别[2-8],但鲜有对MMBD的专门研究报道。本研究分析21例MM患者的病变及正常胸、腰椎的PDFF和正反相位成像资料,旨在评估PDFF和正反相位成像对MMBD的诊断效能。
1 资料与方法 1.1 研究对象回顾性分析2018年12月—2019年5月在中国医科大学附属盛京医院第二血液内科就诊的MM患者21例,其中男10例、女11例,年龄41~80岁,中位年龄65岁,患者诉有胸腰背部疼痛,均经过骨髓穿刺及实验室检查确诊,排除标准:(1)胸、腰椎外伤史;(2)患者有其他肿瘤病史;(3)磁共振禁忌证;(4)图像质量不满足本研究要求;(5)胸腰椎MRI检查未见确切病灶。18例为初诊患者,未经过任何治疗;3例为复诊患者已经过化疗,化疗时间不超过8月,且治疗状态未达缓解,未使用集落刺激因子治疗。本研究经本院伦理委员会批准,所有受试对象均签署知情同意书。
1.2 扫描方法采用Philips Ingenia 3.0T磁共振扫描仪,患者取仰卧位,头先进,扫描范围为枕骨大孔水平到骶椎。运用体线圈对脊柱(颈椎、胸椎、腰椎)分为两段(第一段:枕骨大孔至胸10水平;第二段:胸10至骶椎水平)进行扫描。扫描序列包括矢状位T1WI(TR 535 ms, TE 16 ms,矩阵188×307×13,FOV 180 mm×360 mm×57 mm),矢状位STIR(TR 4055 ms,TE 70 ms,矩阵164×252×13,FOV 180 mm×360 mm×57 mm),矢状位mDxion dyn(TR 5.2ms,TE 1.93 ms,矩阵200×378×19,FOV 180 mm×360 mm×52 mm),矢状位mDxion quant(TR 5.2ms,TE 1.93 ms,矩阵200×378×19,FOV 180 mm×360 mm×52 mm)。
1.3 图像分析由两名具有5年以上阅片经验的放射科医生在矢状位T1WI和STIR序列对胸、腰椎共同诊断,如有分歧,进行协商达成一致。MMBD表现为T1WI低信号、STIR高信号,结合病史、骨髓穿刺及实验室结果、旧片(包括CT和MRI检查),确定椎体为正常、MMBD及良性病变(血管瘤、终板炎)。
将图像上传至Philips Isp后处理工作站进行分析。依据在常规序列的诊断结果,分别测量正常椎体及病变椎体的OP/IP、PDFF值:(1)正常椎体,在正中连续三个层面勾画范围约200 mm2的圆形感兴趣区(region of interest, ROI),取其平均值;(2)病变椎体,选择直径≥5 mm的病变,在病变区域尽可能大地勾画圆形ROI,连续测量三次,取平均值;如有椎体的病变直径 < 5 mm,则不计入。
1.4 统计学方法采用MedCalc15.6.1统计软件,MMBD病变和非MMBD病变组间PDFF和OP/IP参数比较采用两独立样本t检验。计算PDFF及OP/IP诊断MM的敏感度、特异性,并绘制ROC曲线,计算ROC曲线下面积(area under curve, AUC);用Youden指数计算PDFF和OP/IP的诊断临界值。用Pearson相关分析分析两参数间相关性。P < 0.05为差异有统计学意义。
2 结果 2.1 MMBD病变组与非MMBD病变组椎体个数及病变类型MM患者的MR表现分为五种类型,本研究有三种,21例患者中,14例表现为局灶型(14/21, 66.7%)、5例表现为弥漫型(5/21, 23.8%)、2例表现为“盐和胡椒”型(2/21, 9.5%)。共有338个椎体纳入本研究,MMBD组与非MMBD组分别为119和219个椎体(35.2% vs. 64.8%),其中非MMBD组中214个为正常椎体、4个椎体见终板炎、1个椎体内见血管瘤。
2.2 MMBD病变组与非MMBD病变组PDFF、OP/IP值的比较经两独立样本t检验,非MMBD病变组的OP/IP平均值约(0.445±0.157),MMBD病变组的OP/IP平均值约(0.749±0.123),两者比较差异有统计学意义(t=-19.593, P=0.000)。非MMBD病变组的PDFF平均值约(45.587±15.814)%,MMBD病变组约(3.858±9.280)%,两者比较差异有统计学意义(t=30.550, P=0.000)。椎体MMBD病灶在反相位(out of phase)图信号增高,在同相位(in phase)图信号减低,OP/IP比值升高;在脂肪分数图信号减低,PDFF减低,见图 1。
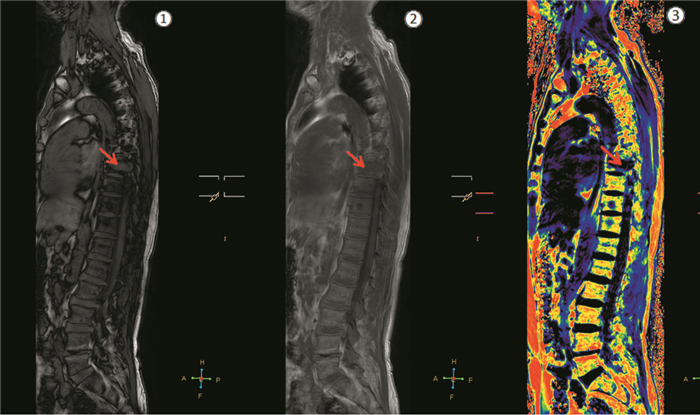
|
| Male, 67 years old, T8 vertebral body showed multiple myeloma lesions with compression fracture; ①: signal in out of phase map increased; ②: signal in in phase map decreased; ③: signal in PDFF map decreased; PDFF: proton density fat fraction. 图 1 1例患者的脊柱反相位、同相位、PDFF图 Figure 1 Out of phase map, in phase map and PDFF map of one patient's spine |
对两参数做ROC曲线,见图 2。PDFF的AUC、敏感度和特异性均高于OP/IP。PDFF的诊断界值为8.45%,AUC为0.969,敏感度为96.64%,特异性为96.35%;OP/IP的诊断界值为0.66,AUC为0.922,敏感度为85.71%,特异性为90.41%,两者的ROC-AUC差异有统计学意义(P=0.007)。
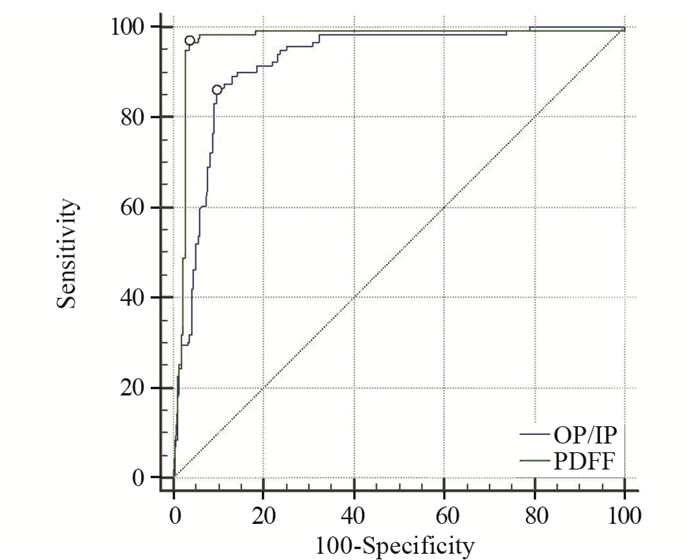
|
| 图 2 OP/IP和PDFF的ROC曲线 Figure 2 ROC curves of OP/IP and PDFF |
对PDFF及OP/IP两参数行Pearson相关性分析,结果显示r=-0.560,P < 0.05,即两者呈中度负相关。
3 讨论OP/IP及PDFF基于mDxion技术,利用脂肪和水的质子共振频率的差异,经过多个回波后将水信号与脂肪信号分离。PDFF能够实现无创性定量测量骨髓中的脂肪成分。OP/IP能够反映组织中水和脂肪含量的改变。已有多项研究表明椎体恶性病变的成分不同于良性病变及正常椎体,本研究非MMBD病变组OP/IP值低于MMBD病变组(P < 0.05);PDFF值高于MMBD病变组(P < 0.05),该结果与既往文献报道一致[5-9]。
随着年龄的增长,红骨髓向黄骨髓转化,骨髓内的脂肪成分随之增多。本文的研究对象为中老年人,非MMBD病变组主要为正常椎体(214/219个),其OP/IP及PDFF平均值分别为(0.445±0.157)%和(45.587±15.814)%,与其他研究基本相近[2]。良性占位(如红骨髓增多及骨髓水肿)中含有水和脂肪成分,MM细胞在椎体骨髓中恶性增殖浸润,正常的骨髓成分被MM细胞代替,在MM细胞周围骨溶解增强,同时成骨细胞的功能受到抑制,即造成骨重建偶联失衡[10],这使得骨髓成分进一步减少。MMBD病变组的OP/IP及PDFF平均值分别为0.749±0.123和(3.858±9.280)%。Schmeel等[2]研究椎体恶性病变的平均PDFF值为(3.09±3.06)%,正常椎体平均PDFF值(50.51±14.69)%,与本研究基本一致。
OP/IP值即反相位信号强度与同相位信号强度的比值,当脂肪信号与水信号处于反相位时两者相减,处于同相位时两者相加;相应区域的PDFF值经过六个回波、七个脂肪峰模型后获得,能无创性地定量测量脂肪含量,与磁共振波谱的检测结果一致性好[11];ROC曲线显示PDFF的敏感度、特异性、AUC均高于OP/IP。有若干因素影响OP/IP图脂肪分数的计算,如骨小梁的存在使局部信号不均匀,周围组织的T2*缩短,影响了脂肪和水信号的分离[4, 12],从而对OP/IP的诊断效能产生一定影响。因此,PDFF对于椎体MMBD病变的诊断价值高于OP/IP。
有研究认为,椎体恶性病变代替正常的骨髓成分,病灶区域不含脂肪成分[13]。本研究MMBD病变与非MMBD病变的OP/IP诊断界值为0.66,Douis等测得椎体良恶性病变的诊断界值约0.8[5],该研究纳入的恶性病变共12例,其中仅一例为浆细胞瘤,无MMBD。Schmeel等[2]测得椎体良恶性病变的诊断界值约6.40%,该研究中MMBD病变仅占恶性病变的11.36%(5/44)。本研究测得MMBD病变与非MMBD病变的PDFF界值为8.45%,说明MM与其他椎体恶性肿瘤存在差异。
Pearson相关性分析显示OP/IP与PDFF值呈负相关,这与两者均可反映组织的脂肪成分有关,同时OP/IP也可反映组织的水成分。当组织的脂肪成分减少时,水与脂肪信号之和减小,而信号之差增大,OP/IP增大;而组织中脂肪所占比例减少,PDFF减小,因此两者呈负相关。
本研究存在的不足有:(1)样本人群选取有偏倚,良性病变样本量小,诊断界值反映椎体是否为MMBD病变,而对良恶性鉴别诊断价值有限;(2)由于纳入研究对象的颈椎MMBD病灶较少,遂本研究只分析胸、腰椎的正常、良性、MMBD病变,对于颈椎MMBD今后仍需进一步研究。(3)未将胸、腰椎分节段进行分析。既往文献[5, 14]认为胸、腰椎的PDFF值存在差异,本研究将其忽略。
综上所述,PDFF和OP/IP均可以反映胸、腰椎MMBD病变的脂肪含量改变,在其诊断方面均具有价值,但PDFF的诊断效能更高,优于OP/IP。
作者贡献
魏铃:试验实施、数据统计分析及文章撰写
王丰哲:文章写作指导及修改润色
殷国良:部分试验实施及数据整理
潘诗农:试验全程指导及文章修改
| [1] |
Brigle K, Rogers B. Pathobiology and Diagnosis of Multiple Myeloma[J]. Semin Oncol Nurs, 2017, 33(3): 225-236. DOI:10.1016/j.soncn.2017.05.012 |
| [2] |
Schmeel FC, Luetkens JA, Wagenhäuser PJ, et al. Proton density fat fraction (PDFF) MRI for differentiation of benign and malignant vertebral lesions[J]. Eur Radiol, 2018, 28(6): 2397-2405. DOI:10.1007/s00330-017-5241-x |
| [3] |
Zhang L, Li S, Hao S, et al. Quantification of fat deposition in bone marrow in the lumbar vertebra by proton MRS and in-phase and out-of-phase MRI for the diagnosis of osteoporosis[J]. J Xray Sci Technol, 2016, 24(2): 257-266. |
| [4] |
Kumar NM, Ahlawat S, Fayad LM. Chemical shift imaging with in-phase and opposed-phase sequences at 3 T: what is the optimal threshold, measurement method, and diagnostic accuracy for characterizing marrow signal abnormalities?[J]. Skeletal Radiol, 2018, 47(12): 1661-1671. DOI:10.1007/s00256-018-2999-0 |
| [5] |
Douis H, Davies AM, Jeys L, et al. Chemical shift MRI can aid in the diagnosis of indeterminate skeletal lesions of the spine[J]. Eur Radiol, 2016, 26(4): 932-940. DOI:10.1007/s00330-015-3898-6 |
| [6] |
Yoo HJ, Hong SH, Kim DH, et al. Measurement of fat content in vertebral marrow using a modified dixon sequence to differentiate benign from malignant processes[J]. J Magn Reson Imaging, 2017, 45(5): 1534-1544. DOI:10.1002/jmri.25496 |
| [7] |
Akman B, Ata Korkmaz HA, Sarı A. Efficacy of chemical shift MRI for differentiating diffuse red bone marrow reconversion and hematological malignancies[J]. Turk J Med Sci, 2019, 49(2): 644-652. DOI:10.3906/sag-1812-125 |
| [8] |
Amin WM, Kotb HT, Abdel-Kerim AA, et al. Diffusion-weighted MRI and in-phase/opposed-phase sequences in the assessment of bone tumors[J]. J Magn Reson Imaging, 2016, 44(3): 565-572. DOI:10.1002/jmri.25212 |
| [9] |
Lee SH, Lee YH, Hahn S, et al. Fat fraction estimation of morphologically normal lumbar vertebrae using the two-point mDixon turbo spin-echo MRI with flexible echo times and multipeak spectral model of fat: Comparison between cancer and non-cancer patients[J]. Magn Reson Imaging, 2016, 34(8): 1114-1120. DOI:10.1016/j.mri.2016.05.007 |
| [10] |
Hansford BG, Silbermann R. Advanced Imaging of Multiple Myeloma Bone Disease[J]. Front Endocrinol (Lausanne), 2018, 9: 436. DOI:10.3389/fendo.2018.00436 |
| [11] |
张勇, 程晓光, 于爱红, 等. 腰椎椎体骨髓脂肪含量与骨密度、年龄关系的定量影像评估[J]. 中华放射学杂志, 2017, 51(10): 771-776. [Zhang Y, Cheng XG, Yu AH, et al. Quantitative radiological evaluation of interaction of lumbar vertebral bone marrow fat, bone mineral density and age[J]. Zhonghua Fang She Xue Za Zhi, 2017, 51(10): 771-776. DOI:10.3760/j.issn.1005-1201.2017.10.010] |
| [12] |
Karampinos DC, Ruschke S, Dieckmeyer M, et al. Modeling of T2* decay in vertebral bone marrow fat quantification[J]. NMR Biomed, 2015, 28(11): 1535-1542. DOI:10.1002/nbm.3420 |
| [13] |
Shi YJ, Li XT, Zhang XY, et al. Differential diagnosis of hemangiomas from spinal osteolytic metastases using 3.0 T MRI: comparison of T1-weighted imaging, chemical-shift imaging, diffusion-weighted and contrast-enhanced imaging[J]. Oncotarget, 2017, 8(41): 71095-71104. |
| [14] |
Baum T, Yap SP, Dieckmeyer M, et al. Assessment of whole spine vertebral bone marrow fat using chemical shift-encoding based water-fat MRI[J]. J Magn Reson Imaging, 2015, 42(4): 1018-1023. DOI:10.1002/jmri.24854 |
 2020, Vol. 47
2020, Vol. 47


