文章信息
- miR-601靶向调控MMP-17抑制非小细胞肺癌的迁移和侵袭
- miR-601 Suppresses Migration and Invasion of Non-small Cell lung Cancer Cells by Targeting MMP-17
- 肿瘤防治研究, 2020, 47(1): 37-41
- Cancer Research on Prevention and Treatment, 2020, 47(1): 37-41
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.0832
- 收稿日期: 2019-06-25
- 修回日期: 2019-10-23
2. 430030 武汉, 武汉市中心医院皮肤科
2. Department of Dermatology, The Central Hospital of Wuhan, Wuhan 430030, China
非小细胞肺癌(NSCLC)是呼吸系统最常见的恶性肿瘤, 其发病率和死亡率都位居恶性肿瘤的第1位[1]。虽然早期手术及靶向药物的治疗措施不断完善, 但我国每年仍然有超过400万人死于肺癌及相关疾病, 肿瘤细胞早期侵袭和转移是导致死亡率高的主要原因[2-3]。因此探寻非小细胞肺癌侵袭转移机制, 寻找可能干预的靶位点具有重要的临床意义[4]。已有研究表明, miR-601能够调控多种肿瘤细胞的侵袭和转移[5], 然而在非小细胞肺癌中的功能并不清楚。本研究将深入探讨miR-601在调控肺癌细胞迁移侵袭中的作用及其可能机制。
1 资料与方法 1.1 临床资料收集2017年3月-2017年9月在武汉市第一医院胸心外科治疗的25例非小细胞肺癌患者(术后病理确诊), 其中男17例、女8例, 平均年龄(57.34±7.84)岁, 所有患者均为第一次诊断及治疗, 无放化疗病史。手术切取瘤体区域及正常肺组织(距离瘤体边界大于5 cm), 并迅速置于液氮罐中临时存储, 随后转移至-80℃冰箱保存。术中患者肺癌侵袭及淋巴结转移情况按照人民卫生出版社出版的内科学第8版[6]分期标准进行。本研究中所有患者均签署知情同意书, 并得到医学伦理委员会批准。
1.2 细胞系人非小细胞肺癌细胞A549、H1299及人肾上皮细胞293T均购自中国科学院上海细胞库。三种细胞均采用含有10%胎牛血清、100 u/ml青霉素及100 μg/ml链霉素的RPMI 1640培养基, 并在37℃、5%CO2的培养箱中进行培养。
1.3 RT-qPCR检测TRIzol法提取组织及细胞的总RNA, 并采用RevertAid First Strand cDNA Synthesis Kit试剂盒将RNA反转录合成cDNA。反转录反应条件为:16℃ 30 min, 42℃ 30 min, 85℃ 5 min。引物如下:miR-601特异性引物5'-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGCTCCTCC-3', U6特异性引物5'-GAACGCTTCACGAATTTGC-3'。采用SYBR Green实时荧光定量PCR法进行扩增, 反应条件为:95℃热启动10 min; 随后95℃变性30 s, 58℃退火1 min, 72℃延伸1 min, 共35个循环; 至4℃结束。定量扩增引物如下:miR-601上游引物5'-TCGGCAGGTGGTCTAGGATTGTT-3', 下游引物5'-CTCAACTGGTGTCGTGGA-3';U6上游引物5'-CTCGCTTCGGCAGCACA-3', 下游引物5'-AACGCTTCACGAATTTGCGT-3';MMP-17上游引物5'-GACCTGTTTGCAGTGGCTGT-3', 下游引物5'-ACGATCTTGTGGTCGCTGGT-3';GAPDH上游引物5'-ACCCACTCCTCCACCTTTG-3', 下游引物5'-CACCACCCTGTTGCTGTAG-3'。
1.4 细胞转染实验将A549细胞或H1299细胞接种于6孔板(2.0×105个/孔), 当细胞生长达到60%左右时, 采用LipofectamineTM 2000转染试剂分别将miR-NC对照组、miR-601 mimics实验组(均购自上海吉凯基因技术有限公司)转染到细胞, 8 h后更换新鲜培养基, 48 h后收集细胞用于后续实验。
1.5 Transwell迁移及侵袭实验采用无Matrigel基质胶和有Matrigel基质胶的Transwell小室分别进行细胞迁移和侵袭实验。将处于对数生长期的细胞制成1×106个/毫升浓度的细胞悬液, 然后在上室中加入100 μl的细胞悬液, 下室加入600 μl含10%胎牛血清的RPMI 1640培养基, 每室设3个对照。细胞培养24 h后取下Transwell小室, 用棉签蘸去小室上面的细胞, 随后4%多聚甲醛固定及0.1%结晶紫染色, 显微镜下进行侵袭细胞计数。
1.6 Western blot检测用预冷的PBS洗涤细胞2次, 加入RIPA裂解液冰上裂解30 min, 在4℃以12 000 g离心15 min后取上清液, 并测定蛋白浓度。将加入上样缓冲液的上清液在100℃变性5 min, 取50 μg加入到SDS-PAGE凝胶泳道中进行电泳, 并将分离后的蛋白电转至硝酸纤维素膜上。用含5%脱脂奶粉的TBST封闭1 h, 加入浓度1:1 000一抗于4℃孵育过夜。TBST洗膜3次后, 加入浓度1:2 000二抗室温孵育1 h, TBST洗膜后加入ECL进行显影分析。本研究所用MMP-17兔抗人多抗和GAPDH兔抗人多抗均购自美国Abcam公司, 二抗购自上海碧云天公司。
1.7 荧光素酶活性检测将处于对数生长期的293T细胞接种到48孔板中(4.0×104个/孔), 培养24 h后, 按照脂质体LipofectamineTM2000试剂盒说明书将miR-601 mimics(20 nmol)、3'UTR报告载体(80 ng)和pRL-TK(表达海肾荧光素酶蛋白作为实验的内参, 40 ng)分别转到293T细胞。转染48 h后, 用Dual-Luciferase Reporter Assay裂解细胞并用多功能酶标仪测定荧光素酶活性。
1.8 统计学方法本研究相关统计分析由SPSS 20.0软件完成, 实验数据以均数±标准差(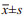
RT-qPCR检测结果表明与癌旁正常组织相比, miR-601在NSCLC组织中的表达水平明显下调(P < 0.001), 见图 1A, 且miR-601表达水平与肿瘤组织的浸润(P < 0.007)及淋巴结转移(P < 0.011)密切相关, 见图 1B~C。
|
| 图 1 miR-601在NSCLC组织中的表达(A)及与肿瘤侵袭(B)和转移(C)的相关性 Figure 1 Correlation of miR-601 expression in NSCLC tissues(A) and invasion/metastasis(B, C) of NSCLC |
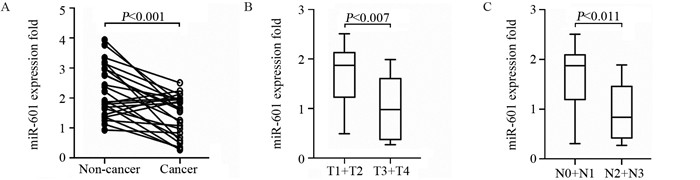
Transwell实验结果显示, 与空白对照组及阴性对照组相比, 转染miR-601 mimics的A549细胞或H1299细胞迁移及侵袭数目均明显减少, 见图 2A~B。
|
| 图 2 Transwell检测miR-601对A549细胞及H1299细胞迁移(A)和侵袭(B)的影响 Figure 2 Effect of miR-601 on migration(A) and invasion (B) of A549 and H1299 cells detected by Transwell assay |
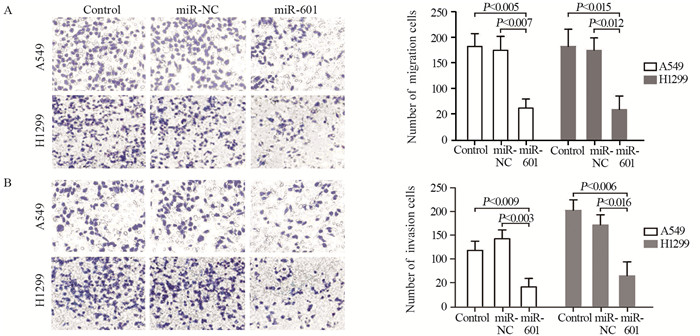
miRWalk 3.0软件预测发现, MMP-17 mRNA 3'UTR存在miR-601的结合位点。成功构建MMP-17野生型及突变型3'UTR报告载体, 见图 3A。结果表明, miR-601 mimics可抑制野生型3'UTR报告载体荧光素酶活性, 而对突变型3'UTR报告载体荧光素酶活性没有明显的抑制作用, 见图 3B。进一步研究发现, 瞬时转染miR-601 mimics可明显抑制A549细胞或H1299细胞中MMP-17的mRNA和蛋白表达, 见图 3C。
|
| A: Putative miR-601 binding sites in the 3′UTR of the MMP-17 gene; B: Luciferase activity of the wild-type reporter gene MMP-17 (WT) and mutant reporter gene MMP-17 (MUT) in miR-NC and miR-601 mimics; C: mRNA and protein expression levels of MMP-17 in A549 cells or H1299 cells after transient transfection of miR-601 mimics. 图 3 双荧光素酶报告基因实验检测miR-601与MMP-17基因3'UTR区的结合 Figure 3 Binding of miR-601 to 3'UTR region of MMP-17 gene detected by dual luciferase reporter assay |
为进一步评估MMP-17是否为miR-601功能性靶基因, 通过瞬时转染MMP-17后发现A549细胞或H1299细胞的迁移及侵袭能力增强, 但当引入miR-601 mimics后细胞迁移和侵袭能力明显被逆转, 见图 4。这些结果说明, miR-601可有效抑制MMP-17对NSCLC细胞的迁移和侵袭。
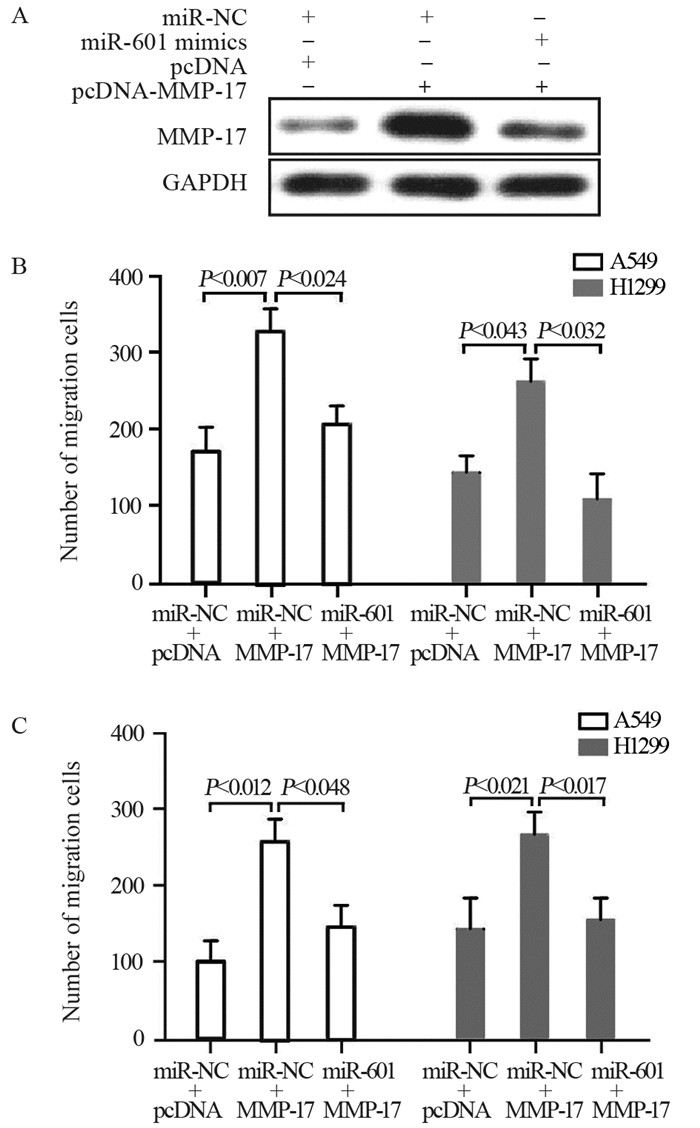
|
| 图 4 miR-601通过调控MMP-17表达(A)抑制A549细胞及H1299细胞的迁移(B)和侵袭(C) Figure 4 miR-601 inhibited migration(B) and invasion(C) of A549 and H1299 cells by regulating MMP-17 expression (A) |
miRNA在非小细胞肺癌的发生及发展中发挥重要作用。一方面miRNA可以作为抑癌因子抑制原癌基因的激活, 从而抑制肿瘤的生长; 另一方面miRNA通过下调肿瘤抑制因子或抑癌基因表达从而产生致癌作用[7]。此外, 具有特征性的miRNA表达指纹谱在非小细胞肺癌的早期诊断、靶向疗效和预后评估等方面也具有重要价值[8]。因此, 研究miRNA与非小细胞肺癌发病机制之间的关系, 对肺癌的临床诊断、治疗及预防具有积极的意义。
既往研究表明, miR-601在调控肿瘤细胞恶性表型方面具有重要作用, 包括结直肠癌[9], 食管鳞状细胞癌[10], 乳腺癌及胰腺癌[11-12]。Wang等发现结直肠癌患者血浆中miR-601水平显著降低, 且降低的程度与患者疾病的进展有着密切关系, 对晚期结直肠癌的诊断具有重要的价值[9]。Yang等发现miR-601在食管鳞状细胞癌中上调, 并增加了食管鳞状细胞癌变的风险[10]。Hu等发现miR-601可以通过直接靶向PTP4A1来抑制乳腺癌细胞的增殖、迁移和侵袭[11]。Cao等发现胰腺癌组织中miR-601可以抑制发育调节因子SIRT1的表达, 从而抑制胰腺癌细胞的增殖和迁移[12]。此外, Fleming等发现miR-601作为抑癌因子, 通过调节SIRT1和BCL2L2抑制前列腺癌细胞的增殖[13]。本研究通过对比非小细胞肺癌组织及癌旁组织中miR-601的表达量, 发现miR-601在肺癌组织中表达明显降低, 且降低程度与癌细胞的浸润及淋巴结转移密切相关, 这表明miR-601在非小细胞肺癌的发展中具有一定的作用。为了研究miR-601是对肺癌细胞功能的影响, 我们以A549细胞及H1299细胞为模型观察miR-601对肺癌细胞迁移及侵袭的作用, 结果发现miR-601能明显抑制细胞的迁移及侵袭能力。
随后, 我们通过靶基因预测及双荧光素酶实验验证了MMP-17是miR-601直接调控的靶基因。MMP-17作为基质金属蛋白酶家族的重要成员, 通过降解细胞外基质从而促进肿瘤细胞突破基底膜和细胞外基质构成的组织学屏障, 从而侵袭周围组织和转移至远处组织[14]。研究表明, MMP-17参与多种肿瘤的运动、侵袭及转移, 包括乳腺癌、胃癌、结肠癌及头颈部肿瘤等[14]。Atkinson等也发现MMP-17也被证明在非小细胞肺癌中组织中高表达, 并可能和肺癌细胞的淋巴结转移密切相关[15]。在本研究中, 过表达MMP-17确实会增强A549细胞及H1299细胞的迁移和侵袭能力, 而当转染miR-601时其增强细胞迁移和侵袭的能力明显被抑制。这些结果表明miR-601通过抑制MMP-17的表达从而调控非小细胞肺癌的迁移和侵袭, 并可将miR-601/MMP-17调控轴作为非小细胞肺癌临床干预的一个重要靶点。
作者贡献
骆曼:实验操作、数据分析及论文撰写
李灵毅:实验设计及指导、论文修改及审核
| [1] |
Herbst RS, Morgensztern D, Boshoff C. The biology and management of non-small cell lung cancer[J]. Nature, 2018, 553(7689): 446-454. DOI:10.1038/nature25183 |
| [2] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [3] |
Chen W, Sun K, Zhang R, et al. Cancer incidence and mortality in China, 2014[J]. Chin J Cancer Res, 2018, 30(1): 1-12. DOI:10.21147/j.issn.1000-9604.2018.01.01 |
| [4] |
毛昀, 李林潞, 薛鹏, 等. 小细胞肺癌关键基因及信号通路分析[J]. 肿瘤防治研究, 2019, 46(8): 683-689. [Mao Y, Li LL, Xue P, et al. Key Genes and Signaling Pathways in Small Cell Lung Cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2019, 46(8): 683-689. DOI:10.3971/j.issn.1000-8578.2019.18.2039] |
| [5] |
Liu C, Tian X, Sun HB, et al. MiR-601 inhibits the proliferation and metastasis of esophageal squamous cell carcinoma (ESCC) by targeting HDAC6[J]. Eur Rev Med Pharmacol Sci, 2019, 23(3): 1069-1076. |
| [6] |
葛均波, 徐永健.内科学[M]. 8版.北京: 人民卫生出版社, 2013: 76-78. [Ge JB, Xu YJ. Internal Medicine[M]. 8th ed. Bejing: People's Medical Publishing House, 2013: 76-78.]
|
| [7] |
Wu KL, Tsai YM, Lien CT, et al. The Roles of MicroRNA in Lung Cancer[J]. Int J Mol Sci, 2019, 20(7): 1611. DOI:10.3390/ijms20071611 |
| [8] |
Inamura K, Ishikawa Y. MicroRNA in lung cancer:novel biomarkers and potential tools for treatment[J]. J Clin Med, 2016, 5(3): E36. DOI:10.3390/jcm5030036 |
| [9] |
Wang Q, Huang Z, Ni S, et al. Plasma miR-601 and miR-760 are novel biomarkers for the early detection of colorectal cancer[J]. PLoS One, 2012, 7(9): e44398. DOI:10.1371/journal.pone.0044398 |
| [10] |
Yang M, Liu R, Sheng J, et al. Differential expression profiles of microRNAs as potential biomarkers for the early diagnosis of esophageal squamous cell carcinoma[J]. Oncol Rep, 2013, 29(1): 169-176. |
| [11] |
Hu JY, Yi W, Wei X, et al. miR-601 is a prognostic marker and suppresses cell growth and invasion by targeting PTP4A1 in breast cancer[J]. Biomed Pharmacother, 2016, 79: 247-253. DOI:10.1016/j.biopha.2016.02.014 |
| [12] |
Cao W, Jin H, Zhang L, et al. Identification of miR-601 as a novel regulator in the development of pancreatic cancer[J]. Biochem Biophys Res Commun, 2017, 483(1): 638-644. DOI:10.1016/j.bbrc.2016.12.090 |
| [13] |
Fleming JL, Bell EH, Andrews K, et al. Abstract 1101:The role of miR-601 in prostate cancer progression[J]. Cancer Res, 2016, 76(Suppl 14): 1101. |
| [14] |
Yip C, Foidart P, Noël A, et al. MT4-MMP:The GPI-Anchored Membrane-Type Matrix Metalloprotease with Multiple Functions in Diseases[J]. Int J Mol Sci, 2019, 20(2): E354. DOI:10.3390/ijms20020354 |
| [15] |
Atkinson JM, Pennington CJ, Martin SW, et al. Membrane type matrix metalloproteinases (MMPs) show differential expression in non-small cell lung cancer (NSCLC) compared to normal lung:correlation of MMP-14 mRNA expression and proteolytic activity[J]. Eur J Cancer, 2007, 43(11): 1764-1771. DOI:10.1016/j.ejca.2007.05.009 |
 2020, Vol. 47
2020, Vol. 47
