文章信息
- 放射诱导的EGFR核转位阻断可增加人宫颈癌细胞放射敏感度
- Blockade of Radiation-induced EGFR Nuclear Transport Enhances Radiosensitivity of Human Cervical Cancer
- 肿瘤防治研究, 2020, 47(1): 25-31
- Cancer Research on Prevention and Treatment, 2020, 47(1): 25-31
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.0807
- 收稿日期: 2019-06-19
- 修回日期: 2019-11-14
同步放化疗为局部晚期宫颈癌患者的标准治疗方法, 然而中晚期宫颈癌5年生存率仅40%~50%[1-2], 宫颈癌放射抗性的分子机制鲜有报道。因此, 研究导致放射抗性的分子机制可能为改善患者预后提供一个新的放射增敏策略。
表皮生长因子受体(epidermal growth factor receptor, EGFR)的表达已被确定与肿瘤的生长、侵袭转移和预后不良密切相关。约80%的宫颈癌高表达EGFR, 且与疾病进展相关, 但宫颈癌细胞EGFR的表达水平与预后及对放疗反应的相关性仍然有争议或不确定的。细胞核EGFR首先在再生的肝细胞中发现, 然后陆续在其他组织细胞核发现[3]。对于放射诱导的非配体依赖性EGFR核转位通路已有初步研究但其具体机制尚未完全阐明[4]。我们前期对120例局部晚期宫颈癌同步放化疗的临床研究结果显示, 细胞核pEGFR-T654高表达是宫颈癌一个独立的不良预后因素[5]。因此, 本研究旨在探讨放射对宫颈癌细胞EGFR核转位的影响, 以及阻断放射诱导的EGFR核转位是否会增加宫颈癌细胞的放射敏感度。
1 材料与方法 1.1 细胞株及培养人宫颈鳞癌CaSki和人宫颈腺癌HeLa细胞株均购于中国科学院上海生命科学研究院细胞资源中心。采用10%新生牛血清RPMI 1640培养基, 于37℃、5%CO2及饱和湿度条件下常规培养, 2~3天传代一次。
1.2 药物与试剂根据EGFR上的核定位序列(EGFR-NLS)设计相似性磷酸化pEGFR-T654多肽[Ac-RKRT(PO3H2)LRRLK]和对照多肽(KKALRRQEAVNAL)(上海楚肽生物科技有限公司), 纯度>98%;西妥昔单抗(Cetuximab, C225)由德国Merck KGaA公司提供; 吉非替尼(Gefitinib)购于武汉贝尔卡生物医药有限公司; 一抗和二抗分别购于美国Abcam公司和北京中杉金桥生物技术有限公司(ZSGB-BIO)。
1.3 药物预处理及放射取指数生长期细胞, 接种培养24 h后, 分别加入pEGFR-T654多肽、pEGFR-T654对照多肽、西妥昔单抗65 nmol/L和吉非替尼2 μmol/L作用16 h, 参考EGFR核转位相关研究, 本研究施予4 Gy X线照射(美国Novalis Tx 6MV直线加速器, 剂量率为320 cGy/min), 于放射前后10、20、40 min采用上海生工核蛋白提取试剂盒(BSP001)提取细胞质和细胞核蛋白, 用考马斯亮蓝法(Bradford)试剂盒(Mbchem)测定蛋白含量。
1.4 免疫印迹法测定蛋白表达按照待测蛋白分子量配制适当的分离浓度, 聚丙烯酰胺凝胶电泳(SDS-PAGE), 半干转膜或湿转膜, 用5%脱脂奶粉T-BST于37℃封闭6 h, 分别加入1:20 000兔抗人GAPDH单克隆抗体, 1:20 000兔抗人Lamin B1单克隆抗体, 1:5 000小鼠抗人EGFR单克隆抗体(货号ab52894, 批次GR41670-23), 1:100小鼠抗人pEGFR-T654单克隆抗体(货号BS4062, 批次CA36131), 1:2 500兔抗人DNA-PK单克隆抗体(货号ab32566, 批次GR190339-3), 1:1 000兔抗人pDNA-PK-T2609单克隆抗体(货号ab97611, 批次GR61403-8), 4℃孵育过夜。用T-BST洗涤3次, 每次10 min, 加入1:5 000辣根过氧化物酶标记的山羊抗兔/抗小鼠二抗, 于37℃孵育1 h, 再次使用T-BST洗涤3次, 每次10 min。将高敏感度化学发光检测试液(康为世纪生物科技有限公司)均匀涂抹在滤膜上, 暗室反应10 min, 置ImageQuant LAS 500成像仪(美国GE公司)采集图像并测定蛋白条带灰度值。Western blot实验中选取Lamin B1作为细胞核内蛋白表达的参照进行分析, 细胞质采用GAPDH作为蛋白表达的参照进行分析。
1.5 克隆形成实验取对数生长期CaSki和HeLa细胞制成细胞悬液并计数, 按不同放射剂量分别接种不同数量的细胞于60 mm培养皿中, 0 Gy(200个)、0.5 Gy(200个)、1 Gy(400个)、2 Gy(1 000个)、4 Gy(4 000个)、6 Gy(10 000个)、8 Gy (20 000个), 于37℃、5%CO2及饱和湿度条件下常规培养24 h, 分别加入吉非替尼2 μmol/L, 西妥昔单抗65 nmol/L作用16 h后, 按照不同剂量进行单次放射, 每个照射剂量点设三个平皿。继续培养12天后, 去除培养基, 加入0.5%结晶紫-30%甲醇固定染色30 min, 低倍镜下计数≥ 50个细胞的克隆数。计算克隆形成率及存活分数, 采用GraphPad Prism5.0软件计算各组细胞存活率, 以单击多靶数学模型拟合剂量-存活曲线, 求出放射生物学参数D0、Dq、N、SF2和SER值。
1.6 统计学方法采用SPSS16.0软件进行统计学分析, 数据采用均数±标准差(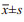
Western blot结果显示, 4 Gy放射后, 细胞质和细胞核内EGFR的表达均呈时间依赖性增加; CaSki和HeLa细胞放射后40 min, 与放射前比较细胞核内EGFR相对表达分别上调了2.9倍(P=0.011)和4.6倍(P=0.000), 细胞质内EGFR相对表达分别上调了2.3倍(P=0.024)和3.5倍(P=0.000), 见图 1, 提示放射可诱导CaSki和HeLa细胞核内EGFR表达增加。
|
| cEGFR: cytoplasm EGFR; nEGFR: nuclear EGFR; *: P < 0.05, **: P < 0.01, compared with 0 min. 图 1 CaSki和HeLa细胞照射后不同时间细胞质和细胞核EGFR表达变化 Figure 1 Relative expression of cEGFR and nEGFR in CaSki and HeLa cell lines at different time after radiation |
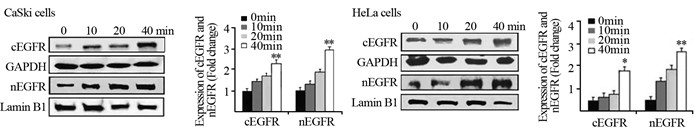
DNA-PK、pEGFR-T654和pDNA-PK-T2609均定位于细胞核, 放射前后细胞质中无表达。CaSki细胞放射后40 min, 与放射前比较细胞核内DNA-PK、pEGFR-T654和pDNA-PK-T2609相对表达量分别上调了3倍(P=0.002)、4.9倍(P=0.000)和3.8倍(P=0.001)。HeLa细胞放射后40 min, 与放射前比较细胞核内DNA-PK、pEGFR-T654和pDNA-PK-T2609相对表达分别上调了3.3倍(P=0.01)、4.8倍(P=0.000)、3.1倍(P=0.006), 见图 2。
|
| **: P < 0.01, compared with 0 min. 图 2 4Gy照射后不同时间CaSki和HeLa细胞核中pEGFR-T654、DNA-PK和pDNA-PK-T2609表达变化 Figure 2 Relative expression of pEGFR-T654, DNA-PK and pDNA-PK-T2609 in CaSki and HeLa cell lines at different time after 4 Gy radiation |
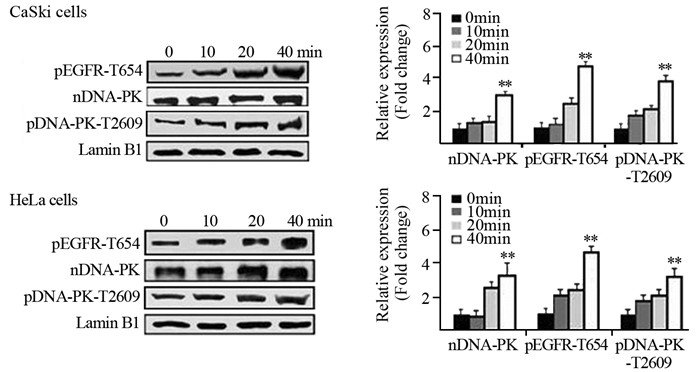
为了证实阻断pEGFR-T654及其核转位是否降低pDNA-PK-T2609的表达, 我们测定了CaSki和HeLa细胞经pEGFR-T654多肽预处理后, 细胞核内DNA-PK、pEGFR-T654和pDNA-PK-T2609的表达水平。与对照多肽比较, pEGFR-T654多肽呈时间依赖性地显著降低了CaSki细胞和HeLa细胞细胞核内DNA-PK、pEGFR-T654和pDNA-PK-T2609的表达, 见图 3。
|
| *: P < 0.05, compared with 0 min. 图 3 多肽和对照多肽不同时间预处理后CaSki和HeLa细胞核中pEGFR-T654、DNA-PK和pDNA-PK-T2609表达变化 Figure 3 Relative expression of pEGFR-T654, DNA-PK and pDNA-PK-T2609 in CaSki and HeLa cell lines with or without Thr654 inhibitory peptide |
西妥昔单抗和吉非替尼联合放射均降低了CaSki细胞核中pEGFR-T654表达, 提示西妥昔单抗和吉非替尼可能有阻断宫颈鳞癌照射后EGFR654位点磷酸化及其核转位的作用。同时观察到西妥昔单抗联合放射后细胞核pDNA-PK-T2609表达水平下调, 但在吉非替尼预处理组中无类似现象。在HeLa细胞中采用西妥昔单抗和吉非替尼联合放射预处理后, 细胞核中DNA-PK、pDNA-PK-T2609和pEGFR-T654变化均不明显, 见图 4。

|
| cn: without GFTN or C225; *: P < 0.05, compared with control group. 图 4 放射前后采用吉非替尼(GFTN)和西妥昔单抗(C225)预处理后CaSki和HeLa细胞细胞核中pEGFR-T654、pDNA-PK-T2609和DNA-PK表达变化 Figure 4 Relative expression of pEGFR-T654, pDNA-PK-T2609 and DNA-PK in CaSki and HeLa cell lines treated with Gefitinib (GFTN) or Cetuximab (C225) before and after radiation |
CaSki和HeLa细胞放射生物学参数见表 1。单因素方差分析结果显示, CaSki细胞中西妥昔单抗联合放射组与单纯放射组比较差异有统计学意义(PD0=0.001, PDq=0.002), 吉非替尼联合放射组与单纯放射组比较差异无统计学意义(PD0=0.131, PDq=0.183), CaSki细胞用西妥昔单抗预处理后放射敏感度明显增加(SF2=31.03; SER=2.34)。但HeLa细胞用西妥昔单抗(PD0=0.714, PDq=0.0481)和吉非替尼(PD0=0.826, PDq=0.279)预处理后放射敏感度差异均无统计学意义, 见图 5。
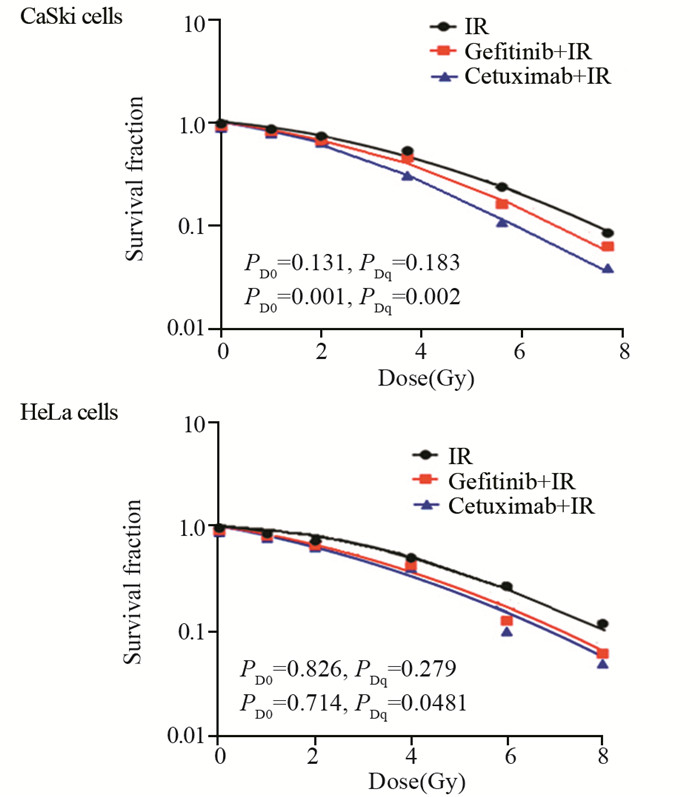
|
| IR: irradiation. 图 5 单击多靶模型拟合细胞存活-曲线 Figure 5 Dose-survival curves of CaSki and HeLa cells fitted by a single-hit multi-target model |
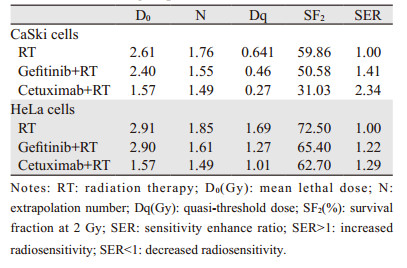
|
EGFR属于ErbB家族中的一员, 也被称作HER-1或ErbB-1。EGFR是一种跨膜糖蛋白, 包括胞外配体结合区、跨膜区和胞内区, 传统的受体学说认为EGFR是一种膜受体[6-7], 通过激活生存和增殖信号转导途径来增强肿瘤细胞对辐射的耐受性[8], 而有研究揭示EGFR的另一种放射抵抗机制:放射诱导EGFR转运入细胞核, 与DNA损伤非同源末端连接(NHEJ)修复途径的关键蛋白DNA-PK相互作用, 进而促进DNA损伤修复[9-10]。
本研究发现, 宫颈癌CaSki和HeLa细胞在放射前细胞核内存在内源性EGFR, 我们分析在细胞正常培养条件下, 培养基中含有多种激素类因子, 其中包括EGF, 除了电离辐射, EGF配体[11]、高热、缺氧、H2O2、顺铂等应激条件均可激活EGFR核转位[12], 导致在无辐射条件下细胞核内存在EGFR, 具体原因需进一步研究。放射后EGFR表达量增多, 我们推测放射可能诱导宫颈癌细胞EGFR核转位。有文献观察到放射后肺癌、乳腺癌、膀胱癌、卵巢癌、口腔癌、胰腺癌、脑胶质瘤中EGFR核转位的现象[9]。细胞核EGFR、pEGFR-T654表达量显著升高, 伴随放射后细胞核内DNA-PK和pDNA-PK-T2609表达量相应增加, 二者具有显著的相关性; 而使用pEGFR-T654多肽后, CaSki和HeLa细胞pEGFR-T654和pDNA-PK-T2609的表达呈时间依赖性显著降低。在我们的前期研究中也观察到类似的现象[13]。对于放射诱导的非配体依赖性EGFR核转位通路已有初步研究但其具体机制尚未完全阐明[4]:活化的EGFR与小窝蛋白形成EGFR/内陷小窝复合体, 通过内吞作用进入细胞质。进入细胞质的受体被循环利用再表达于细胞表面[14]; 也可以被分选进入内涵体, 内涵体逆行进入内质网, 通过内质网内相关降解体系EGFR脱离内涵体囊泡膜结构, 以游离形式再释放入胞浆; 也可以通过细胞内小泡作为转运载体, 逃避溶酶体的降解, 在核膜周围聚集[15]。核周EGFR通过核定位信号区(nuclear localization signal, NLS)与核胞质转运蛋白α或β形成核孔复合体进入细胞核[16]。NLS是一段临近跨膜区的多元序列, 含有3到5个基本残基, 这些残基是核转运时与核胞浆转运蛋白相结合所必需的, 目前认为EGFR家族成员皆具备这样一段保守序列。有学者通过蛋白质-蛋白质相互作用图谱揭示nEGFRNLS是晚期癌症进化过程中EGFR癌变的动态诱导因子[17]。放射促发EGFR内陷进入到核周, 随后EGFR通过NLS核胞质转运蛋白复合体进入细胞核, 这只是短暂的核聚集, 因为核胞质转运蛋白包含了一个核输出序列(nuclear export sequence, NES)使细胞核中的EGFR重新返回细胞质。放射诱发的核蛋白激酶Cε(protein kinase C, PKC-ε)活化促发核周EGFR-T654位点的磷酸化, 显著改变EGFR剩余残基的功能以及与核胞质转运蛋白的相互作用, 使转运过程分离, 最终解释了核转位的机制[18]。Dittmann等[16]多项研究揭示放射可诱导PKC-ε活化, 进一步促进EGFR在654位点磷酸化, 有利于EGFR与核膜上的NLS序列结合介导核转位, EGFR在细胞核内聚集, 激活pDNA-PK-T2609位点磷酸化, 导致了肿瘤细胞放射抵抗。
除此之外, Jette等[19]在放射过程中观察到EGFR和DNA-PK在细胞核内形成复合物, 复合物增强了DNA-PK活性和DNA的损伤修复能力。Yu等[20]提出了核EGFR/DNAPK复合物介导c-myc mRNA升高的机制, 导致细胞存活和抗辐射性。Muthusami等[21]报道了核EGFR和FTS(fused toes homolog)之间的物理联系, FTS是一种致癌基因, 与宫颈癌细胞的抗辐射性有关[22]。因此可以初步认为, 放射诱导宫颈癌细胞EGFR核转位与细胞核内DNA-PK存在密切关系, 细胞核内EGFR-T654位点磷酸化激活DNA-PK-T2609位点磷酸化, 促进非同源末端连接修复, 是造成宫颈癌放射抵抗的原因之一。因此, 阻断EGFR核转位将是降低由DNA-PK磷酸化介导的宫颈癌放射抵抗的重要靶点。
宫颈癌分子靶向药物的临床试验较少[23], 且无更多进展, 因此针对核内EGFR分子靶向治疗具有重要的实际意义。另外一项研究发现, EGFR靶向药物尼妥珠单抗联合放射促使γ-H2AX蛋白表达升高, 增加射线诱导的DNA双链断裂; 联合尼妥珠单抗使细胞核内EGFR及DNA-PK表达量下降, 从而阻止DNA双链的修复, 提高放射敏感度[24-25]。本研究结果显示, 西妥昔单抗可减少放射诱导的宫颈癌CaSki细胞EGFRT654核转位, 表现为西妥昔单抗联合放射组较单纯放射组EGFR-T654表达量降低, pDNA-PK-T2609的表达下调, 细胞的存活分数降低, 放射敏感度增加。在放射诱导核转位类似的研究中发现, 西妥昔单抗与EGFR受体结合内陷, 在细胞质内与小窝蛋白结合形成西妥昔单抗-小窝蛋白复合体, 阻止EGFR转运入细胞核[18], 或者与DNA-PK在细胞质内形成复合体从而阻断EGFR转运入核, 进一步降低细胞核内DNA-PK活性, 抑制DNA损伤修复[26-27]。我们初步推测, 西妥昔单抗能通过减少放射诱导EGFR-T654核转位来增加放射敏感度。而目前在靶向药物治疗方面, 针对核EGFR的研究尚处于基础阶段, 有待更多的临床试验。
吉非替尼是针对EGFR蛋白酪氨酸激酶的小分子抑制剂, 我们进一步探索其在宫颈癌EGFR核转位中的作用, 吉非替尼有阻断宫颈鳞癌照射后EGFR-T654位点磷酸化及其核转位的作用, 但与DNA-PK无相关性。EGFR在细胞核内除了与DNA-PK相互作用, 还包括作为一种新型转录因子与细胞周期或细胞增殖密切相关的靶基因相互作用, 促进肿瘤的发生发展[28-29]; 或者直接通过磷酸化激活PCNA[30-31], 促进DNA合成, 进而促进细胞增殖。我们观察到吉非替尼可降低CaSki和HeLa细胞存活率, 在一定程度上抑制肿瘤生长, 但放射后吉非替尼未显著降低细胞核内DNA-PK、pDNA-PK-T2609表达水平。吉非替尼主要通过竞争性抑制ATP与EGFR受体酪氨酸激酶部分结合, 从而抑制EGFR自身磷酸化, 阻断下游信号转导。电离辐射可激活PI3K-AKT[32]、Ras-MAPK等[33]信号转导通路, 这两条通路的激活被认为是EGFR过表达肿瘤放射抵抗的主要原因[34]。吉非替尼可能通过其他信号通路调控细胞周期和增殖, 增加放射敏感度[35], 而在EGFR核转位介导DNA损伤修复途径中作用甚微。
综上所述, EGFR-T654是放射诱导EGFR核转位的关键作用点, EGFR-T654入核后激活pDNA-PK-T2609, 在介导放射抵抗中发挥着重要作用。西妥昔单抗能减少放射诱导EGFR-T654核转位及DNA非同源末端连接修复的关键激酶pDNA-PK-T2609, 增加放射敏感度, 但放射联合西妥昔单抗能否成为宫颈癌治疗的新模式、EGFR-T654能否作为西妥昔单抗使用的分子检测靶点, 尚需进一步的临床研究。
作者贡献
李璐:设计及实施实验、撰写论文
黄建鸣:设计实验、撰写及审阅论文
冯梅:设计实验、获取研究经费、审阅论文
漆云翔、马士淇、谭明宇:设计及实施实验、采集数据
郎锦义:设计实验、获取研究经费、指导论文
| [1] |
Minig L, Patrono MG, Romero N, et al. Different strategies of treatment for uterine cervical carcinoma stageⅠB2-ⅡB[J]. World J Clin Oncol, 2014, 5(2): 86-92. DOI:10.5306/wjco.v5.i2.86 |
| [2] |
NCCN. NCCN clinical practice guidilines in oncology[EB/OL]. (2019-9-06). https://www.nccn.org/professionals/physician_gls/default.aspx.
|
| [3] |
Han W, Lo HW. Landscape of EGFR signaling network in human cancers:Biology and therapeutic response in relation to receptor subcellular locations[J]. Cancer Lett, 2012, 318(2): 124-134. DOI:10.1016/j.canlet.2012.01.011 |
| [4] |
Dittmann K, Mayer C, Rodemann HP. Nuclear EGFR as Novel Therapeutic Target:insights into nuclear translocation and function[J]. Strahlenther Onkol, 2010, 186(1): 1-6. DOI:10.1007/s00066-009-2026-4 |
| [5] |
Lang J, Lai X, Huang J, et al. Expression of mEGFR, pEGFRThr654 and pPKN1-Thr774 predict response to chemoradiation and prognosis in patients with cervical cancer[J]. Int J Radiat Oncol Biol Phys, 2013, 87(2): 663-664. |
| [6] |
Bossi P, Resteghini C, Paielli N, et al. Prognostic and predictive value of EGFR in head and neck squamous cell carcinoma[J]. Oncotarget, 2016, 7(45): 74362-74379. |
| [7] |
Cuneo KC, Nyati MK, Ray D, et al. EGFR targeted therapies and radiation:Optimizing efficacy by appropriate drug scheduling and patient selection[J]. Pharmacol Ther, 2015, 154: 67-77. DOI:10.1016/j.pharmthera.2015.07.002 |
| [8] |
Zadeh G, Bhat KP, Aldape K. EGFR and EGFRⅧ in glioblastoma:partners in crime[J]. Cancer Cell, 2013, 24(4): 403-404. DOI:10.1016/j.ccr.2013.09.017 |
| [9] |
Ahel J, Dordevic G, Markic D, et al. Nuclear EGFR characterize still controlled proliferation retained in better differentiated clear cell RCC[J]. Med Hypotheses, 2015, 85(2): 183-185. DOI:10.1016/j.mehy.2015.04.033 |
| [10] |
Brand TM, Iida M, Luthar N, et al. Nuclear EGFR as a molecular target in cancer[J]. Radiother Oncol, 2013, 108(3): 370-377. DOI:10.1016/j.radonc.2013.06.010 |
| [11] |
马士淇, 李璐, 刘惠芬, 等. 靶向抑制EGFR核转位对鼻咽癌细胞辐射耐受相关分子DNA-PK活化的作用[J]. 肿瘤预防与治疗, 2015, 28(6): 317-321, 334. [Ma SQ, Li L, Liu HF, et al. Inhibition of Targeting Nuclear Translocation of EGFR on Expression of DNA-PK Activation associated with Radioresistance in Nasopharyngeal Carcinoma Cells[J]. Zhong Liu Yu Fang Yu Zhi Liao, 2015, 28(6): 317-321, 334. DOI:10.3969/j.issn.1674-0904.2015.06.003] |
| [12] |
Chua CY, Liu Y, Granberg KJ, et al. IGFBP2 potentiates nuclear EGFRSTAT3 signaling[J]. Oncogene, 2016, 35(6): 738-747. DOI:10.1038/onc.2015.131 |
| [13] |
Qi YX, Huang JM, Yi GM, et al. The inhibition of EGFR nuclear translocation attenuates radioresistance through decreasing the expression of p-DNA-PK in cervical cancer cells[J]. Int J Clin Exp Med, 2017, 10(12): 16579-16585. |
| [14] |
Singh B, Coffey RJ. Trafficking of epidermal growth factor receptor ligands in polarized epithelial cells[J]. Annu Rev Physiol, 2014, 76: 275-300. DOI:10.1146/annurev-physiol-021113-170406 |
| [15] |
Iida M, Brand TM, Campbell DA, et al. Yes and Lyn play a role in nuclear translocation of the epidermal growth factor receptor[J]. Oncogene, 2013, 32(6): 759-767. DOI:10.1038/onc.2012.90 |
| [16] |
Dittmann K, Mayer C, Fehrenbacher B, et al. Radiation induced epidermal growth factor receptor nuclear import is linked to activation of DNA dependent protein kinase[J]. J Biol Chem, 2005, 280(35): 31182-31189. DOI:10.1074/jbc.M506591200 |
| [17] |
Sharip A, Abdukhakimova D, Wang X, et al. Analysis of origin and protein-protein interaction maps suggests distinct oncogenic role of nuclear EGFR during cancer evolution[J]. J Cancer, 2017, 8(5): 903-912. DOI:10.7150/jca.17961 |
| [18] |
Dittmann K, Mayer C, Fehrenbacher B, et al. Nuclear EGFR shuttling induced by ionizing radiation is regulated by phosphorylation at residue Thr654[J]. FEBS Lett, 2010, 584(18): 3878-3884. DOI:10.1016/j.febslet.2010.08.005 |
| [19] |
Jette N, Lees-Miller SP. The DNA-dependent protein kinase:a multifunctional protein kinase with roles in DNA double strand break repair and mitosis[J]. Prog Biophys Mol Biol, 2015, 117(2-3): 194-205. DOI:10.1016/j.pbiomolbio.2014.12.003 |
| [20] |
Yu YL, Chou RH, Wu CH, et al. Nuclear EGFR suppresses ribonuclease activity of polynucleotide phosphorylase through DNAPK-mediated phosphorylation at serine 776[J]. J Biol Chem, 2012, 287(37): 31015-31026. DOI:10.1074/jbc.M112.358077 |
| [21] |
Muthusami S, Prabakaran DS, Yu JR, et al. FTS is responsible for radiation-induced nuclear phosphorylation of EGFR and repair of DNA damage in cervical cancer cells[J]. J Cancer Res Clin Oncol, 2015, 141(2): 203-210. DOI:10.1007/s00432-014-1802-4 |
| [22] |
Anandharaj A, Cinghu S, Kim WD, et al. Fused toes homolog modulates radiation cytotoxicity in uterine cervical cancer cells[J]. Mol Biol Rep, 2011, 38: 5361-5370. DOI:10.1007/s11033-011-0688-3 |
| [23] |
Farley J, Sill MW, Birrer M, et al. Phase study of cisplatin plus cetuximab in advanced, recurrent, and previously treated cancers of the cervix and evaluation of epidermal growth factor receptor immunohistochemical expression:a Gynecologic Oncology Group study[J]. Gynecol Oncol, 2011, 121(2): 303-308. DOI:10.1016/j.ygyno.2011.01.030 |
| [24] |
Wang C, Fu X, Cai X, et al. High-dose nimotuzumab improves the survival rate of esophageal cancer patients who underwent radiotherapy[J]. Onco Targets Ther, 2015, 9: 117-122. |
| [25] |
Teng K, Zhang Y, Hu X, et al. Nimotuzumab enhances radiation sensitivity of NSCLC H292 cells in vitro by blocking epidermal growth factor receptor nuclear translocation and inhibiting radiation-induced DNA damage repair[J]. Onco Targets Ther, 2015, 8: 809-818. |
| [26] |
Dittmann K, Mayer C, Rodemann HP. Inhibition of radiationinduced EGFR nuclear import by C225(cetuximab) suppresses DNA-PK activity[J]. Radiother Oncol, 2005, 76(2): 157-161. DOI:10.1016/j.radonc.2005.06.022 |
| [27] |
何婧怡, 吴芳, 胡春宏, 等. 第三代EGFR-TKIs治疗晚期非小细胞肺癌的耐药机制及应对策略研究进展[J]. 肿瘤防治研究, 2019, 46(10): 938-945. [He JY, Wu F, Hu CH, et al. Research progress on resistance mechanisms and overcoming strategies to third-generation EGFR-TKIs in advanced non-small cell lung cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2019, 46(10): 938-945. DOI:10.3971/j.issn.1000-8578.2019.19.0169] |
| [28] |
Dittmann K, Mayer C, Paasch A, et al. Nuclear EGFR renders cells radio-resistant by binding mRNA species and triggering a metabolic switch to increase lactate production[J]. Radiother Oncol, 2015, 116(3): 431-437. DOI:10.1016/j.radonc.2015.08.016 |
| [29] |
Pereira NB, do Carmo AC, Diniz MG, et al. Nuclear localization of epidermal growth factor receptor (EGFR) in ameloblastomas[J]. Oncotarget, 2015, 6(12): 9679-9685. |
| [30] |
Tong D, Ortega J, Kim C, et al. Arsenic Inhibits DNA Mismatch Repair by Promoting EGFR Expression and PCNA Phosphorylation[J]. J Biol Chem, 2015, 290(23): 14536-14541. DOI:10.1074/jbc.M115.641399 |
| [31] |
Ortega J, Li JY, Lee S, et al. Phosphorylation of PCNA by EGFR inhibits mismatch repair and promotes misincorporation during DNA synthesis[J]. Proc Natl Acad Sci U S A, 2015, 112(18): 5667-5672. DOI:10.1073/pnas.1417711112 |
| [32] |
Maier P, Hartmann L, Wenz F, et al. Cellular Pathways in Response to Ionizing Radiation and Their Targetability for Tumor Radiosensitization[J]. Int J Mol Sci, 2016, 17(1): E102. DOI:10.3390/ijms17010102 |
| [33] |
Paglin S, Lee NY, Nakar C, et al. Rapamycin-sensitive pathway regulates mitochondrial membrane potential, autophagy, and survival in irradiated MCF-7 cells[J]. Cancer Res, 2005, 65(23): 11061-11070. DOI:10.1158/0008-5472.CAN-05-1083 |
| [34] |
Nyati MK, Morgan MA, Feng FY, et al. Integration of EGFR inhibitors with radiochemotherapy[J]. Nat Rev Cancer, 2006, 6(11): 876-885. DOI:10.1038/nrc1953 |
| [35] |
Harari PM, Huang S. Radiation combined with EGFR signal inhibitors:head and neck cancer focus[J]. Semin Radiat Oncol, 2006, 16(1): 38-44. DOI:10.1016/j.semradonc.2005.08.005 |
 2020, Vol. 47
2020, Vol. 47


