文章信息
- 冻融治疗后肝癌库普弗细胞分泌功能的变化
- Secretory Function of Kupffer Cells in Liver Cancer After Cryoablation
- 肿瘤防治研究, 2020, 47(1): 20-24
- Cancer Research on Prevention and Treatment, 2020, 47(1): 20-24
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.0801
- 收稿日期: 2019-06-18
- 修回日期: 2019-10-24
2. 430070 武汉, 中国人民解放军中部战区总医院放射治疗科
2. Department of Oncological Radiotherapy, Wuhan General Hospital of PLA, Wuhan 430070, China
在过去20年里, 局部肿瘤的冻融治疗已经有了长足的发展, 主要集中在肝癌[1]、转移性癌[2]、肾癌[3]、前列腺癌[4]等实体瘤治疗中。同时, 越来越多的报道表明, 冻融治疗可以破坏肿瘤, 增强或诱导细胞免疫或抗肿瘤免疫应答[5-7]。此外, 肿瘤细胞的破坏和溶解可能成为炎性反应的重要介质[8]。
库普弗细胞(Kupffer cells, KCs)是数量最大的免疫细胞, 占肝脏巨噬细胞的80%~90%, 也是单核吞噬细胞系统的重要组成部分, 在肝脏巨噬细胞的发生发展中起着重要的作用[9]。KCs的激活与多种细胞因子的分泌密切相关, 这些细胞因子参与免疫和促炎或抗炎反应[10]。KCs自身还具有分泌炎性因子的功能, 参与肝脏中各种重要的生理和病理过程, 如炎性反应、脂质代谢、移植免疫等[11]。
因此, 有必要研究冻融后KCs分泌功能的特征, 帮助我们治疗肝癌, 促进患者的早期康复, 为肝癌冻融治疗能提高自身免疫功能的学说提供理论依据。为此, 本研究通过体外细胞实验, 从兔肝中提取KCs并进行了体外培养, 应用NF-κB抑制剂吡咯烷二硫代氨基甲酸酯(PDTC)阻断NF-κB信号通路后, 观察KCs的分泌功能变化, 探索冻融治疗引起KCs功能变化的机制。
1 材料与方法 1.1 材料NF-κB抑制剂PDTC购自美国BioVision公司; 胎牛血清购自杭州四季青生物工程材料有限公司; 低糖DMEM完全培养基购自美国ATCC公司; 0.4%锥虫蓝溶液购自美国Sigma公司; GAPDH购自英国Abcam公司; 蛋白Marker(10~170 kDa)购自立陶宛Fermentas公司; 0.45 μm PVDF膜购自美国Millipore公司; SDS-PAGE凝胶制备试剂盒、蛋白抽提试剂盒、BCA蛋白浓度测定试剂盒、ECL化学发光试剂盒、PMSF(100 mmol/L)、磷酸化蛋白酶抑制剂、5×蛋白上样缓冲液、10×丽春红染液和抗体洗脱液均购自武汉拓捷生物公司; Tris和甘氨酸购自国药集团化学试剂有限公司(上海); 动物麻醉剂(速眠新Ⅱ)购自中国动物保健品有限公司(北京), 其他试剂由中国人民解放军中部战区总医院医学实验科提供。
1.2 方法 1.2.1 KCs细胞悬液的制备经肌肉注射速眠新Ⅱ(0.2 ml/kg)麻醉后, 对其进行消毒、开腹、门静脉暴露和固定插管并打开胸腔。根据Zeng等[12]制备KCs细胞悬液的方法, 对下腔静脉结扎后, 快速切割、断裂部分肝脏, 用PBS冲洗两次。取肝悬液离心, 取上清液。充分悬浮后, 将上述肝细胞悬液移入含30%和60%细胞分离液的离心管中, 以800 g(20℃)缓升缓降离心20 min, 离心后可见乳白色细胞层。收集细胞层, 继续培养。
1.2.2 构建低温和冻融坏死的肿瘤细胞攻击KCs的细胞模型模拟冻融治疗时体内KCs受到的主要攻击因素是低温和冻融坏死物质, 构建体外细胞模型。将浓度为1×106/ml的KCs悬浮液用5 ml一次性塑料吸管分为不同的培养瓶, 每瓶加入5 ml。实验分为8组, 每组9瓶:(1)对照组:KCs正常培养37℃; (2)0℃组:模拟冻融治疗时冰球边缘温度, 将培养瓶置于0℃环境中20 min, 取出放回37℃孵化器。5 min后, 将培养瓶置于0℃环境中20 min, 再放入37℃培养箱中, 培养6 h后, 进行实验; (3)5℃低温组和10℃低温组:模拟冻融治疗时冰球边缘距离0.5 cm和2 cm的温度。实验方法与0℃组相同, 但放置培养瓶的温度环境不同。5℃组在5℃环境中放置2次20 min, 10℃组在10℃环境中放置2次20 min; (4)冻融坏死物质组:冻融治疗后第3天将治疗中心肿瘤组织(人肝癌HepG2细胞购于中国科学院上海科学院资源中心, 于中国人民解放军中部战区总医院医学实验科内进行传代培养)制成1%细胞悬液, 在KCs培养瓶中加入2 ml, 其余培养条件与对照组相同; (5)联合刺激组:按不同温度(0℃、5℃、10℃)放置的KCs培养瓶分为3组。各组再加入冻融肿瘤坏死细胞悬液, 其浓度与冻融坏死物质组相同, 实验方法分为0℃、5℃和10℃组。
1.2.3 干预措施以上8组各设1个平行组。将PDTC加入培养基中, NF-κB抑制剂最终浓度为100 μmol/L。
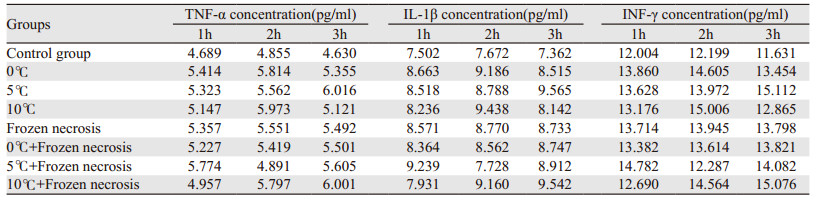
1.2.4 KCs分泌功能的检测参考文献中的方法[13], 采用ELISA法检测KCs上清液中肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1β)和干扰素-γ(INF-γ)的浓度。各组采用ELISA法检测细胞培养液中的IFN-γ、IL-1β、TNF-α的浓度。
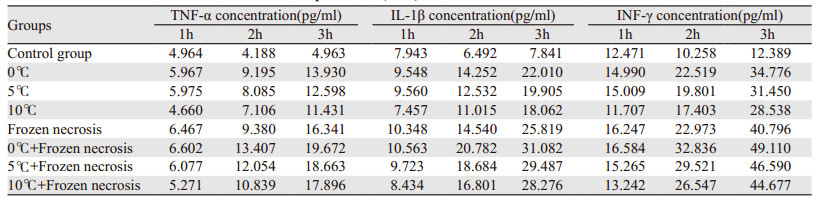
1.2.5 NF-κB蛋白测定各组培养6 h后, 用Western blot法检测各组NF-κB蛋白的表达, 用定量软件处理系统分析靶带的吸光度值。Western blot检测方法如文献所述[14]。用鼠抗NF-κB抗体(sc-109, Santa Cruz生物技术, 美国圣克鲁斯州)进行印迹检测, 计算靶带的吸光度值。
1.3 统计学方法采用SPSS19.0统计学软件进行统计学分析。计数资料以均数±标准差(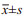
(1) 无抑制剂组与对照组比较:低温组(0℃、5℃、10℃)和10℃冻融坏死物质组培养1 h时KCs细胞分泌炎性因子水平差异无统计学意义(P>0.05), 冻融坏死物质组与联合刺激组比较KCs细胞分泌炎性因子水平差异有统计学意义(P < 0.05), 10℃冻融坏死物质组与对照组比较KCs细胞分泌炎性因子水平差异有统计学意义(P < 0.05)。各组培养1 h, 与对照组比较(P < 0.01), 差异有统计学意义。(2)无抑制剂组KCs细胞分泌炎性因子水平与培养时间的相关性:随着培养时间的延长(1、2、3 h), 炎性因子的分泌水平显著升高, 差异有统计学意义(χ2=10.750, P=0.005)。(3)抑制剂组与对照组比较:各组KCs细胞分泌炎性因子水平比较(P>0.05), 差异无统计学意义; 组内KCs细胞分泌炎性因子水平比较, 差异无统计学意义(χ2=2.25, P=0.325)。(4)有抑制剂组和无抑制剂组KCs细胞分泌炎性因子水平比较, 两组在相同条件下(对照组除外)均有统计学意义(P < 0.01)。
KCs分泌功能结果显示, 用低温或冻融坏死物或联合刺激KCs后培养1 h, 炎性因子的分泌增加(P < 0.01), 低温和冻融坏死产物组的联合刺激具有叠加作用。此外, 随着培养时间的延长(1、3、6 h), 炎性因子的分泌水平显著升高(χ2=10.750, P=0.005), 有级联放大的趋势。在PDTC存在下, 8组间炎性因子的分泌水平差异无统计学意义(P=0.325)。延迟培养时间, 各组KCs细胞分泌炎性因子水平无变化, 见表 1~2。
|
低温刺激对NF-κB蛋白的表达无显著影响, 而对照组与低温组之间比较差异无统计学意义(P>0.05)。联合刺激组和冻融坏死物质组NF-κB蛋白表达明显上调(P < 0.05), 差异有统计学意义。而抑制剂组NF-κB蛋白的表达无明显变化, 其线型几乎呈直线状, 见图 1~3。
|
| 图 1 无抑制剂时NF-κB蛋白的表达 Figure 1 Expression of NF-κB protein in group without inhibitor |
|
| 图 2 有抑制剂时对NF-κB蛋白表达的影响 Figure 2 Effect of inhibitor on expression of NF-κB protein |
|
| 1: Control group; 2: 0℃; 3: 5℃; 4: 10℃; 5: Frozen necrosis; 6: 0℃+Frozen necrosis; 7: 5℃+Frozen necrosis; 8: 10℃+Frozen necrosis 图 3 NF-κB蛋白的表达 Figure 3 Expression of NF-κB protein |
KCs凭其吞噬和分泌功能, 参与了肝脏多种重要的生理和病理过程, 如清除坏死细胞和组织碎片, 诱导炎性反应、参与脂质代谢、移植免疫等[15-17]。KCs功能受内毒素、脂多糖、坏死组织或细胞、应激等多种因素的影响[10]。活化的KCs能产生多种细胞因子, 包括TNF-α、IL-1β和INF-γ等, 对靶细胞产生杀伤作用, 从而发挥其生物学作用[18]。冻融治疗主要利用温度急剧变化, 破坏肿瘤细胞, 同时对治疗区周围组织产生低温刺激, 诱发机体应激反应。而应激和坏死肿瘤细胞释放的如水解蛋白酶等细胞有害物均可引起KCs的变化[19]。
KCs受到低温或冻融坏死物质刺激后, 可促进炎性因子的分泌, 如TNF-α、IL-1β和INF-γ, 这些炎性因子可诱导炎性细胞聚集、介导炎性反应和清除坏死细胞或组织碎片[20], 这一反应过程可能是冻融治疗后残存肿瘤的一个杀伤机制。此外, 本研究还发现, 在培养瓶中加入NF-κB抑制剂后, 低温组、冻融坏死物质组和联合刺激组的炎性细胞因子水平均无变化, 说明用NF-κB抑制剂可以抑制炎性因子的分泌过程。同时, 还发现TNF-α、IL-1β和INF-γ的浓度与KCs上清液中NF-κB蛋白表达呈正相关, 所以冻融治疗后KCs的分泌功能可能通过NF-κB信号通路调控。
NF-κB是一个转录因子家族, 调控大量参与细胞存活、炎性反应和免疫反应等重要生理过程的基因。最近有研究表明, NF-κB的组成型表达与多种类型的癌症有关[21]。NF-κB信号通路也是炎性反应相关的癌症发生的重要因素[22]。本研究通过对NF-κB信号通路相关蛋白的检测, 探讨了KCs诱导炎性反应的机制。NF-κB是细胞内重要的核转录因子, 是细胞免疫和炎性反应的重要组成部分[23], 它参与多种基因的表达和调控[24]。关于KCs活化的信号转导途径, 认为NF-κB是调节KCs活化的关键因素[25], NF-κB在某些细胞信息转录调控中起着关键作用[26], 它是细胞活化的标志, 也是激活炎性反应的重要因素[27]。有研究证实, NF-κB信号通路是肿瘤治疗的潜在靶点[28]。如果这一信号通路在冻融治疗引起的免疫功能变化中发挥类似作用, 将有助于探讨冻融治疗后免疫功能变化的机制。其最直接的判断方法即阻断NF-κB信号通路。吡咯烷二硫代氨基甲酸酯在NF-κB活化通道的不同水平发挥抑制NF-κB蛋白表达的作用, 从而阻断NF-κB信号通路, 阻断是否成功可以通过检测NF-κB信号通路中的通路终末蛋白NF-κB蛋白的表达情况判断。
在KCs培养瓶中加入冻融坏死物质, 其中含有细胞毒素等刺激信号, 这些信号可与KCs膜表面受体结合, 如与清道夫受体(scavenger receptor, SR)结合, 被吞噬到KCs内; 再经过多级级联反应, 使NF-κB的抑制蛋白(IKB)的上游激酶IKB激酶(IKB kinse, IKK)磷酸化而激活, IKK使IKB降解。P50有核定位信号, 当失去了IKB的束缚后, P50会携载RelA(P65)向核内迁移, P65与细胞核内基因启动子或增强子区域上的顺势反应元件结合, 从而调控靶基因的转录, 诱导NF-κB mRNA的产生, 最后转录、产生和释放各种细胞因子(如TNF-α、IL-1β等)[29]。本研究检测结果提示加入冻融坏死物质后, NF-κB蛋白表达上调, 炎性因子分泌增加, 说明NF-κB信号通路的存在; 而加入PDTC后, PDTC作为一种抗氧化剂, 可以在NF-κB活化通道的不同水平发挥抑制NF-κB蛋白表达的作用, 如阻止上游IKK磷酸化, 从而阻止NF-κB信号通路, 抑制NF-κB蛋白表达, 导致炎性因子分泌减少。反向证明冻融治疗后KCs的变化可能通过NF-κB信号通路发挥作用。
综上所述, 冻融治疗可以改变KCs周围的微环境, 刺激KCs分泌细胞因子的功能, 从而诱导炎性反应, 清除肿瘤细胞。另外还证实KCs分泌功能变化可能是通过NF-κB信号通路转导的。
作者贡献
朱亚玲、易峰涛:参与实验、论文撰写
丁梦南、曾程、徐振华:课题设计及论文修改
邵志雄、谢俊杰:实验数据分析及论文审核
| [1] |
Niu LZ, Li JL, Xu KC. Percutaneous Cryoablation for Liver Cancer[J]. J Clin Transl Hepatol, 2014, 2(3): 182-188. |
| [2] |
Susa M, Kikuta K, Nakayama R, et al. CT guided cryoablation for locally recurrent or metastatic bone and soft tissue tumor:initial experience[J]. BMC Cancer, 2016, 16(1): 798. DOI:10.1186/s12885-016-2852-6 |
| [3] |
Hongo F, Yamada Y, Ueda T, et al. Preoperative lipiodol marking and its role on survival and complication rates of CT-guided cryoablation for small renal masses[J]. BMC Urol, 2017, 17(1): 10. DOI:10.1186/s12894-017-0199-1 |
| [4] |
Yılmaz S, Özdoğan M, Cevener M, et al. Use of cryoablation beyond the prostate[J]. Insights Imaging, 2016, 7(2): 223-232. DOI:10.1007/s13244-015-0460-7 |
| [5] |
Sidana A. Effect of renal embolization and cryoablation on regulatory T cells in advanced renal cell carcinoma[J]. Cryobiology, 2013, 66(2): 95. DOI:10.1016/j.cryobiol.2012.12.001 |
| [6] |
Haen SP, Pereira PL, Salih HR, et al. More Than Just Tumor Destruction:Immunomodulation by Thermal Ablation of Cancer[J]. Clin Dev Immunol, 2011, 2011: 160250. |
| [7] |
Si TG, Wang JP, Guo Z. Analysis of circulating regulatory T cells (CD4+CD25+CD127-) after cryosurgery in prostate cancer[J]. Asian J Androl, 2013, 15(4): 461-465. DOI:10.1038/aja.2013.22 |
| [8] |
Stuart WD, Kulkarni RM, Gray JK, et al. Ron receptor regulates Kupffer cell-dependent cytokine production and hepatocyte survival following endotoxin exposure in mice[J]. Hepatology, 2011, 53(5): 1618-1628. DOI:10.1002/hep.24239 |
| [9] |
Yuan F, Zhang W, Mu D, et al. Kupffer cell in the immune activation and tolerance toward HBV/HCV infection[J]. Adv Clin Exp Med, 2017, 26(4): 739-745. DOI:10.17219/acem/62759 |
| [10] |
Tsutsui H, Nishiguchi S. Importance of Kupffer cells in the development of acute liver injuries in mice[J]. Int J Mol Sci, 2014, 15(5): 7711-7730. DOI:10.3390/ijms15057711 |
| [11] |
Zhu R, Guo W, Fang H, et al. Kupffer cell depletion by gadolinium chloride aggravates liver injury after brain death in rats[J]. Mol Med Rep, 2018, 17(5): 6357-6362. |
| [12] |
Zeng WQ, Zhang JQ, Li Y, et al. A New Method to Isolate and Culture Rat Kupffer Cells[J]. PLoS One, 2013, 8(8): e70832. DOI:10.1371/journal.pone.0070832 |
| [13] |
Chen XJ, Tang ZZ, Zhu GG, et al. JNK signaling is required for the MIP-1α-associated regulation of Kupffer cells in the heat stroke response[J]. Mol Med Rep, 2017, 16(3): 2389-2396. DOI:10.3892/mmr.2017.6922 |
| [14] |
Thirukkumaran C, Shi ZQ, Thirukkumaran P, et al. PUMA and NF-κB Are Cell Signaling Predictors of Reovirus Oncolysis of Breast Cancer[J]. PLoS One, 2017, 12(1): e0168233. DOI:10.1371/journal.pone.0168233 |
| [15] |
Duarte N, Coelho IC, Patarrão RS, et al. How Inflammation Impinges on NAFLD:A Role for Kupffer Cells[J]. Biomed Res Int, 2015, 2015: 984578. |
| [16] |
Dixon LJ, Barnes M, Tang H, et al. Kupffer Cells in the Liver[J]. Compr Physiol, 2013, 3(2): 785-797. |
| [17] |
Matsumura H, Kondo T, Ogawa K, et al. Kupffer cells decrease metastasis of colon cancer cells to the liver in the early stage[J]. Int J Oncol, 2014, 45(6): 2303-2310. DOI:10.3892/ijo.2014.2662 |
| [18] |
Hoth JJ, Wells JD, Jones SE, et al. Complement mediates a primed inflammatory response after traumatic lung injury[J]. J Trauma Acute Care Surg, 2014, 76(3): 601-608. DOI:10.1097/TA.0000000000000129 |
| [19] |
Ozeki Y, Tsutsui H, Kawada N, et al. Macrophage scavenger receptor down-regulates mycobacterial cord factor-induced proinflammatory cytokine production by alveolar and hepatic macrophages[J]. Microb Pathog, 2006, 40(4): 171-176. DOI:10.1016/j.micpath.2005.12.006 |
| [20] |
王永奇, 李志勇, 曹晓芳, 等. 肿瘤坏死因子-α对间充质干细胞体内外免疫调节活性的影响[J]. 中国实验血液学杂志, 2012, 20(4): 981-984. [Wang YQ, Li ZY, Cao XF, et al. Effects of tumor necrosis factor-α on immunoregulatory activities of mesenchymal stem cells in vitro and in vivo[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2012, 20(4): 981-984.] |
| [21] |
Pires BRB, Silva RCMC, Ferreira GM, et al. NF-kappaB:Two Sides of the Same Coin[J]. Genes(Basel), 2018, 9(1): E24. |
| [22] |
Burkitt MD, Hanedi AF, Duckworth CA, et al. NF-κB1, NF-κB2 and c-Rel differentially regulate susceptibility to colitis-associated adenoma development in C57BL/6 mice[J]. J Pathol, 2015, 236(3): 326-336. DOI:10.1002/path.4527 |
| [23] |
Lin TH, Pajarinen J, Lu L, et al. NF-κB as a Therapeutic Target in Inflammatory-Associated Bone Diseases[J]. Adv Protein Chem Struct Biol, 2017, 107: 117-154. DOI:10.1016/bs.apcsb.2016.11.002 |
| [24] |
Ruan Q, Chen YH. Nuclear factor-kappaB in immunity and inflammation:the Treg and Th17 connection[J]. Adv Exp Med Biol, 2012, 946: 207-221. |
| [25] |
Li T, Zhu JY, Wang FS, et al. Down-Regulation of Donor Kupffer Cell B7 Expression Reduced Recipient Lymphocyte Activation and Secretion of Interleukin-2 In Vitro[J]. Transpl Proc, 2015, 47(10): 2985-2990. DOI:10.1016/j.transproceed.2015.10.038 |
| [26] |
Hoesel B, Schmid JA. The complexity of NF-kappaB signaling in inflammation and cancer[J]. Mol Cancer, 2013, 12: 86. DOI:10.1186/1476-4598-12-86 |
| [27] |
Dong J, Jimi E, Zeiss C, et al. Constitutively active NF-κB triggers systemic TNFα-dependent inflammation and localized TNFα-independent inflammatory disease[J]. Genes Dev, 2010, 24(16): 1709-1717. DOI:10.1101/gad.1958410 |
| [28] |
Madonna G, Ullman CD, Gentilcore G, et al. NF-κB as potential target in the treatment of melanoma[J]. J Transl Med, 2012, 10: 53. DOI:10.1186/1479-5876-10-53 |
| [29] |
Fouad D, Ataya FS, Muntane J. Expression of p53 during Apoptosis Induced by D-Galactosamine and the Protective Role of PGE1 in Cultured Rat Hepatocytes[J]. Pak J Biol Sci, 2011, 14(21): 976-983. DOI:10.3923/pjbs.2011.976.983 |
 2020, Vol. 47
2020, Vol. 47