文章信息
- 非小细胞肺癌术后复发转移的风险模型构建及预测能力的验证
- Construction of Risk Model for Postoperative Recurrence and Metastasis of Non-small Cell Lung Cancer and Verification of Predictive Ability
- 肿瘤防治研究, 2020, 47(4): 273-277
- Cancer Research on Prevention and Treatment, 2020, 47(4): 273-277
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.0796
- 收稿日期: 2019-06-17
- 修回日期: 2019-09-29
2. 063000 唐山,华北理工大学附属唐山市人民医院骨科
2. Department of Orthopedics, Tangshan People's Hospital Affiliated to North China University of Technology, Tangshan 063000, China
肺癌的发病率和死亡率在全世界范围内呈现出逐年增加的趋势[1-2]。非小细胞肺癌(non-small cell lung cancer, NSCLC)占所有肺癌患者的80%~85%,手术仍是NSCLC最重要的治疗方法,但受局部的复发和远处转移[3-4]的影响,手术患者的长期预后仍不尽如人意。目前还没有用于预测NSCLC术后复发转移的临床风险模型。本研究旨在通过筛选NSCLC患者术后复发转移的危险因素,构建NSCLC患者术后复发转移的预测模型,并确定复发转移高风险患者,可进行早期干预,提高患者生存率。
1 资料与方法 1.1 一般资料收集华北理工大学附属唐山市人民医院2011年5月—2014年5月行手术治疗的323例NSCLC患者的病历资料。其中36例患者失访,9例围手术期死亡。共纳入278例具备完整临床和随访数据的患者为建模组,作单因素、多因素分析以及实际转移率的ROC曲线,记录曲线下面积、特异性及敏感度,以约登指数作为判断有无转移的截断值。后连续收集2014年7月—2015年12月的67例NSCLC患者资料作为模型预测能力的验证组。
1.2 纳入标准及排除标准纳入标准:(1)术后病理分期为Ⅰ~Ⅲ A期;(2)初治的原发性NSCLC,单发病灶;(3)病历资料及随访结果完整。排除标准:(1)术前发现肺部多发病灶或已有远处转移者;(2)伴有其他恶性肿瘤病史;(3)术后病理为非非小细胞癌;(4)因各种原因未清扫淋巴结,术后未获得准确病理分期;(5)非肿瘤原因死亡;(6)病历资料及随访结果不完整;(7)术后标本切缘有癌细胞残存。
1.3 参数的选择与收集遵循“客观、常规、与生理功能密切相关”的原则,同时根据唐山市人民医院的实际情况,选择常规指标作为替代参数。经过筛选,初步确定了10项指标,包括年龄、吸烟史、肿瘤直径、肿瘤部位、肿瘤组织类型、肿瘤分化程度、纵隔淋巴结转移、脏层胸膜受累、术后病理分期、术后辅助化疗周期。
1.4 统计学方法使用SPSS22.0统计软件进行统计学分析。通过频率描述计数数据,用χ2检验进行组间的比较。使用二分类Logistic回归模型分析风险因素,计算OR值并建立风险预测模型。模型预测效能检验采用受试者工作曲线特征进行分析。P < 0.05表示两组之间差异有统计学意义。
2 结果 2.1 患者随访复查情况患者在术后2年内每3~6月复查一次,术后3~5年内每6~12月复查一次,术后5年以后每1年复查一次。复查项目包括肿瘤标志物、头部CT、胸部CT和腹部彩色多普勒超声。每年进行头部MRI及全身骨扫描。局部复发指边缘、肺门和纵隔淋巴结的复发。远处转移指除上述之外的肿瘤病变。复发转移时间指手术时间至NSCLC复发转移的时间间隔。随访终点为患者死亡或者肿瘤复发转移,随访时间截至2019年5月31日。
2.2 影响NSCLC术后复发转移发生的单因素分析经卡方检验分析发现,年龄、吸烟史、肿瘤部位、肿瘤组织类型、脏层胸膜受累情况以及术后辅助化疗周期不是NSCLC患者术后复发转移的相关危险因素。肿瘤直径,肿瘤分化程度,纵隔淋巴结转移和术后病理分期是影响NSCLC患者复发转移的危险因素(均P < 0.05),见表 1。
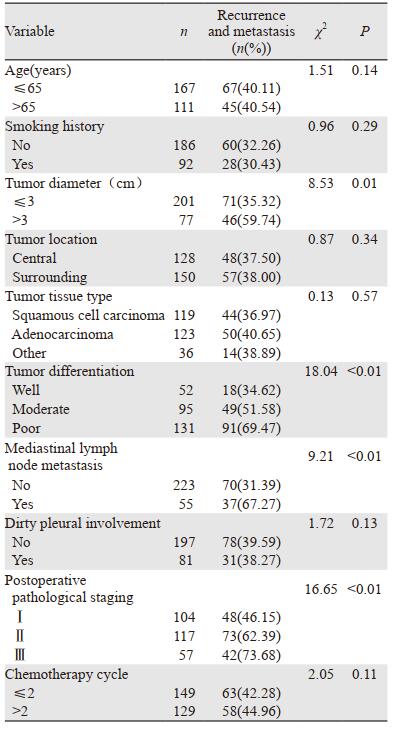
|
将单因素分析中有意义的指标全部纳入回归分析,结果显示肿瘤分化程度、纵隔淋巴结转移、术后病理分期是影响患者术后复发转移的独立危险因素,差异均有统计学意义(均P < 0.05)。其中肿瘤分化程度以高分化为基准,每降低一个单位其发生术后复发转移的风险将是原来的2.223倍;发生纵隔淋巴结转移的患者复发转移的风险将是无淋巴结转移患者的2.696倍;患者术后病理分期每增高一期其发生复发转移的风险将是前一期患者的4.903倍,见表 2。
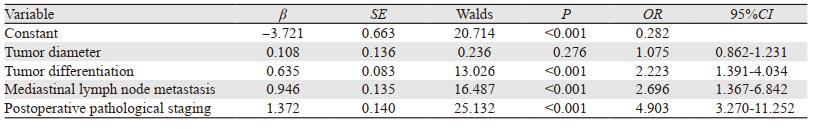
|
将独立危险因素纳入二分类Logistic回归模型中,建立预测模型: Logit P=Ln(P/1-P) =-3.721+0.635×肿瘤分化程度+0.946×纵隔淋巴结转移+1.372×术后病理分期。模型似然比检验:χ2=34.976, P < 0.001。拟合优度检验:χ2=3.203, P=0.862。表明模型拟合程度较好。
2.5 回归方程的ROC曲线Youden指数最大值为0.867,截断值为0.664,敏感度为73.64%,特异性93.86%,曲线下面积为0.867。将截断值0.664回带入回归方程,总计百分比为84.65%,见图 1。表明模型预测价值高。
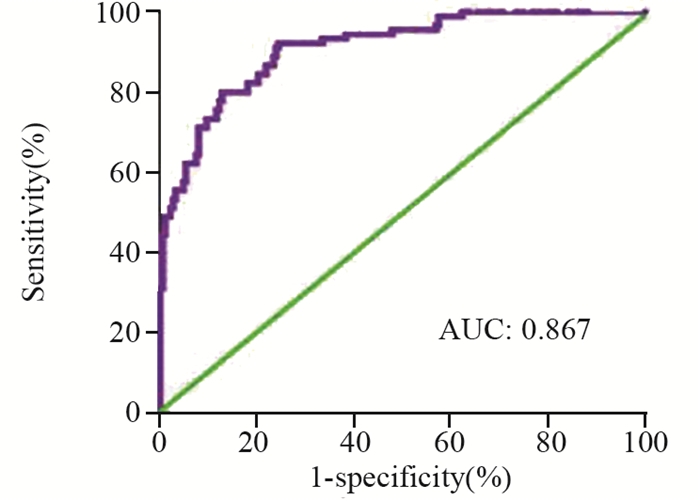
|
| 图 1 回归方程的ROC曲线 Figure 1 ROC curve of regression equation |
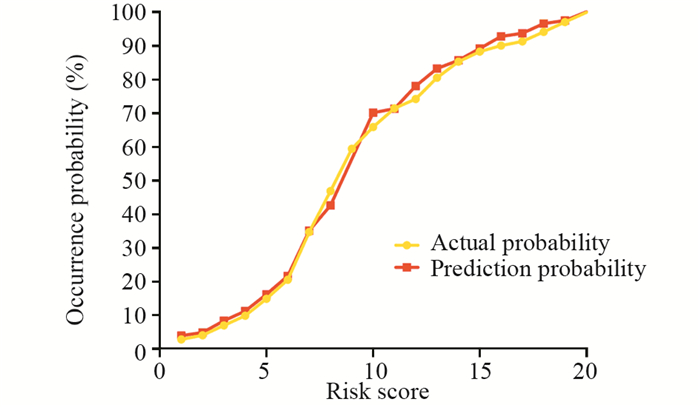
验证组67例患者,男47例,女20例,其中18例发生术后复发转移。将验证组患者各因素带入预测模型,利用ROC曲线检验该模型预测效能,结果发现,ROC曲线下面积为0.83,Hosmer-Lemeshow拟合优度检验显示,χ2=10.11, P=0.28。说明模型实际预测能力良好,见图 2~3。
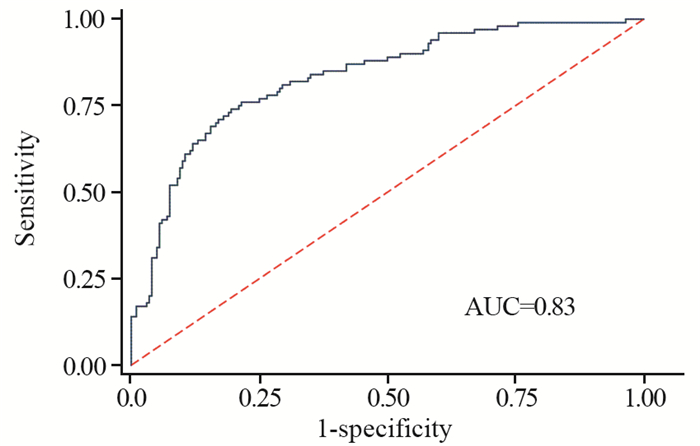
|
| 图 2 预测模型效能的ROC曲线 Figure 2 ROC curve for predicting model effectiveness |
|
| 图 3 预测模型预测效能的拟合优度曲线 Figure 3 Fitting curve of prediction probability of the model |
肿瘤的局部复发和远处转移是NSCLC治疗失败和死亡的最主要原因[4]。日本学者在早期的研究中就发现,完整切除术后Ⅰ期、Ⅱ~Ⅲ期NSCLC的复发率分别为20.3%、45.5%,转移率为26.6%、47.7%[5]。叶轩婷等[6]报道,NSCLC术后发生复发转移的患者,其5年生存率约为23.3%,无转移者5年生存率约为46.8%。由此可见,NSCLC患者术后复发转移是影响患者预后的关键因素。因此,研究影响NSCLC患者术后复发转移的危险因素,构建风险预测模型,可以前瞻性预测NSCLC术后复发转移的风险,有利于指导术后的综合治疗,为制定最佳诊疗策略提供重要的理论支持。
目前,胸外科的预测模型构建主要集中于孤立性肺结节的相关研究,包括公认度较高的Mayo模型、VA模型及国内的北大模型[7]。上述三个风险评估模型均为基于多中心大样本量数据得到的,也在很多国家得以验证,具有良好的风险预测能力。目前国内外尚未见对NSCLC患者术后复发转移的风险预测模型进行报道。在本研究中,我们基于临床、病理特征和影像学检查参数构建一套风险预测模型,模型的构建主要涉及肿瘤分化程度、纵隔淋巴转移及术后病理分期三个变量。信度、效度及ROC曲线下面积等方面均提示模型的拟合能力较好。
病理分期仍被认为是预测肺癌预后的最佳标准之一。研究表明,病理分期是NSCLC术后复发转移的独立危险因素。病理分期主要由肿瘤直径和淋巴结转移决定。而本研究中肿瘤直径和纵隔淋巴结转移均是NSCLC术后复发转移的独立危险因素。江涵等[8]研究发现肿瘤分化程度是NSCLC患者术后复发转移的危险因素。合并纵隔淋巴结转移的NSCLC患者术后复发转移率明显升高。
本研究的单因素分析显示,年龄、吸烟史、肿瘤部位、肿瘤组织类型、脏层胸膜受累情况以及术后辅助化疗周期不是NSCLC患者术后复发转移的危险因素。葛会景等[9]报道称NSCLC患者术后,年龄不是影响预后的相关因素。陶洪等[10]研究显示NSCLC患者术后复发转移在吸烟者与不吸烟者间差异无统计学意义。在NSCLC的病理类型中,血行转移可发生在腺癌早期,淋巴结转移发生在腺癌晚期。相反,淋巴结转移发生在鳞癌早期,血行转移可发生在鳞癌晚期。目前,关于不同病理类型对预后影响仍存在争议,尚不能证明病理类型对NSCLC患者术后复发转移有影响。宋勇等[11-12]研究表明,中央型NSCLC患者手术后更容易出现局部复发转移。原因是中央型肺癌主要出现在段支气管和以近支气管,而周围型肺癌主要出现在段支气管以远的细支气管,根据淋巴液回流特点,中央型肺癌的肺内淋巴管距纵隔淋巴结的距离明显短于周围型肺癌,因此更易引起纵隔淋巴结转移,从而导致NSCLC患者术后复发转移[13]。但在本研究中,NSCLC的临床类型(周围型及中央型)与局部复发或者远处转移的关系并不明显,可能是因为病例数偏少,以致未能检测出其中细微差异。金澄宇[14]等研究表明,术后辅助化疗对Ⅰ期患者无益,但对Ⅱ期和Ⅲ期患者有显著益处。而本研究的结果显示化疗周期在NSCLC术后是否复发转移中差异无统计学意义。导致这种结果可能的原因是本组资料中早期患者所占比例较大以及总体病例数较少。NSCLC患者术后复发转移的发生是多因素共同作用的结果,因此相关预测模型的建立需要在筛查高危因素的基础上全面评估。本研究在多因素Logistic分析基础上,对模型进行简化转变,构建了更简洁明了的评价模型,P=-3.721+0.635×肿瘤分化程度+0.946×纵隔淋巴转移+1.372×术后病理分期。我们用ROC曲线对该模型进行综合评价,它是一种全面准确评价诊断试验的有效工具,ROC的AUC越大,诊断的意义越大,AUC接近0.5时几乎没有诊断价值,AUC < 0.7时诊断具有较低准确率,AUC在0.7~0.9代表诊断准确性一般,AUC > 0.9时表示诊断有较高的准确性。本研究ROC的AUC为0.867,提示模型预测价值较高。我们连续性收集了2014年7月—2015年12月收治的67例患者资料作为验证模型预测能力的验证组。将验证组患者各因素带入预测模型,利用ROC曲线检验本模型预测效能,结果发现,ROC曲线下面积为0.83,Hosmer-Lemeshow拟合优度检验显示,χ2值=10.11, P=0.28,证明模型实际预测能力良好。
本模型的建立可为手术疗效、外科病例筛选甚至术后辅助治疗提供依据。随着对NSCLC患者术后复发转移的研究进展,更有意义的危险因素将被纳入研究,得出更高效的风险预测模型,更具有临床指导意义。然而,本研究尚属于一项单中心、小样本的研究。在未来,基于多中心组合和增加的样本量将为此模型提供更有说服力的临床证据。
作者贡献
赵方超:构思并设计研究、撰写论文
王伟健:搜集数据、实施实验
刘建明:分析数据、论文审查
| [1] |
Siegel RL, Miller KD, Jemal A, et al. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. |
| [2] |
林金兰, 郭天兴, 潘小杰, 等. 长春瑞滨软胶囊单药节拍化疗一线治疗老年非小细胞肺癌临床疗效观察[J]. 肿瘤防治研究, 2018, 45(11): 909-912. [Li JL, Guo TX, Pan XJ, et al. clinical observation of metronomic oral vinorelbine monotherapy as first-line treatment on elderly patients with advanced non-small cell lung cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2018, 45(11): 909-912. DOI:10.3971/j.issn.1000-8578.2018.18.0841] |
| [3] |
罗猛, 刘波, 刘迪, 等. 非小细胞肺癌患者微创切除术后的复发与转移状况研究[J]. 中国内镜杂志, 2017, 23(9): 42-47. [Luo M, Liu B, Liu D, et al. Recurrence and metastasis of patients with non-small cell lung cancer after minimally invasive surgery[J]. Zhongguo Nei Jing Za Zhi, 2017, 23(9): 42-47.] |
| [4] |
Zhao J, Zhang X, Gong C, et al. Targeted therapy with apatinib in a patient with relapsed small cell lung cancer: A case report and literature review[J]. Medicine (Baltimore), 2017, 96(50): e9259. |
| [5] |
Yoshida Y, Watanabe S. Primary Lung Cancer Surgery-Clinical Trial Results[J]. Gan To Kagaku Ryoho, 2018, 45(10): 1405-1409. |
| [6] |
叶轩婷, 张朋, 沈丽萍, 等. 非小细胞肺癌根治术后预防复发转移的治疗进展[J]. 医学综述, 2018, 24(5): 879-883. [Ye XT, Zhang P, Shen LP, et al. Advance of the Prevention from Recurrence and Metastasis after Radical Resection for Non-Small Cell Lung Cancer[J]. Yi Xue Zong Shu, 2018, 24(5): 879-883. DOI:10.3969/j.issn.1006-2084.2018.05.010] |
| [7] |
Oguma J, Ozawa S, Kazuno A, et al. Clinical Significance of New Magnetic Resonance Thoracic Ductography Before Thoracoscopic Esophagectomy for Esophageal Cancer[J]. World J Surg, 2018, 42(6): 1779-1786. |
| [8] |
江涵.非小细胞肺癌淋巴结转移及术后局部(区域)复发因素荟萃分析[D].南方医科大学, 2018. [Jiang H. Meta-analysis of lymph node metastasis and postoperative local (regional) recurrence in non-small cell lung cancer[D]. Southern Medical University, 2018.] http://cdmd.cnki.com.cn/Article/CDMD-12121-1018276395.htm
|
| [9] |
葛会景, 郭占林. 非小细胞肺癌术后预后相关因素的研究进展[J]. 内蒙古医科大学学报, 2018, 40(6): 650-653. [Ge HJ, Guo ZL. Research progress on prognositic factors of non-small cell lung cancer after operation[J]. Neimenggu Yi Ke Da Xue Xue Bao, 2018, 40(6): 650-653.] |
| [10] |
陶洪, 孙国平. 非小细胞肺癌根治术后复发及进展影响因素的回顾性分析[J]. 医学信息, 2018, 31(12): 61-64. [TAO H, Sun GP. Retrospective analysis of factors influencing recurrence and progression after radical resection of non-small cell lung cancer[J]. Yi Xue Xin Xi, 2018, 31(12): 61-64. DOI:10.3969/j.issn.1006-1959.2018.12.019] |
| [11] |
宋勇. Ⅲ期非小细胞肺癌手术治疗患者预后的影响因素分析[J]. 中国实用医药, 2019, 14(1): 25-26. [Song Y. Analysis of factors affecting prognosis of patients with stage Ⅲ non-small cell lung cancer undergoing surgical treatment[J]. Zhongguo Shi Yong Yi Yao, 2019, 14(1): 25-26.] |
| [12] |
Flores RM, Nicastri D, Bauer T, et al. Computed tomography screening for lung cancer: mediastinal lymph node resection in stage IA nonsmall cell lung cancer manifesting as subsolid and solid nodules[J]. Ann Surg, 2017, 265(5): 1025-1033. |
| [13] |
李星凯, 刘战业, 姜运峰, 等. 原发性中央型和周围型肺鳞癌临床病理学及预后差异[J]. 山东大学学报(医学版), 2017, 55(9): 73-78. [Li XK, Liu ZY, Jiang YF, et al. Clinicopathological factors and prognosis between primary central and peripheral lung squamous cell carcinoma[J]. Shandong Da Xue Xue Bao(Yi Xue Ban), 2017, 55(9): 73-78.] |
| [14] |
金澄宇, 续文栋, 杜亮, 等. 非小细胞肺癌患者术后复发240例临床分析[J]. 中国临床研究, 2018, 31(7): 933-935, 939. [Jin CY, Xu WD, Du L, et al. Postoperative recurrence of non-small cell lung cancer: analysis of 240 cases[J]. Zhongguo Lin Chuang Yan Jiu, 2018, 31(7): 933-935, 939.] |
 2020, Vol. 47
2020, Vol. 47


