文章信息
- 基于二氧化硅纳米粒子的抗肿瘤药物递送系统研究进展
- Research Progress of Anti-cancer Drug Delivery System Based on Silica Nanoparticles
- 肿瘤防治研究, 2020, 47(2): 135-140
- Cancer Research on Prevention and Treatment, 2020, 47(2): 135-140
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.0785
- 收稿日期: 2019-06-14
- 修回日期: 2019-09-04
2. 361102 厦门,厦门大学生命科学学院
2. School of Life Science, Xiamen University, Xiamen 361102, China
近年来癌症发病率不断攀升,目前的化疗、放疗和手术等治疗手段存在不良反应多、易复发和多药耐药性强等局限,因此开发新的治疗手段十分紧要。大量研究[1-3]表明基于无机纳米粒子的纳米药物载体在肿瘤治疗领域具有巨大潜力,其中二氧化硅纳米粒子(Silica nanoparticle, SiO2 NPs)因其独特的物理化学性质引起了研究人员的广泛关注。与其他纳米粒子相比,SiO2 NPs的孔隙结构有序可调[4],比表面积大,表面功能基团易于修饰[5],这些特性使SiO2 NPs能够高效负载药物,并且实现药物的靶向递送与可控释放,成为新型纳米抗癌药物载体的优良候选者。
近年来,SiO2 NPs的设计和合成迅速发展,在抗癌药物负载、靶向递送、生物成像方面的应用研究不断深入。FDA认为:“基于二氧化硅纳米材料普遍是安全的”[3]。被称为“康奈尔点”(C点)的SiO2 NPs已经通过FDA批准用于人体临床试验。本文将对SiO2 NPs的制备及其在肿瘤医学方面的应用,特别是抗癌药物递送和生物成像领域的研究进展进行综述。
1 SiO2 NPs的制备20世纪90年代,SiO2 NPs首次被合成,随着纳米颗粒合成技术的不断发展,目前已经能够合成球形、棒状、片层状等不同形状的SiO2 NPs,其中球形SiO2 NPs最具潜力,应用研究最为深入广泛。球形SiO2 NPs包括实心球形、中空球形以及具有核壳结构的SiO2 NPs。
实心SiO2 NPs通常用溶胶凝胶法制备,利用NaOH等刻蚀剂对SiO2 NPs进行刻蚀可形成实心多孔氧化硅纳米颗粒,其纳米孔是装载抗癌药物的良好载体。
中空SiO2 NPs的空心结构能够更大限度地提高药物装载量,因此中空SiO2 NPs深受研究人员的青睐。模板法是制备中空SiO2NPs的最常用方法。该法是以聚合物、无机物、金属复合物或生物体作为模板,将氧化硅材料通过组装、吸附、沉积以及溶胶-凝胶等方法包覆在模板表面,再通过有机溶剂溶解、高温煅烧等方法将模板去除,得到中空SiO2 NPs[6]。
核壳结构SiO2 NPs由外层氧化硅壳和内部物质组成,它的制备策略是先制备内部物质,然后在其外部包覆一层氧化硅外壳,形成核壳结构。Chen等[7]使用“基于结构差异的选择性蚀刻”策略成功制备出内核和外壳均为氧化硅材料的核壳结构SiO2 NPs。FDA已批准核壳结构SiO2 NPs的C点用于临床试验[8]。
2 SiO2 NPs用于药物递送系统SiO2 NPs稳定的物理化学性质、高负载能力,以及独特的光、电、磁特性,使它成为高效的药物递送载体,它将抗肿瘤药物靶向递送至肿瘤组织后,以刺激响应的方式释放药物,达到靶向递送药物、控制药物释放的目的,改善癌症治疗效果。
2.1 SiO2 NPs用于药物靶向递送不具备靶向功能的传统抗肿瘤药物,无法有效提高肿瘤部位的药物浓度,所以研究者一直致力于开发出能够靶向肿瘤部位、提高药物作用效率的药物。目前常用的肿瘤靶向治疗策略分为被动靶向与主动靶向两类。其中被动靶向是基于肿瘤组织的渗透性和保留效应(enhanced permeability and retention, EPR)[9],主动靶向是基于在肿瘤细胞上过表达的受体,利用受体和配体的特异性结合实现靶向。
SiO2 NPs药物递送系统的被动靶向功能基于EPR效应。一方面,SiO2 NPs能从肿瘤组织中通透性增强的血管里渗透出来,而在正常血管中不发生渗透;另一方面,肿瘤组织中淋巴引流效率降低,SiO2 NPs在肿瘤组织中的停留时间增长。利用EPR效应,SiO2 NPs药物递送系统能够一定程度上将药物靶向递送至肿瘤组织,而想获得更高的特异性,需要依靠主动靶向的方式。
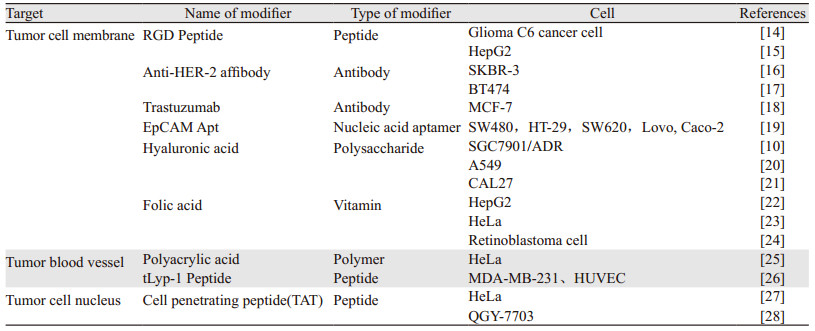
主动靶向需要对SiO2 NPs进行特殊设计。经过特定分子官能化的SiO2 NPs能够特异性结合肿瘤组织中过度表达的分子,实现主动靶向功能。目前,已发现小分子、肽、抗体和抗体片段以及核酸适体等多种分子可以用于修饰SiO2 NPs,从而实现主动靶向。根据靶向受体的不同,可以将SiO2 NPs药物递送系统的主动靶向策略分为肿瘤细胞靶向和血管靶向。
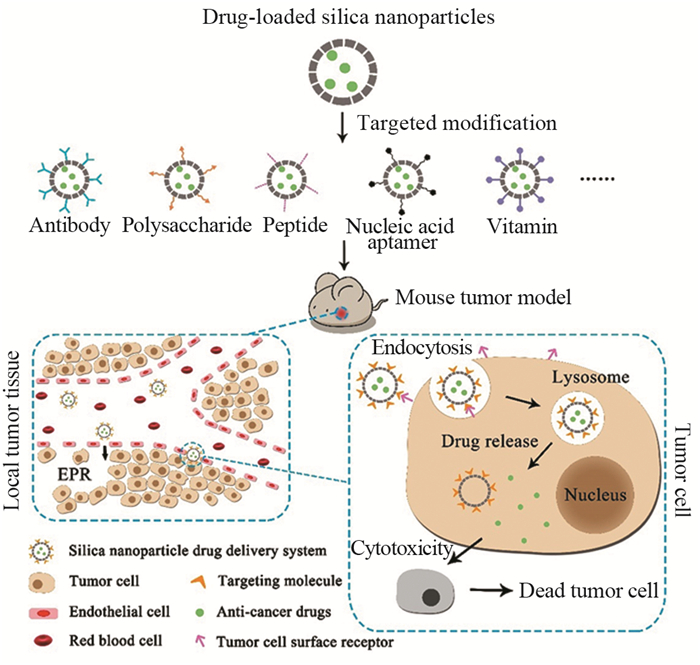
肿瘤细胞靶向是最常用的策略,官能化的SiO2 NPs对肿瘤细胞的亲和力增强,可将负载的药物靶向递送至肿瘤细胞。目前已经发现小分子(如叶酸)、核酸适体、抗体、多糖等物质修饰的SiO2 NPs药物递送系统能够特异性靶向癌细胞,提高肿瘤组织内的药物浓度。图 1展示的是肿瘤细胞靶向策略的简单示意图。近日,Fang等[10]使用透明质酸修饰的SiO2 NPs可识别胃癌细胞上过表达的CD44,介导特异性肿瘤靶向,递送治疗药物多柔比星(DOX)和槲皮素,提高了肿瘤细胞对药物的摄取。Zhang等[11]将SiO2 NPs表面缀合西妥昔单抗以靶向在多种乳腺癌中过表达的表皮生长因子受体。部分用于基因治疗的抗癌药物需进一步靶向至肿瘤细胞核内才能顺利发挥抗肿瘤作用。Wu等使用TAT(核定位信号肽)[12]修饰SiO2 NPs,该SiO2 NPs能够顺利穿过细胞核膜并将基因药物递送到细胞核中,达到基因治疗的目的。
|
| 图 1 SiO2 NPs药物递送系统肿瘤细胞靶向模式图 Figure 1 Tumor cell targeting pattern of Silica nanoparticle (SiO2 NPs) drug delivery system |
除肿瘤细胞靶向外,另一种策略是肿瘤血管靶向。由于大多数类型的肿瘤血管系统具备相似的性质,因此血管靶向的SiO2 NPs药物递送系统通常可应用于大多数类型的肿瘤。基于血管靶向的SiO2 NPs药物递送系统将抗肿瘤药物靶向递送至肿瘤血管内皮细胞,使其死亡,从而切断肿瘤组织的氧气和营养物质的供应。目前发现精氨酸-甘氨酸-天门冬氨酸肽、CD105抗体、血管内皮生长因子121等可以特异性结合肿瘤血管系统上过表达的分子,经它们修饰的SiO2 NPs药物递送系统能够明显增强抗肿瘤效果。
具有主动靶向功能的SiO2 NPs药物递送系统在被动靶向的基础上进一步提高了药物靶向肿瘤的特异性。表 1列举了不同主动靶向策略的部分可用修饰物。但人体内环境的复杂性使SiO2 NPs药物递送系统的具体作用过程尚不清晰,有研究表明SiO2 NPs在肺、肝和肾等器官中有积累现象[13],目前的SiO2 NPs药物递送系统还需进一步改造,使它们能够躲开人体器官的“抓捕”。
随着SiO2 NPs在抗肿瘤药物载体领域研究的不断深入,SiO2 NPs药物递送系统在药物可控释放方面的潜力被越来越多研究者发现。利用特定物质对SiO2 NPs药物递送系统的纳米孔进行“封锁”,使药物在到达肿瘤组织前无释放或低释放,到达肿瘤组织后,SiO2 NPs药物递送系统响应相应刺激,“锁”被打开,才实现药物释放。常见的刺激方式主要有内源性刺激与外源性刺激。
2.2.1 基于内源性刺激的SiO2 NPs药物递送系统响应内源性刺激的SiO2 NPs药物递送系统主要是利用肿瘤组织与正常组织的性质差异,如pH值、氧化还原条件和酶表达量。
肿瘤组织的pH值比正常组织中的更小[29],异常的pH值为pH敏感SiO2 NPs药物递送系统提供信号,触发药物释放。pH响应性SiO2 NPs药物递送系统常用聚电解质、pH敏感的化学键(如乙缩醛键、腙键等)和小分子(如CaCO3)作为阻断材料包封纳米孔。在酸性条件下阻断材料发生裂解或溶解,导致纳米孔打开,释放药物。最近,Samykutty等[30]使用壳聚糖包封SiO2 NPs,开发了pH响应的药物递送系统,并在小鼠卵巢癌模型中发现该系统能使肿瘤内药物浓度显著增高,改善肿瘤治疗效果。
氧化还原响应SiO2 NPs药物递送系统通常使用对氧化还原条件敏感的二硫键包封纳米孔。SiO2 NPs药物载体达到肿瘤组织后二硫键被肿瘤组织中明显高于正常组织的谷胱甘肽、胶原蛋白、细胞色素C、肝素等氧化还原物质裂解[31],纳米孔打开,药物释放;而在未到达肿瘤组织前二硫键将药物包封于SiO2 NPs内,阻止药物过早释放。
基于酶响应的SiO2 NPs药物递送系统使用特定化学键或序列包封纳米孔,SiO2 NPs药物递送系统到达肿瘤组织后,这些化学键或序列被肿瘤组织中高度表达的酶特异性水解,药物从纳米孔中释放。目前已发现基质金属蛋白酶、组织蛋白酶B、β-D-半乳糖苷酶、弹性蛋白酶、胰蛋白酶等在肿瘤组织中的表达量较正常组织高。Liu等[32]使用对基质金属蛋白酶敏感的底物肽包封SiO2 NPs,成功构建了基于SiO2 NPs的基质金属蛋白酶响应药物递送系统,并在小鼠体内实验中证明该SiO2 NPs药物递送系统可有效抑制肿瘤生长。
内源性刺激响应类SiO2 NPs药物递送系统利用肿瘤组织本身特有性质来实现药物的受控释放,而人群的生理条件具有差异,内源性环境变化程度不尽相同,故该类SiO2 NPs-药物递送系统的效果存在个体差异。
2.2.2 基于外源性刺激的SiO2 NPs药物递送系统与内源性刺激不同,外源性刺激响应类SiO2 NPs药物递送系统是利用肿瘤组织外部环境的变化来发挥作用,受个体差异的影响较小。外源性刺激主要包括光、温度、磁场、超声波以及电场。
光响应SiO2 NPs药物递送系统使用光敏分子封闭SiO2 NPs纳米孔,经特定波长的光(例如紫外线、可见光或近红外光)照射后,光敏分子发生构象转变,纳米孔打开,从而触发药物释放。常用的光敏分子有偶氮苯、香豆素等。Lu等[33]开发了一种涂覆硫化铋的SiO2 NPs,它对近红外光高度敏感,并在小鼠实验中证明可有效减少药物在正常组织中的释放。
温度响应性SiO2 NPs药物递送系统是研究最多的刺激响应策略之一。该类药物递送系统通常由SiO2 NPs和表面的热响应材料涂层组成,药物释放依赖于周围温度的变化。有研究人员[34]用双链DNA包封SiO2 NPs纳米孔,双链DNA具有独特的解链温度,在特定温度下发生解链,从而打开纳米孔并释放药物。此外,聚N-异丙基丙烯酰胺也是温度响应性SiO2 NPs药物递送系统常用的包封材料[35-37]。
磁响应SiO2 NPs药物递送系统是将SiO2 NPs与磁性材料结合,在外部磁场的驱动下,该药物递送系统可以精确地将药物在目标位置释放。Baeza等[38]将超顺磁性Fe3O4纳米颗粒嵌入SiO2 NPs中,再使用热响应聚合物异丙基丙烯酰胺包封SiO2 NPs,组成一种新型氧化硅纳米载体,在磁场的作用下,该氧化硅纳米粒子可以产生热能,诱导热响应材料的构象变化,从而实现药物释放。这种新型SiO2 NPs药物递送系统联合应用磁响应与热响应,建立了控制药物释放的双重关卡,这种双响应药物递送载体为SiO2 NPs药物递送系统的发展提供了新的思路。
多刺激响应方法可以结合各个单一刺激响应策略的优点,形成药物释放的多道关卡,只有在各个响应均被触发时药物才可迅速释放,增强对药物释放过程的控制。近几年,越来越多的研究者利用多重刺激响应来控制药物释放。Jin等[39]设计制造了一种具有三层核壳结构的氧化硅纳米载体,第一层由酶响应物质透明质酸组成,用于响应肿瘤组织中过度表达的酶;第二层由氧化还原响应物质二硫键组成,响应谷胱甘肽;第三层由pH响应的两性粒离子表面组成。近年来,多重响应SiO2 NPs药物递送系统已成为主要研究方向,目前已有pH响应与氧化还原响应、酶响应、温度响应联合使用,光响应与热响应联合等多重刺激响应SiO2 NPs药物递送系统被报道。
3 SiO2 NPs用于生物成像生物成像诊断是一种非侵入性的诊断方式,使用SiO2 NPs将造影剂靶向递送至肿瘤部位,对肿瘤的诊断及其预后意义重大[40]。SiO2 NPs不仅能够装载造影剂,而且能提高造影剂的溶解度与稳定性。同时,SiO2 NPs缀合造影剂与靶向配体后可用于药物定位、肿瘤诊断等。针对不同的成像模式,SiO2 NPs可缀合不同的造影剂(氧化铁、金纳米颗粒、FITC、Cy5等染料)。此外,SiO2 NPs负载不同种造影剂,可与磁共振[41]、正电子发射型计算机断层显像[42]、计算机断层扫描[43]、近红外光谱技术、荧光成像等不同的成像手段联用,构建多功能载体系统,弥补单一成像模式的缺点,通过多模态生物成像,建立克服个体局限性的不同成像方式的组合,以达到不同的诊断、治疗目的。近日,Sánchez等[15]成功将Fe3O4与金纳米颗粒结合在SiO2 NPs上,同时在纳米孔中掺入荧光染料,得到的氧化硅纳米粒子可以同时用于磁共振(Fe3O4)、计算机断层扫描(金纳米颗粒)和荧光成像(荧光染料),并且在纤维肉瘤小鼠模型中成功验证了这种SiO2 NPs的成像和载体功能。
康奈尔大学的研究人员合成了一种10纳米以下的SiO2 NPs,称为康奈尔点或C点。C点使用聚乙二醇(PEG)缀合环状精氨酸-甘氨酸-天门冬氨酸肽来提供靶向功能,嵌入荧光染料用于荧光检测,并且可同时标记同位素用于正电子发射型计算机断层扫描。临床试验结果表明,C点可以用于肿瘤相关生物成像,且注射入人体内的C点在2周内从体内清除,未发现对人体造成损伤。同时研究人员发现C点本身显示出一定的抗肿瘤作用。进一步在小鼠上进行研究后,他们发现C点能够靶向黑色素瘤,细胞并杀伤肿瘤细胞,猜测是由于C点可吸附铁离子并将其送至肿瘤细胞,铁离子内化至癌细胞后引起细胞死亡,从而起到抗肿瘤作用[44]。
4 讨论与展望自20世纪90年代SiO2 NPs被首次合成以来,其已被广泛用于生物医学领域,它凭借独特的物化特性,成为理想的抗癌药物载体,可以用于抗癌药物的靶向递送和药物的受控释放。与此同时,SiO2 NPs在克服肿瘤多药耐药性[45]和肿瘤光动力疗法(photodynamic therapy, PDT)领域[46-47]具有潜力。Lin的小组[48]使用一种新型星形介孔SiO2 NPs构建PDT的光敏剂,它可以靶向肿瘤部位,并在激发光下选择性活化,引起肿瘤细胞的死亡,在肿瘤小鼠中成功抑制肿瘤生长,并表现出低毒性。
SiO2 NPs已经在生物医学领域显示出巨大潜力,FDA已批准将10 nm以下的SiO2 NPs——C点用于人体试验。SiO2 NPs能够增加药物载量,靶向递送药物,使其受控释放,提高药物作用效率,它在生物成像领域的应用将使肿瘤诊断方式更加丰富。因此,SiO2 NPs的生物相容性也引发了研究者的关注。研究表明SiO2 NPs的表面积、尺寸[49]或形状[50]可能在它所引起的细胞毒性中起关键作用。Malvindi[51]、Chang[52]等的研究结果表明SiO2 NPs在低剂量下呈现出低毒性。同时,针对SiO2 NPs的消除与代谢开展的研究中,研究人员发现,经静脉注射给药后SiO2 NPs主要积聚在肝、肾、膀胱,最终SiO2 NPs通过肾脏途径进行排泄[53]。
虽然SiO2 NPs作为新兴生物材料仍有许多问题有待解决,在应用于临床之前还面临着很多挑战,还需对SiO2 NPs与人体生理系统之间相互作用进行深入研究以及全面的体外筛选试验,从而开发出更可靠、稳定、可用于临床的SiO2 NPs。
作者贡献
郑伟斌:资料收集、文章撰写及修改
张博雅:资料收集、文章修改
殷晓辰:文章修改
王鑫:文章选题、设计及修改
赵勤俭:文章选题与设计
| [1] |
Jafari S, Derakhshankhah H, Alaei L, et al. Mesoporous silica nanoparticles for therapeutic/diagnostic applications[J]. Biomed Pharmacother, 2019, 109: 1100-1111. DOI:10.1016/j.biopha.2018.10.167 |
| [2] |
Murugan B, Krishnan UM. Chemoresponsive smart mesoporous silica systems-An emerging paradigm for cancer therapy[J]. Int J Pharm, 2018, 553(1-2): 310-326. DOI:10.1016/j.ijpharm.2018.10.026 |
| [3] |
Kumar P, Tambe P, Paknikar KM, et al. Mesoporous silica nanoparticles as cutting-edge theranostics: Advancement from merely a carrier to tailor-made smart delivery platform[J]. J Control Release, 2018, 287: 35-57. DOI:10.1016/j.jconrel.2018.08.024 |
| [4] |
Tabasi O, Falamaki C, Khalaj Z. Functionalized mesoporous silicon for targeted-drug-delivery[J]. Colloids Surf B Biointerfaces, 2012, 98: 18-25. DOI:10.1016/j.colsurfb.2012.04.018 |
| [5] |
Graf C, Dembski S, Hofmann A, et al. A General Method for the Controlled Embedding of Nanoparticles in Silica Colloids[J]. Langmuir, 2006, 22(13): 5604-5610. DOI:10.1021/la060136w |
| [6] |
安璐, 张崇琨, 胡鹤, 等. 中空二氧化硅微球的制备及其在超声成像中的应用研究[J]. 上海师范大学学报(自然科学版), 2012, 41(4): 432-440. [An L, Zhang CK, Hu H, et al. Synthesis of hollow silica microspheres and their applications in ultrasound imaging[J]. Shanghai Shi Fan Da Xue Xue Bao(Zi Ran Ke Xue Ban), 2012, 41(4): 432-440. DOI:10.3969/j.issn.1000-5137.2012.04.015] |
| [7] |
Chen Y, Chen H, Guo L, et al. Hollow/Rattle-Type Mesoporous Nanostructures by a Structural Difference-Based Selective Etching Strategy[J]. ACS Nano, 2010, 4(1): 529-539. DOI:10.1021/nn901398j |
| [8] |
Zhou Y, Quan G, Wu Q, et al. Mesoporous silica nanoparticles for drug and gene delivery[J]. Acta pharm Sin B, 2018, 8(2): 165-177. DOI:10.1016/j.apsb.2018.01.007 |
| [9] |
Yang Y, Yu C. Advances in silica based nanoparticles for targeted cancer therapy[J]. Nanomedicine, 2016, 12(2): 317-332. DOI:10.1016/j.nano.2015.10.018 |
| [10] |
Fang J, Zhang S, Xue X, et al. Quercetin and doxorubicin co-delivery using mesoporous silica nanoparticles enhance the efficacy of gastric carcinoma chemotherapy[J]. Int J Nanomedicine, 2018, 13: 5113-5126. DOI:10.2147/IJN.S170862 |
| [11] |
Zhang X, Li Y, Wei M, et al. Cetuximab-modified silica nanoparticle loaded with ICG for tumor-targeted combinational therapy of breast cancer[J]. Drug Deliv, 2019, 26(1): 129-136. DOI:10.1080/10717544.2018.1564403 |
| [12] |
Wu M, Meng Q, Chen Y, et al. Large-Pore Ultrasmall Mesoporous Organosilica Nanoparticles: Micelle/Precursor Co-templating Assembly and Nuclear-Targeted Gene Delivery[J]. Adv Mater, 2015, 27(2): 215-222. DOI:10.1002/adma.201404256 |
| [13] |
Chen F, Nayak TR, Goel S, et al. In Vivo Tumor Vasculature Targeted PET/NIRF Imaging with TRC105(Fab)-Conjugated, Dual-Labeled Mesoporous Silica Nanoparticles[J]. Molecular Pharmaceutics, 2014, 11(11): 4007-4014. DOI:10.1021/mp500306k |
| [14] |
Maggini L, Cabrera I, Ruiz-Carretero A, et al. Breakable mesoporous silica nanoparticles for targeted drug delivery[J]. Nanoscale, 2016, 8(13): 7240-7247. |
| [15] |
Sánchez A, Ovejero Paredes K, Ruiz-Cabello J, et al. Hybrid Decorated Core@Shell Janus Nanoparticles As Flexible Platform For Targeted Multimodal Molecular Bioimaging Of Cancer[J]. ACS Appl Mater Interfaces, 2018, 10(37): 31032-31043. DOI:10.1021/acsami.8b10452 |
| [16] |
Yamaguchi H, Hayama K, Sasagawa I, et al. HER2-Targeted Multifunctional Silica Nanoparticles Specifically Enhance the Radiosensitivity of HER2-Overexpressing Breast Cancer Cells[J]. Int J Mol Sci, 2018, 19(3): E908. DOI:10.3390/ijms19030908 |
| [17] |
Gu S, Ngamcherdtrakul W, Reda M, et al. Lack of acquired resistance in HER2-positive breast cancer cells after long-term HER2 siRNA nanoparticle treatment[J]. PLoS One, 2018, 13(6): e0198141. DOI:10.1371/journal.pone.0198141 |
| [18] |
Meng LX, Ren Q, Meng Q, et al. Trastuzumab modified silica nanoparticles loaded with doxorubicin for targeted and synergic therapy of breast cancer[J]. Artif Cells Nanomed Biotechnol, 2018, 46(sup3): s556-s563. DOI:10.1080/21691401.2018.1501380 |
| [19] |
Li Y, Duo Y, Zhai P, et al. Dual targeting delivery of miR-328 by functionalized mesoporous silica nanoparticles for colorectal cancer therapy[J]. Nanomedicine(Lond), 2018.[Epub ahead of print
|
| [20] |
Wang Y, Cui Y, Zhao Y, et al. Fluorescent carbon dot-gated multifunctional mesoporous silica nanocarriers for redox/enzyme dual-responsive targeted and controlled drug delivery and real-time bioimaging[J]. Eur J Pharm Biopharm, 2017, 117: 105-115. DOI:10.1016/j.ejpb.2017.03.019 |
| [21] |
Shi XL, Li Y, Zhao LM, et al. Delivery of MTH1 inhibitor (TH287) and MDR1 siRNA via hyaluronic acid-based mesoporous silica nanoparticles for oral cancers treatment[J]. Colloids Surf B Biointerfaces, 2019, 173: 599-606. DOI:10.1016/j.colsurfb.2018.09.076 |
| [22] |
Chen C, Yao W, Sun W, et al. A self-targeting and controllable drug delivery system constituting mesoporous silica nanoparticles fabricated with a multi-stimuli responsive chitosan-based thin film layer[J]. Int J Biol Macromol, 2019, 122: 1090-1099. DOI:10.1016/j.ijbiomac.2018.09.058 |
| [23] |
Das M, Solanki A, Joshi A, et al. β-cyclodextrin based dual-responsive multifunctional nanotheranostics for cancer cell targeting and dual drug delivery[J]. Carbohydr Polym, 2019, 206: 694-705. DOI:10.1016/j.carbpol.2018.11.049 |
| [24] |
Qu W, Meng B, Yu Y, et al. Folic acid-conjugated mesoporous silica nanoparticles for enhanced therapeutic efficacy of topotecan in retina cancers[J]. Int J Nanomedicine, 2018, 13: 4379-4389. DOI:10.2147/IJN.S142668 |
| [25] |
Rejeeth C, Vivek R, Nipunbabu V, et al. Cancer nanomedicine: from PDGF targeted drug delivery[J]. Medchemcomm, 2017, 8(11): 2055-2059. DOI:10.1039/C7MD00391A |
| [26] |
Liu Y, Chen Q, Xu M, et al. Single peptide ligand-functionalized uniform hollow mesoporous silica nanoparticles achieving dual-targeting drug delivery to tumor cells and angiogenic blood vessel cells[J]. Int J Nanomedicine, 2015, 10: 1855-1867. DOI:10.2217/nnm.15.75 |
| [27] |
Wu M, Meng Q, Chen Y, et al. Large-Pore Ultrasmall Mesoporous Organosilica Nanoparticles: Micelle/Precursor Co-templating Assembly and Nuclear-Targeted Gene Delivery[J]. Adv Mater, 2015, 27(2): 215-222. DOI:10.1002/adma.201404256 |
| [28] |
Han L, Tang C, Yin C. Dual-targeting and pH/redox-responsive multi-layered nanocomplexes for smart co-delivery of doxorubicin and siRNA[J]. Biomaterials, 2015, 60: 42-52. DOI:10.1016/j.biomaterials.2015.05.001 |
| [29] |
Liberti MV, Locasale JW. The Warburg Effect: How Does it Benefit Cancer Cells?[J]. Trends Biochem Sci, 2016, 41(3): 287. DOI:10.1016/j.tibs.2016.01.004 |
| [30] |
Samykutty A, Grizzle WE, Fouts BL, et al. Optoacoustic imaging identifies ovarian cancer using a microenvironment targeted theranostic wormhole mesoporous silica nanoparticle[J]. Biomaterials, 2018, 182: 114-126. DOI:10.1016/j.biomaterials.2018.08.001 |
| [31] |
Song Y, Li Y, Xu Q, et al. Mesoporous silica nanoparticles for stimuli-responsive controlled drug delivery: advances, challenges, and outlook[J]. Int J Nanomedicine, 2016, 12: 87-110. DOI:10.2147/IJN.S117495 |
| [32] |
Liu Y, Ding X, Li J, et al. Enzyme responsive drug delivery system based on mesoporous silica nanoparticles for tumor therapy in vivo[J]. Nanotechnology, 2015, 26(14): 145102. DOI:10.1088/0957-4484/26/14/145102 |
| [33] |
Lu Y, Li L, Lin Z, et al. Enhancing Osteosarcoma Killing and CT Imaging Using Ultrahigh Drug Loading and NIR-Responsive Bismuth Sulfide@Mesoporous Silica Nanoparticles[J]. Adv Healthc Mater, 2018, 7(19): 1800602. DOI:10.1002/adhm.201800602 |
| [34] |
Ruiz-hernández E, Baeza A, Vallet-Regí M. Smart Drug Delivery through DNA/Magnetic Nanoparticle Gates[J]. ACS Nano, 2011, 5(2): 1259-1266. DOI:10.1021/nn1029229 |
| [35] |
Brunella V, Jadhav SA, Miletto I, et al. Hybrid drug carriers with temperature-controlled on-off release: A simple and reliable synthesis of PNIPAM-functionalized mesoporous silica nanoparticles[J]. React Funct Polym, 2016, 98: 31-37. DOI:10.1016/j.reactfunctpolym.2015.11.006 |
| [36] |
Li A, Zhang J, Xu Y, et al. Thermoresponsive copolymer/SiO2 nanoparticles with dual functions of thermally controlled drug release and simultaneous carrier decomposition[J]. Chemistry, 2015, 20(40): 12945-12953. |
| [37] |
Peralta ME, Jadhav SA, Magnacca G, et al. Synthesis and in vitro testing of thermoresponsive polymer-grafted core-shell magnetic mesoporous silica nanoparticles for efficient controlled and targeted drug delivery[J]. J Colloid Interface Sci, 2019, 544: 198-205. DOI:10.1016/j.jcis.2019.02.086 |
| [38] |
Baeza A, Manzano M, Colilla M, et al. Recent advances in mesoporous silica nanoparticles for antitumor therapy: our contribution[J]. Biomater Sci, 2016, 4(5): 803-13. DOI:10.1039/C6BM00039H |
| [39] |
Jin R, Liu Z, Bai Y, et al. Multiple-Responsive Mesoporous Silica Nanoparticles for Highly Accurate Drugs Delivery to Tumor Cells[J]. ACS Omega, 2018, 3(4): 4306-4315. DOI:10.1021/acsomega.8b00427 |
| [40] |
赵苗, 赵云, 周军. 靶向超声造影剂在癌症诊疗中的应用前景[J]. 肿瘤防治研究, 2017, 44(5): 360-364. [Zhao M, Zhao Y, Zhou J. Application Perspectives of Targeted Ultrasound Contrast Agents in Diagnosis and Therapy of Cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2017, 44(5): 360-364. DOI:10.3971/j.issn.1000-8578.2017.05.010] |
| [41] |
Maboudi SA, Shojaosadati SA, Aliakbari F, et al. Theranostic magnetite cluster@silica@albumin double-shell particles as suitable carriers for water-insoluble drugs and enhanced T2 MR imaging contrast agents[J]. Mater Sci Eng C Mater Biol Appl, 2019, 99: 1485-1492. DOI:10.1016/j.msec.2019.02.063 |
| [42] |
Goel S, Chen F, Hong H, et al. VEGF121-Conjugated Mesoporous Silica Nanoparticle: A Tumor Targeted Drug Delivery System[J]. ACS Appl Mater Interfaces, 2014, 6(23): 21677-21685. DOI:10.1021/am506849p |
| [43] |
Zhang Y, Cheng J, Li N, et al. A versatile theranostic nanoplatform based on mesoporous silica[J]. Mater Sci Eng C Mater Biol Appl, 2019, 98: 560-571. DOI:10.1016/j.msec.2019.01.004 |
| [44] |
Kim SE, Zhang L, Ma K, et al. Ultrasmall nanoparticles induce ferroptosis in nutrient-deprived cancer cells and suppress tumour growth[J]. Nat Nanotechnol, 2016, 11(11): 977-985. DOI:10.1038/nnano.2016.164 |
| [45] |
Xue H, Yu Z, Liu Y, et al. Delivery of miR-375 and doxorubicin hydrochloride by lipid-coated hollow mesoporous silica nanoparticles to overcome multiple drug resistance in hepatocellular carcinoma[J]. Int J Nanomedicine, 2017, 12: 5271-5287. DOI:10.2147/IJN.S135306 |
| [46] |
Bouramtane S, Bretin L, Pinon A, et al. Porphyrin-xylan-coated silica nanoparticles for anticancer photodynamic therapy[J]. Carbohydr Polym, 2019, 213: 168-175. DOI:10.1016/j.carbpol.2019.02.070 |
| [47] |
Ellahioui Y, Patra M, Mari C, et al. Mesoporous silica nanoparticles functionalised with a photoactive ruthenium(ii) complex: exploring the formulation of a metal-based photodynamic therapy photosensitiser[J]. Dalton Trans, 2019, 48(18): 5940-5951. DOI:10.1039/C8DT02392A |
| [48] |
Lin AL, Li SZ, Xu CH, et al. A pH-responsive stellate mesoporous silica based nanophotosensitizer for in vivo cancer diagnosis and targeted photodynamic therapy[J]. Biomater Sci, 2018, 7(1): 211-219. |
| [49] |
Vallhov H, Gabrielsson S, Stromme M, et al. Mesoporous Silica Particles Induce Size Dependent Effects on Human Dendritic Cells[J]. Nano Lett, 2007, 7(12): 3576-3582. DOI:10.1021/nl0714785 |
| [50] |
Fenoglio I, Martra G, Coluccia S, et al. Possible Role of Ascorbic Acid in the Oxidative Damage Induced by Inhaled Crystalline Silica Particles[J]. Chem Res Toxicol, 2000, 13(10): 971-975. DOI:10.1021/tx000125h |
| [51] |
Malvindi MA, Brunetti V, Vecchio G, et al. SiO2 nanoparticles biocompatibility and their potential for gene delivery and silencing[J]. Nanoscale, 2012, 4(2): 486-495. DOI:10.1039/C1NR11269D |
| [52] |
Chang JS, Chang KL, Hwang DF, et al. In Vitro Cytotoxicitiy of Silica Nanoparticles at High Concentrations Strongly Depends on the Metabolic Activity Type of the Cell Line[J]. Environ Sci Technol, 2007, 41(6): 2064-2068. DOI:10.1021/es062347t |
| [53] |
He X, Nie H, Wang K, et al. In vivo Study of Biodistribution and Urinary Excretion of Surface-Modified Silica Nanoparticles[J]. Anal Chem, 2008, 80(24): 9597-9603. DOI:10.1021/ac801882g |
 2020, Vol. 47
2020, Vol. 47