文章信息
- 核磁共振诊断直肠癌盆腔侧方淋巴结转移价值的Meta分析
- Value of Magnetic Resonance Imaging in Diagnosis of Pelvic Lateral Lymph Node Metastasis in Rectal Cancer:A Meta-analysis
- 肿瘤防治研究, 2020, 47(1): 52-57
- Cancer Research on Prevention and Treatment, 2020, 47(1): 52-57
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.0706
- 收稿日期: 2019-05-30
- 修回日期: 2019-09-28
2. 362000 泉州, 泉州医学高等专科学校附属人民医院妇产科
2. Department of Obstetrics and Gynecology, Quanzhou Medical College People's Hospital Affiliated, Quanzhou 362000, China
直肠癌是最常见的癌症之一, 即使接受根治性全直肠系膜切除术的中晚期直肠癌患者中, 约5%~40%的患者出现局部复发[1]。局部晚期直肠癌患者的生存率仍然很低。据报道, 盆腔侧方淋巴结转移(pelvic lateral lymph node metastasis, PLLNM)可能是中晚期直肠癌局部复发和预后不良的最重要因素[2-3], 并且与癌症特异性死亡率高度相关[4]。因此, 准确判断是否发生PLLNM具有非常重要的意义。磁共振成像(magnetic resonance imaging, MRI)是临床上常用的影像学检查手段, 并且可用于确定直肠癌的治疗策略[5]。目前MRI诊断淋巴结转移的标准包括淋巴结大小、形状和边界等[6]。但是, 何种指标是最佳诊断PLLNM的标准没有达成共识。近年来, 虽然关于MRI诊断直肠癌侧方淋巴结转移的文章逐年增多, 但多数属于小样本研究[7]。因此, 本Meta分析的目的是评估基于侧方淋巴结最短径标准的MRI诊断PLLNM的效能。
1 资料与方法 1.1 纳入与排除标准 1.1.1 研究类型国内外公开发表的关于MRI诊断直肠癌盆腔侧方淋巴结转移的诊断性试验。
1.1.2 研究对象经病理学证实的直肠癌患者, 肿瘤分期及具体病理类型不限, 手术方式必须包括侧方淋巴结清扫术。
1.1.3 诊断方法待评价试验为术前行MRI检查, 并进行直肠癌盆腔侧方淋巴结影像学评估转移的诊断性试验, 以术后病理学诊断结果为金标准。
1.1.4 排除标准(1) 非中、英文文献; (2)重复发表的研究; (3)不能获取全文者; (4)文献无法提取完整的四格表数据; (5)动物实验。
1.2 文献检索策略计算机检索PubMed、Web of Science、The Cochrane Library、CNKI和WanFang Data数据库, 搜集MRI诊断直肠癌盆腔侧方淋巴结转移的诊断性试验, 检索时限从建库至2019年3月。文后的参考文献也被进一步收集以提高查全率。检索采用主题词和自由词相结合的方式进行。中文检索词包括:直肠癌、直肠恶性肿瘤、磁共振、磁共振成像、盆腔淋巴结转移、诊断性试验; 英文检索词包括:Rectal cancer, rectal malignancy, magnetic resonance imaging, pelvic lymph node metastasis, diagnostic test等。以PubMed为例, 其具体检索策略为:#1 Rectal neoplasm[Mesh] OR Rectal malignancy OR Rectal cancer; #2 Magnetic resonance imaging[Mesh] OR MRI; #3 Lateral pelvic lymph nodes; #4 #1 AND #2 AND #3。
1.3 文献筛选与资料提取由两位系统评价员独立筛选文献、提取资料并交叉核对。如遇分歧, 则与第三方共同讨论解决。按事先设计好的表格进行数据提取, 必要时与文章原作者联系获得更详细资料。提取内容包括:(1)纳入研究的基本信息, 包括第一作者、发表年份、试验中心、研究类型等; (2)研究对象的基本特征, 包括样本量、年龄等; (3)诊断试验的主要参数:真阳性(TP)、假阳性(FP)、假阴性(FN)、真阴性(TN); (4)偏倚风险评价的相关指标。
1.4 纳入研究的偏倚风险评价采用QUADAS-2(Quality assessment for diagnostic accuracy studies-2)工具评价纳入研究的偏倚风险[8], 评价的条目包括偏倚的风险和适用性, 前者包括研究对象选择、待评价试验、金标准、病例流程和进展情况四个条目; 后者包括研究对象选择、待评价试验、金标准三个条目。评价时交叉核对, 意见不一致时通过讨论解决, 讨论未果则由第三名研究人员协助判断。
1.5 统计学方法基于Reitsma等[9]提出的双变量模型, 采用Stata15.0软件进行统计分析。首先评价其是否具有无阈值效应, 绘制ROC曲线平面图。根据ROC曲线分布是否呈"肩臂状"及相关系数的P值是否大于0.05判断阈值效应。计算其合并的敏感度(sensitivity, Sen)、特异性(specificity, Spe)、阳性似然比(+LR)、阴性似然比(-LR)、诊断比值比(diagnostic odds ratio, DOR), 并绘制汇总的SROC曲线, 计算AUC值。根据Deeks等提出的回归方法, 以样本含量与效应量DOR作Deeks漏斗图检测是否存在发表偏倚[10]。
2 结果 2.1 文献筛选流程及结果初检共获得287篇文献, 根据纳入与排除标准, 经逐层筛选后, 最终纳入11个研究[6-7, 11-19], 包含1 059例患者。文献筛选流程及结果见图 1。
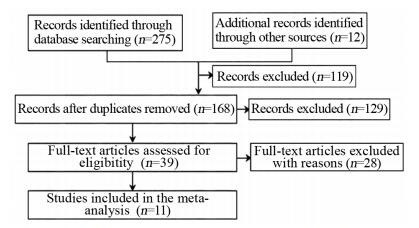
|
| The number of studies searched in the following databases were: PubMed(n=37), EMbase(n=6), The Cochrane Library(n=12), CNKI(n=108), WanFang Data(n=112). 图 1 文献筛选流程图 Figure 1 Flow chart of literature screening |
纳入研究的基本特征见表 1。
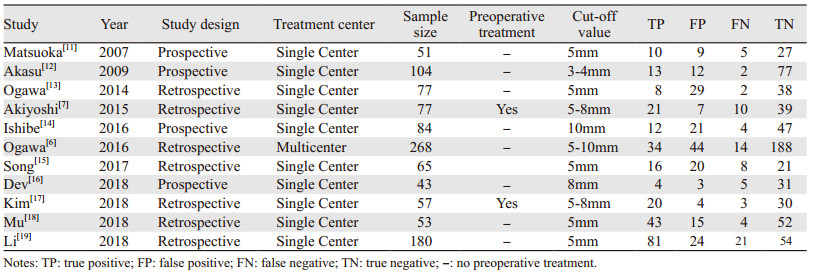
|
在病例对象选择条目中, 6项研究因为没有提供是否连续入组而被认为不明确偏倚风险[6, 11, 14-15, 18-19]。在待评价试验条目中, 4项研究因为未提供盲法被认为偏倚风险不明确[6, 13, 16, 19], 1项研究阈值设定不明确被判断为偏倚高风险[11]。在金标准设置方面, 1项研究被评价为风险不明确[11]。在病例流程和进展情况条目中, 3项研究因为没有连续入组被认为高偏倚风险[6-7, 12], 6项研究因为描述不清, 被评价为偏倚风险不明确[11, 13-16, 19]。质量评价结果条例图和总结图见图 2~3。
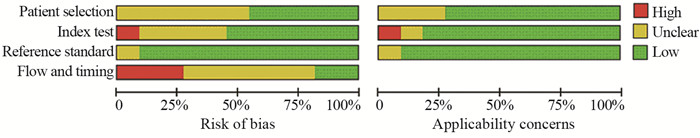
|
| 图 2 MRI诊断直肠癌盆腔侧方淋巴结转移价值的病例质量评价结果条例图 Figure 2 Risk of bias and applicability concerns graph of diagnostic value of MRI for pelvic lateral lymph node metastasis of rectal cancer |
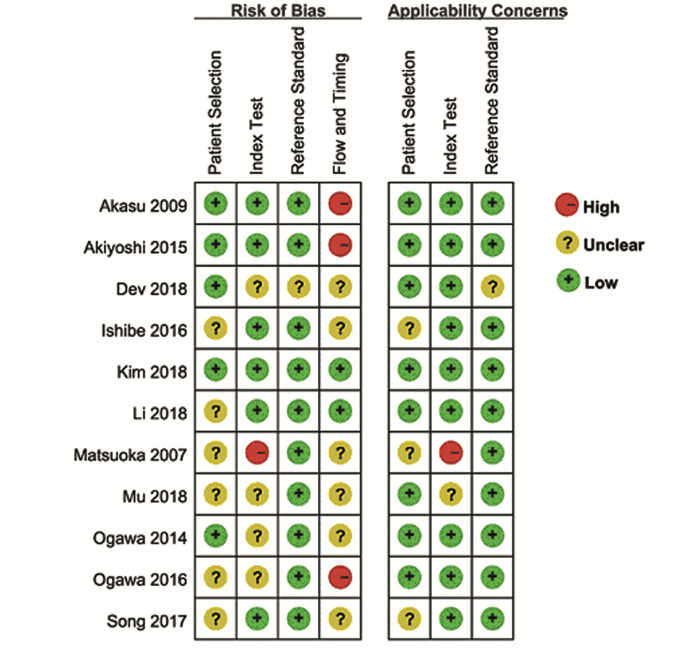
|
| 图 3 MRI诊断直肠癌盆腔侧方淋巴结转移价值的病例质量评价结果总结图 Figure 3 Risk of bias and applicability concerns summary of diagnostic value of MRI for pelvic lateral lymph node metastasis of rectal cancer |
通过SROC曲线可以看出, 曲线不呈肩臂状分布。Spearman相关系数=0.04, P=0.00, 提示不存在阈值效应。
2.4.2 异质性检验对11个研究进行合并分析, Sen合并、Spe合并均存在显著异质性。异质性统计量I2值分别为:45.79%(95% CI:7.85~83.72)、79.66%(95% CI:68.24~91.09);Q值分别为18.45、49.17。通过Meta回归, 结果显示研究设计有统计学意义, 是重要的异质性来源, 见表 2。
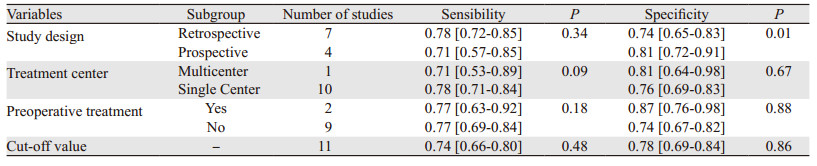
|
MRI诊断直肠癌侧方淋巴结转移的Sen合并、Spe合并、+LR合并、-LR合并、DOR合并分别为0.77(95% CI:0.38~0.88)、0.77(95% CI:0.69~0.83)、3.3(95% CI:2.4~4.5)、0.3(95% CI:0.23~0.41)、11(95% CI:6~18), 见图 4。
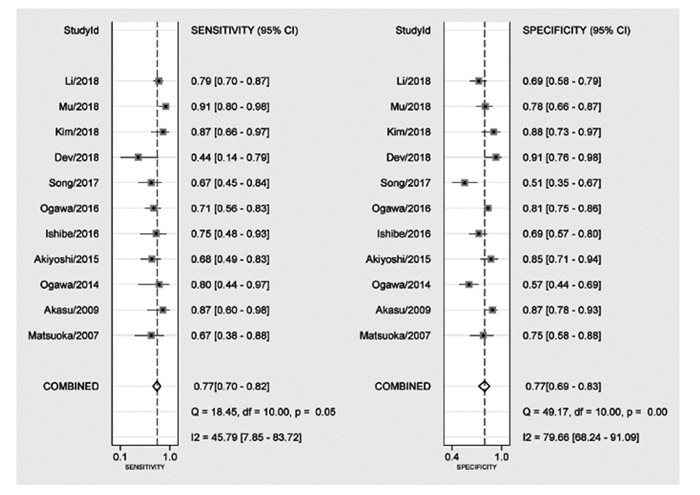
|
| 图 4 MRI诊断直肠癌盆腔侧方淋巴结转移的敏感度和特异性森林图 Figure 4 Forest plot of sensitivity and specificity of MRI in diagnosis of pelvic lateral lymph node metastasis of rectal cancer |
MRI诊断直肠癌侧方淋巴结转移的SROC曲线, 其AUC为0.83(95% CI:0.80~0.86), 见图 5。
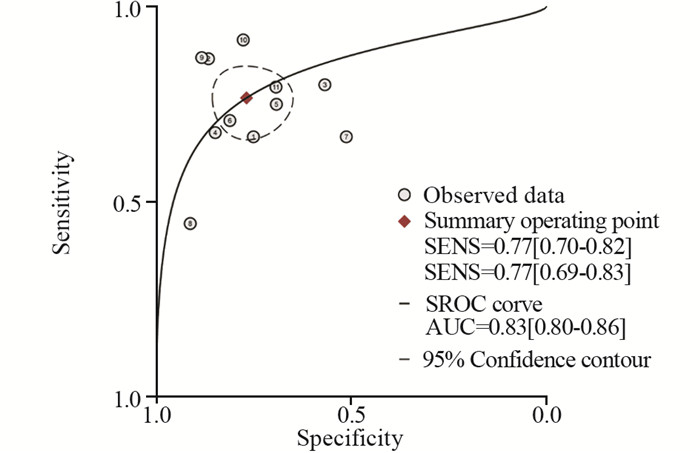
|
| 图 5 MRI诊断直肠癌盆腔侧方淋巴结转移的SROC曲线 Figure 5 SROC curve of MRI diagnosis of pelvic lateral lymph node metastasis of rectal cancer |
以诊断比值比(DOR)为横坐标, 有效样本量的平方根的倒数为纵坐标绘制漏斗图, 漏斗图趋近于垂直, 提示无发表偏倚(P=0.81), 见图 6。
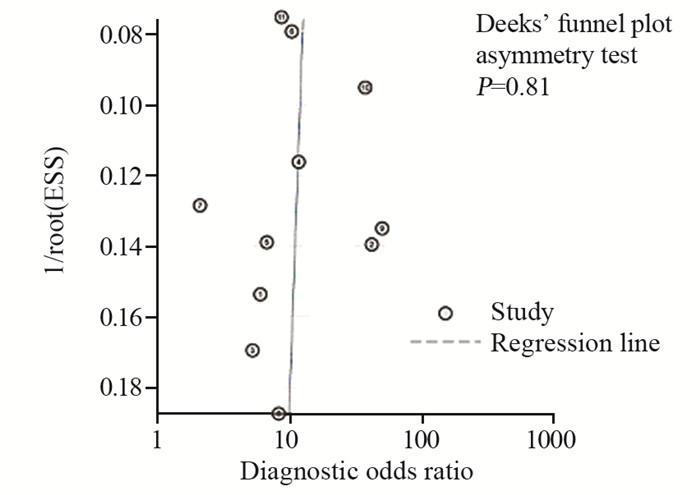
|
| 图 6 MRI诊断直肠癌盆腔侧方淋巴结转移的发表偏倚漏斗图 Figure 6 Funnel plot of publication bias about MRI diagnosis of pelvic lateral lymph node metastasis of rectal cancer |
低位直肠癌的侧方盆腔淋巴结切除术存在争议[4]。在我国和日本, 对于局部晚期低位直肠癌患者, 常规进行盆腔侧方淋巴结切除术, 而在西方国家则不常规进行[20-24]。NCCN直肠癌诊疗指南中没有提及侧方淋巴结的概念, 但日本大肠癌规约则认为有适应证的低位直肠癌应行侧方淋巴结清扫术[25]。西方学者认为直肠癌患者发生侧方淋巴结转移是全身疾病, 侧方淋巴结清扫并不能改善直肠癌患者的结局; 相反, 日本学者则认为是局部疾病, 对低位直肠癌规范手术为全直肠系膜切除术(total mesorectal excision, TME)+侧方淋巴结清扫[25]。
日本JCOG0212研究报道了预防性侧方淋巴结清扫术的近远期临床疗效[24, 26]。从报道的数据看, 侧方淋巴结转移阳性率为7%, 进行侧方淋巴结清扫需要更长的手术时间、更多的术中出血量, 3、4级严重术后并发症无明显差异。随访结果分析显示, TME+侧方淋巴结清扫组的局部复发率, 尤其是盆侧壁复发率更低。日本JCOG 0212研究是目前国际上唯一报道直肠癌预防性盆腔侧方淋巴结清扫长期随访结果的多中心随机对照研究。然而, 该研究属于非劣效研究设计, 仍具有较大争议, 需进一步进行优势性多中心随机对照研究方能阐明其临床意义[20]。由于侧方淋巴结清扫术带来的术后并发症风险, 术前正确评价直肠癌是否发生侧方淋巴结极为重要[7]。
MRI已成为直肠癌术前评估的关键诊断成像模式[17]。MRI应用于直肠癌患者的术前评估的目的是为了评价肿瘤深度和淋巴结转移。尽管多数学者认为MRI评估肿瘤侵袭深度的准确性优于CT, 但MRI确定淋巴结状态的准确性不如局部肿瘤分期可靠[27]。一项Meta分析显示, MRI诊断肿瘤浸润深度的合并敏感度和特异性分别为0.87(95% CI:0.81~0.92)、0.75(95% CI:0.68~0.80), 而淋巴结转移的合并敏感度和特异性分别为0.77(95% CI:0.69~0.84)和0.71(95% CI:0.59~0.81)。笔者认为, MRI诊断淋巴结转移的价值是不可接受的[28]。国内Li等发表了一项Meta分析, 旨在比较MRI、CT和直肠内超声检查(endorectal ultrasound, EUS)对直肠癌淋巴结转移的价值; 结果显示:MRI、EUS、CT诊断直肠癌淋巴结转移的敏感度、特异性和诊断比值比分别为:0.76(0.70, 0.81)、0.77(0.72, 0.81)、11(7, 15), 0.63(0.58, 0.68)、0.80(0.77, 0.83)、7(6, 9), 0.70(0.59, 0.79)、0.75(0.67, 0.81)、7(4, 11);研究发现, 三种检查手段对直肠癌淋巴结转移显示出相似的准确性(P=0.39)[29]。Ishihara等报道了一项FDG-PET/CT诊断直肠癌术前化疗后盆腔侧方淋巴结转移的价值, 结果显示, 以肿瘤最小直径大小≥ 12 mm和(或)SUV ≥ 1.6为阈值时, PET/CT诊断盆腔侧方淋巴结转移的准确性、敏感度、特异性、PPV和NPV分别为92.9%、88.2%、100%、100%和84.6%[30]。需要注意的是, Al-Sukhni和Li等报道的淋巴结是"直肠系膜切除术"后的淋巴结; 而全直肠系膜切除是目前直肠癌患者的标准手术方式。与Al-Sukhni等不同, 笔者研究的侧重点是MRI评价盆腔侧方淋巴结转移的诊断准确性。本文中笔者使用敏感度、特异性和诊断比值比研究了术前MRI对侧方淋巴结转移(lateral lymph node metastasis, LLNM)的诊断准确性。为了保证准确检测LLNM, 本研究只纳入行侧方淋巴结清扫和病理检查作为参考标准的研究。Meta分析结果显示, MRI诊断直肠癌侧方淋巴结转移的Sen合并、Spe合并分别为0.77(95% CI:0.38~0.88)、0.77(95% CI:0.69~0.83)。结果表明, MRI的诊断性能并不是特别好。
LLNM术前准确诊断至关重要, 因为侧方淋巴结是否转移可能影响治疗策略。然而目前并不清楚哪种影像学检查手段可以代替MRI用于诊断LLNM。相较于CT和PET/CT等检查手段, MRI是更流行的诊断手段。MRI诊断淋巴结性质的标准包括淋巴结短轴的最大尺寸、淋巴结的形状和信号强度等[15]。淋巴结短径大小是LLNM的最佳指标, 并且病理学证实淋巴结大小与病变的性质具有显著相关性[31]。关于预测转移性淋巴结的大小标准尚未达成共识。在使用MRI诊断转移盆腔侧方淋巴结(pelvic lateral lymph node, PLLN)性质时, 淋巴结大小似乎仍然是最可靠的参数。因此, 本Meta分析侧重于基于侧方淋巴结大小来系统评价MRI的诊断价值。正如本文纳入的研究所示, 不同的研究报道的阈值具有明显差异, 淋巴结阈值包括3 mm到10 mm。目前尚不清楚明确淋巴结转移的最佳临界值。根据既往的研究报道, 淋巴结短径≥ 8 mm可以获得最佳的诊断准确性[32]。采用更高的临界值, 例如10 mm, 可以获得更加的特异性, 但敏感度下降[32]。
本系统评价存在一定的局限性:(1)不同研究报道的MRI场强、淋巴结大小的测量及淋巴结转移的短径标准存在差别, 因此纳入研究的异质性是不可避免的。(2)部分采用回顾性研究设计, 缺乏盲法评价, 甚至部分研究并没有实现双人评价, 可能造成偏倚风险。(3)受原始资料的限制, 我们无法对MRI场强进行分析, 无法确定MRI最佳场强的影响。
综上所述, 以淋巴结短径为诊断标准, MRI诊断直肠癌侧方淋巴结转移的敏感度和特异性一般, 但在没有更佳的影像学筛查条件下, MRI仍然是被推荐的检查手段。
作者贡献
郑建清、李婷婷:原始文献收集与筛选、数据处理和统计学分析及文章执笔
肖丽华、吴敏:文献资料收集与质量评价、研究结果评估
黄碧芬:研究设计及文章修改与审校
| [1] |
Lezoche E, Guerrieri M, De Sanctis A, et al. Long-term results of laparoscopic versus open colorectal resections for cancer in 235 patients with a minimum follow-up of 5 years[J]. Surg Endosc, 2006, 20(4): 546-553. DOI:10.1007/s00464-005-0338-8 |
| [2] |
Ueno M, Oya M, Azekura K, et al. Incidence and prognostic significance of lateral lymph node metastasis in patients with advanced low rectal cancer[J]. Br J Surg, 2005, 92(6): 756-763. DOI:10.1002/bjs.4975 |
| [3] |
Fujita S, Yamamoto S, Akasu T, et al. Lateral pelvic lymph node dissection for advanced lower rectal cancer[J]. Br J Surg, 2003, 90(12): 1580-1585. DOI:10.1002/bjs.4350 |
| [4] |
Wu ZY, Wan J, Li JH, et al. Prognostic value of lateral lymph node metastasis for advanced low rectal cancer[J]. World J Gastroenterol, 2007, 13(45): 6048-6052. DOI:10.3748/wjg.v13.45.6048 |
| [5] |
Otowa Y, Yamashita K, Kanemitsu K, et al. Treating patients with advanced rectal cancer and lateral pelvic lymph nodes with preoperative chemoradiotherapy based on pretreatment imaging[J]. Onco Targets Ther, 2015, 8: 3169-3173. |
| [6] |
Ogawa S, Hida J, Ike H, et al. Selection of lymph node-positive cases based on perirectal and lateral pelvic lymph nodes using magnetic resonance imaging:study of the japanese society for cancer of the colon and rectum[J]. Ann Surg Oncol, 2016, 23(4): 1187-1194. DOI:10.1245/s10434-015-5021-2 |
| [7] |
Akiyoshi T, Matsueda K, Hiratsuka M, et al. Indications for Lateral Pelvic Lymph Node Dissection Based on Magnetic Resonance Imaging Before and After Preoperative Chemoradiotherapy in Patients with Advanced Low-Rectal Cancer[J]. Ann Surg Oncol, 2015, 22(Suppl 3): S614-S620. |
| [8] |
Whiting PF, Rutjes AW, Westwood ME, et al. QUADAS-2:a revised tool for the quality assessment of diagnostic accuracy studies[J]. Ann Intern Med, 2011, 155(8): 529-536. DOI:10.7326/0003-4819-155-8-201110180-00009 |
| [9] |
Reitsma JB, Glas AS, Rutjes AW, et al. Bivariate analysis of sensitivity and specificity produces informative summary measures in diagnostic reviews[J]. J Clin Epidemiol, 2005, 58(10): 982-990. DOI:10.1016/j.jclinepi.2005.02.022 |
| [10] |
Deeks JJ, Macaskill P, Irwig L. The performance of tests of publication bias and other sample size effects in systematic reviews of diagnostic test accuracy was assessed[J]. J Clin Epidemiol, 2005, 58(9): 882-893. DOI:10.1016/j.jclinepi.2005.01.016 |
| [11] |
Matsuoka H, Nakamura A, Masaki T, et al. Optimal diagnostic criteria for lateral pelvic lymph node metastasis in rectal carcinoma[J]. Anticancer Res, 2007, 27(5B): 3529-3533. |
| [12] |
Akasu T, Iinuma G, Takawa M, et al. Accuracy of high-resolution magnetic resonance imaging in preoperative staging of rectal cancer[J]. Ann Surg Oncol, 2009, 16(10): 2787-2794. DOI:10.1245/s10434-009-0613-3 |
| [13] |
Ogawa S, Itabashi M, Hirosawa T, et al. Lateral pelvic lymph node dissection can be omitted in lower rectal cancer in which the longest lateral pelvic and perirectal lymph node is less than 5 mm on MRI[J]. J Surg Oncol, 2014, 109(3): 227-233. DOI:10.1002/jso.23478 |
| [14] |
Ishibe A, Ota M, Watanabe J, et al. Prediction of lateral pelvic lymph-node metastasis in low rectal cancer by magnetic resonance imaging[J]. World J Surg, 2016, 40(4): 995-1001. DOI:10.1007/s00268-015-3299-7 |
| [15] |
宋幸鹤, 杨素行, 王屹. 高分辨率MRI检查诊断直肠癌淋巴结转移及分期的准确性[J]. 中华消化外科杂志, 2017, 16(8): 865-873. [Song XH, Wang SX, Wang Y. Accuracy of highresolution magnetic resonance imaging in diagnosis of the lymph node metastases and stage of rectal cancer[J]. Zhonghua Xiao Hua Wai Ke Za Zhi, 2017, 16(8): 865-873. DOI:10.3760/cma.j.issn.1673-9752.2017.08.021] |
| [16] |
Dev K, Veerenderkumar KV, Krishnamurthy S. Incidence and predictive model for lateral pelvic lymph node metastasis in lower rectal cancer[J]. Indian J Surg Oncol, 2018, 9(2): 150-156. DOI:10.1007/s13193-017-0719-1 |
| [17] |
Kim MJ, Hur BY, Lee ES, et al. Prediction of lateral pelvic lymph node metastasis in patients with locally advanced rectal cancer with preoperative chemoradiotherapy:Focus on MR imaging findings[J]. PLoS One, 2018, 13(4): e0195815. DOI:10.1371/journal.pone.0195815 |
| [18] |
李铭, 段成洲, 张玉兴, 等. MRI对直肠癌及局部淋巴结转移的诊断效能研究[J]. 中国CT和MRI杂志, 2018, 16(11): 124-127. [Li M, Duan CZ, Zhang YX, et al. MRI diagnosis of rectal cancer with local lymph node metastasis[J]. Zhongguo CT He MRI Za Zhi, 2018, 16(11): 124-127. DOI:10.3969/j.issn.1672-5131.2018.11.037] |
| [19] |
牟东景. 3.0TMR扩散加权成像对直肠癌盆腔淋巴结转移的诊断价值[J]. 中华普外科手术学杂志(电子版), 2018, 12(4): 343-345. [Mu DJ. The diagnostic value of 3.0T MR diffusion weighted imaging for pelvic lymph node metastasis of rectal cancer[J]. Zhonghua Pu Wai Ke Shou Shu Xue Za Zhi(Dian Zi Ban), 2018, 12(4): 343-345. DOI:10.3877/cma.j.issn.1674-3946.2018.04.023] |
| [20] |
韩方海, 周声宁. 直肠癌侧方淋巴结清扫的再思考[J]. 中华结直肠疾病电子杂志, 2018, 7(5): 407-411. [Han FH, Zhou SN. Take a second thought about lateral pelvic lymph node dissection of rectal cancer[J]. Zhonghua Jie Zhi Chang Ji Bing Dian Zi Za Zhi, 2018, 7(5): 407-411. DOI:10.3877/cma.j.issn.2095-3224.2018.05.002] |
| [21] |
Matsuoka H, Masaki T, Sugiyama M, et al. Impact of lateral pelvic lymph node dissection on evacuatory and urinary functions following low anterior resection for advanced rectal carcinoma[J]. Langenbecks Arch Surg, 2005, 390(6): 517-522. DOI:10.1007/s00423-005-0577-0 |
| [22] |
Shiozawa M, Akaike M, Yamada R, et al. Lateral lymph node dissection for lower rectal cancer[J]. Hepatogastroenterology, 2007, 54(76): 1066-1070. |
| [23] |
Sato H, Maeda K, Maruta M, et al. Who can get the beneficial effect from lateral lymph node dissection for Dukes C rectal carcinoma below the peritoneal reflection?[J]. Dis Colon Rectum, 2006, 49(Suppl 10): S3-S12. |
| [24] |
Fujita S, Mizusawa J, Kanemitsu Y, et al. Mesorectal excision with or without lateral lymph node dissection for clinical stage Ⅱ/Ⅲ lower rectal cancer (JCOG0212):a multicenter, randomized controlled, noninferiority trial[J]. Ann Surg, 2017, 266(2): 201-207. DOI:10.1097/SLA.0000000000002212 |
| [25] |
Akiyoshi T, Watanabe T, Miyata S, et al. Results of a Japanese nationwide multi-institutional study on lateral pelvic lymph node metastasis in low rectal cancer:is it regional or distant disease?[J]. Ann Surg, 2012, 255(6): 1129-1134. DOI:10.1097/SLA.0b013e3182565d9d |
| [26] |
Fujita S, Akasu T, Mizusawa J, et al. Postoperative morbidity and mortality after mesorectal excision with and without lateral lymph node dissection for clinical stage Ⅱ or stage Ⅲ lower rectal cancer (JCOG0212):results from a multicentre, randomised controlled, non-inferiority trial[J]. Lancet Oncol, 2012, 13(6): 616-621. DOI:10.1016/S1470-2045(12)70158-4 |
| [27] |
Lee JH, Jang HS, Kim JG, et al. Prediction of pathologic staging with magnetic resonance imaging after preoperative chemoradiotherapy in rectal cancer:pooled analysis of KROG 10-01 and 11-02[J]. Radiother Oncol, 2014, 113(1): 18-23. |
| [28] |
Al-Sukhni E, Milot L, Fruitman M, et al. Diagnostic accuracy of MRI for assessment of T category, lymph node metastases, and circumferential resection margin involvement in patients with rectal cancer:a systematic review and meta-analysis[J]. Ann Surg Oncol, 2012, 19(7): 2212-2223. DOI:10.1245/s10434-011-2210-5 |
| [29] |
Li XT, Sun YS, Tang L, et al. Evaluating local lymph node metastasis with magnetic resonance imaging, endoluminal ultrasound and computed tomography in rectal cancer:a metaanalysis[J]. Colorectal Dis, 2015, 17(6): O129-O135. DOI:10.1111/codi.12909 |
| [30] |
Ishihara S, Kawai K, Tanaka T, et al. Diagnostic value of FDGPET/CT for lateral pelvic lymph node metastasis in rectal cancer treated with preoperative chemoradiotherapy[J]. Tech Coloproctol, 2018, 22(5): 347-354. DOI:10.1007/s10151-018-1779-0 |
| [31] |
Hatano S, Ishida H, Ishiguro T, et al. Prediction of metastasis to mesorectal, internal iliac and obturator lymph nodes according to size criteria in patients with locally advanced lower rectal cancer[J]. Jpn J Clin Oncol, 2015, 45(1): 35-42. DOI:10.1093/jjco/hyu162 |
| [32] |
Faletti R, Gatti M, Arezzo A, et al. Preoperative staging of rectal cancer using magnetic resonance imaging:comparison with pathological staging[J]. Minerva Chir, 2018, 73(1): 13-19. |
 2020, Vol. 47
2020, Vol. 47
