文章信息
- Notch信号通路可通过激活Slug调控骨肉瘤上皮-间质转化
- Notch Signaling Pathway Regulates Epithelial-mesenchymal Transition of Osteosarcoma by Activating Slug
- 肿瘤防治研究, 2020, 47(1): 6-12
- Cancer Research on Prevention and Treatment, 2020, 47(1): 6-12
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.0704
- 收稿日期: 2019-05-30
- 修回日期: 2019-10-28
骨肉瘤是最常见的间叶组织来源的原发恶性骨肿瘤, 好发于青少年, 恶性程度高, 预后差[1-2]。自20世纪70年代以来, 化疗和保肢手术的进展提高了骨肉瘤患者存活率, 但并发化疗耐药和肺转移使患者5年生存率不足20%[3-4], 给患者带来了巨大痛苦和经济负担, 因此亟需寻求新的治疗方案。
上皮间质转化(epithelial-mesenchymal transition, EMT)是上皮细胞失去极性, 减少细胞-细胞黏附获得迁移和侵袭而成为间充质细胞的生物学过程[5]。研究表明多种转录因子(Snail/Slug、Zeb1/2及Twist1/2等)参与该过程, 并伴随细胞-细胞黏附分子E-cadherin减少, 波形蛋白vimentin、N-钙黏蛋白N-cadherin和平滑肌肌动蛋白等可塑蛋白含量增多[5-6]。研究发现骨肉瘤出现侵袭与转移时也伴随EMT发生, 然而促使肿瘤发生EMT的因素有很多, 包括转录因子表达上调、上皮表型蛋白丢失及信号转导通路的开放等, 目前机制尚不清楚[7-9]。
Notch信号通路在进化过程中高度保守, 与细胞的增殖、分化与凋亡有重要关系[10]。研究表明Notch信号通路介导多种肿瘤细胞EMT过程, 与肿瘤发生发展、侵袭与转移过程有着密切的关系[11-13], 包括骨肉瘤[14], 但Notch信号通路对骨肉瘤EMT调控机制尚不清楚, 仍需进一步研究。
本研究通过调控Notch信号通路活性进行体外、体内实验, 研究其调控骨肉瘤EMT的具体机制, 旨在通过激活和关闭Notch信号通路, 检测其对骨肉瘤EMT的影响; 系统探索Notch信号通路对转录因子Slug的调控在骨肉瘤EMT过程中的作用及机制, 以期为治疗骨肉瘤提供新策略和实验依据。
1 材料与方法 1.1 试剂与仪器人骨肉瘤细胞143B细胞系由中国科学院上海生物研究所提供, 慢病毒购自上海吉凯基因化学技术有限公司, DMEM高糖和DMEM/F12(1:1)培养液购自美国Gibco公司, 新生胎牛血清(fetal bovine serum, FBS)购自澳洲Gibco公司, 青/链霉素及嘌呤霉素购自杭州吉诺公司, 磷酸盐(phosphate buffer saline, PBS)缓冲液购自美国ExCell Biology公司, 二甲基亚砜购自上海久亿化学试剂有限公司, DAPT及B27购自美国Sigma公司, 表皮生长因子(epidermal growth factor, EGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)购自美国BioLegend公司, TRIzol购自美国Invitrogen公司。qRT-PCR试剂盒购自日本YOYOBO公司, Western blot试剂盒购自中国生工生物工程(上海)股份有限公司, Slug购自美国Abcam公司, 细胞培养箱购自日本SANYO公司, 倒置显微镜购自日本Olympus公司, 紫外分光光度计购自英国Genova Nann公司, 荧光定量PCR仪购自美国Bio-Rad公司。
1.2 细胞培养人骨肉瘤143B细胞温浴培养于10%FBS的DMEM高糖培养基(含10%新生胎牛血清、100 u/ml青霉素和100 μg/ml链霉素)中, 每3天更换新鲜培养基, 并于37℃、5%CO2恒温培养箱内培养, 当细胞铺满90%培养瓶时, 采用0.25%胰蛋白酶进行消化传代培养至对数期。
取对数生长期143B骨肉瘤细胞接种于由DMEM/F12(1:1)、B27(2%)、EGF(20 ng/ml)和bFGF(20 ng/ml)组成的无血清培养基内培养, 置于37℃、5%CO2饱和湿度的环境下培养。
1.3 细胞转染在室温下融化慢病毒颗粒, 使用前轻轻混匀, 向培养液中加入慢病毒颗粒以感染细胞。轻轻震动培养板使其混匀并孵育过夜, 于第3天移去培养液并添加5 ml新鲜培养基, 第4天按1:3~1:5传代并在培养基中添加嘌呤霉素筛选培养14天。将骨肉瘤143B细胞根据感染病毒种类的不同分为三组:感染NICD1过表达慢病毒(NICD1-OE组), shRNA慢病毒(RBPJ-shRNA组)和对照慢病毒(CON组)。
1.4 Western blot分析蛋白表达变化用细胞裂解液提取处理后的骨肉瘤143B细胞细胞质蛋白, BCA法进行蛋白定量。吸取40 μg蛋白经10%聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后, 转入聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜。5%脱脂奶粉封闭1.5 h, 加入相应-抗4℃孵育过夜。经三乙醇胺缓冲盐+Tween 20溶液漂洗3次后, 采用1:3 000辣根过氧化物酶二抗室温孵育2 h。在暗室中将PVDF膜用发光剂显色曝光分析结果。以目的蛋白与β-actin的灰度比值表示蛋白表达水平。
1.5 免疫荧光染色观察EMT标记E-cadherin和N-cadherin蛋白将玻片在酒精灯上过火, 放入24孔板中, 消化细胞, 终止消化后离心弃去培养液, 用PBS洗涤1~2遍。重悬后以5×105个/毫升的密度接种入24孔板中, 取无血清DMEM培养基饥饿处理2 h, 转染试剂LipofectamineTM2000配制质粒悬液, 混匀, 静置20 min后加入孔中。8 h后换含血清培养基培养2~3天。弃去培养基, PBS洗涤2~3遍, 冰上处理。加入4%多聚甲醛固定15 min, PBS洗3次×3 min, 0.3%Triton-X-100室温通透20 min。PBS洗3次×3 min, 吸水纸吸干PBS, 滴加山羊血清, 室温封闭30 min。弃去血清, 滴加1%牛血清白蛋白稀释的一抗E-cadherin(1:200稀释)和N-cadherin(1:200稀释), 4℃过夜。次日, 弃去一抗, PBS洗3次×5 min, 加入荧光二抗, 避光孵育1 h。DAPI复染细胞核6 min, 避光, PBS洗3次×5 min。取出玻片, 载玻片加防荧光淬灭封片剂, 将玻片细胞片贴于载玻片上, 荧光显微镜观察并拍摄照片。
1.6 qRT-PCR检测基因表达的变化分别按照TRIzol总RNA提取试剂盒和Fermentas提供的RevertAidTM第一链cDNA合成试剂盒操作方案提取RNA并进行反转录。利用序列检测系统ABI PRISM 7 000进行序列扩增。热循环条件为50℃ 2 min、95℃ 10 min、59℃ 1 min, 95℃、15 s进行40个循环。GAPDH为内参。
1.7 TranswellTM侵袭实验用无血清的DMEM培养基按体积1:3稀释Matrigel, 将TranswellTM小室放入24孔板中, 上室加入50 μl稀释后的Matrigel, 于37℃恒温无菌培养箱中孵育30 min, 吸出Matrigel表面液体。收集骨肉瘤143B细胞, 用胰蛋白酶消化并重悬细胞, 调整细胞密度为2×105个/毫升, 上室加入200 μl细胞悬液, 下室加入500 μl含15%FBS的DMEM培养液。于37℃恒温无菌培养箱中培养24 h。取出小室, 棉签擦去未侵袭的细胞, 40 g/L多聚甲醛固定10 min, 晾干后加入结晶紫染色10 min, PBS漂洗3次, 晾干后于正置光学显微镜下观察滤膜底附着的细胞数。每组随机选取5个视野(×200), 计数每个视野穿过的细胞数。每组实验均独立重复3次。
1.8 划痕实验取传代一致的细胞, 调整细胞浓度至1×103个/毫升, 接种于6孔板, 采用10 μl微量加样枪头划出无细胞区。采用磷酸缓冲液吸取划痕后脱落的细胞并进行拍照。培养24及48 h, 分别拍照, 观察细胞迁移能力。细胞迁移率(%)=(0 h划痕距离-24 h(或48 h)划痕距离)/0 h划痕距离×100%。
1.9 siRNA转染143B细胞和NICD1-OE细胞传代培养, 生长至50%融合后, 以7×108个/毫升的密度接种至6孔培养板中, 培养过夜。根据转染细胞不同将实验分成4组:对照组(con组)、空白对照组(blank组)、无关siRNA处理组(mock组)、Slug siRNA处理组(siRNA组)。转染以每孔为例:取5 μl 20 nmol/L的siRNA储存液(ERK1/2siRNA(购自Santa Cruz公司, #sc-29307, 50 nmol/L)或阴性对照siRNA(购自Santa Cruz公司, #sc-37007, 50 nmol/L), Slug siRNA(广州锐博公司合成, Gen Bank accession No. AK223368。Sense:5'-GATCCGACTACAGTCCAAGGTTTCTTCAAGACGTTGATGTCAGGTTCGAAAGTTTTTGAATTCA-3';antisense:3'-CTAGGCTGATGTCCAGGTTCGAAAGAAGTTCTGCAACTACAGTCCAAGCTTTCAAAAACTTAAGT-5';100 nmol/L)与250 ml OPTIMEM培养基混合均匀成A液; 取5 μl Lipofectamine2000与250 ml OPTIMEM培养基混合均匀成B液, 分别室温放置5 min, 将A液和B液混合, 室温放置20 min, 将混合液加入6孔板中, 每孔加入无血清培养基至2 ml, 培养箱中孵育6 h, 更换成完全培养基, 按照实验要求处理细胞, 进行后续实验。
1.10 体内成瘤实验根据小鼠成瘤时注射细胞的不同, 将雄性无胸腺裸鼠随机分为三组:NICD1过表达组(NICD1组)、DAPT抑制剂组(DAPT组)和对照组(control组), 6只/组, NICD1组于右背部皮下注射1×105个NICD1细胞。DAPT组于右背部皮下注射1×105个143B细胞, 并给予DAPT处理:DAPT溶于DMSO中, 腹腔注射给药, 每天10 mg/kg, 连续1周。对照组于右背部皮下注射1×105个143B细胞, 并给予相应体积DMSO腹腔注射作为对照处理。
观察裸鼠的一般状态和肿瘤形成情况。于第8周脱颈处死小鼠, 测量小鼠肿瘤的体积和重量。qRT-PCR检测各组肿瘤组织中Slug、N-cadherin表达情况, 所有动物实验均经武汉大学人民医院伦理委员会批准(批准号20150419)。
1.11 统计学方法应用SPSSl6.0软件进行统计学分析, 计量数据以均数±标准差(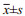
采用慢病毒感染系统构建了调控Notch通路NICD1表达的143B稳转细胞系, qRT-PCR和Western blot结果显示NICD1-OE组NICD1表达量较CON组显著上调(2.312±0.094 vs. 1.382±0.136, P=1.51E-06)。RBPJ-shRNA组NICD1表达量为0.364±0.055, 与CON组差异有统计学意义(P=1.52E-07), 见图 1A~B。
|
| 图 1 Notch通路促进骨肉瘤细胞上皮-间质转化 Figure 1 Notch pathway promoted epithelial-mesenchymal transition of osteosarcoma cells |
免疫荧光染色结果显示, E-cadherin的表达在NICD1-OE组与CON组中无明显差异, 而N-cadherin的表达较CON组显著上调, 且在RBPJ-shRNA细胞中下调, 见图 1C。相差显微镜观察结果显示NICD1-OE组细胞长/短轴比率为3.567±0.199, CON组为2.634±0.263, 差异有统计学意义(P=1.07E-06)。RBPJ-shRNA组长/短轴比率为1.269±0.202, 与CON组差异有统计学意义(P=2.68E-07), 见图 1D。
Western blot和qRT-PCR结果显示, Slug相对表达量在NICD1-OE组、RBPJ-shRNA组和CON组分别为1.783±0.118、0.440±0.113和1.187±0.119, 差异有统计学意义(NICD1-OE vs. CON:P=0.0003; RBPJ-shRNA vs. CON:P=0.0097);Twist相对表达量分别为1.420±0.095、0.291±0.089及0.990±0.191, 差异均有统计学意义(NICD1-OE vs. CON:P=0.012; RBPJ-shRNA vs. CON:P=0.024), 见图 1E~F。
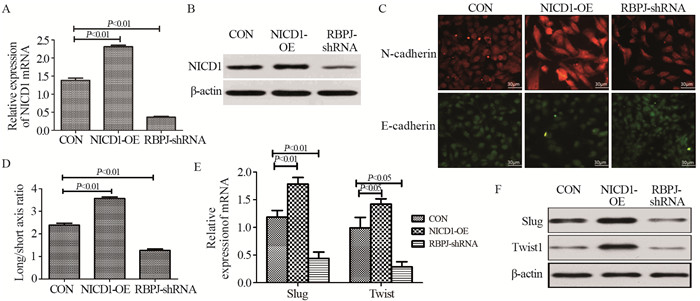
2.2 Notch通路促进骨肉瘤细胞迁移和侵袭细胞划痕实验结果显示, 与CON组相比, RBPJ-shRNA组细胞的迁移率显著降低, 而NICD1-OE组细胞迁移率显著增强, (24 h:NICD1-OE vs. CON, P=0.006; RBPJ-shRNA vs. CON, P=0.003。48 h:NICD1-OE vs. CON, P=0.04; RBPJ-shRNA vs. CON, P=0.007), 见图 2A。
|
| 图 2 Notch通路促进骨肉瘤细胞迁移和侵袭 Figure 2 Notch pathway promoted migration(A) and invasion(B) of osteosarcoma cells |
Transwell实验结果显示, 与CON组侵袭细胞数目平均值(139.7±6.4个)相比, NICD1-OE组细胞(354.7±13.9个)的侵袭能力增强(P=0.023), 而RBPJ-shRNA组细胞(90.0±10.4个)的侵袭能力减弱(P=0.001), 见图 2B。
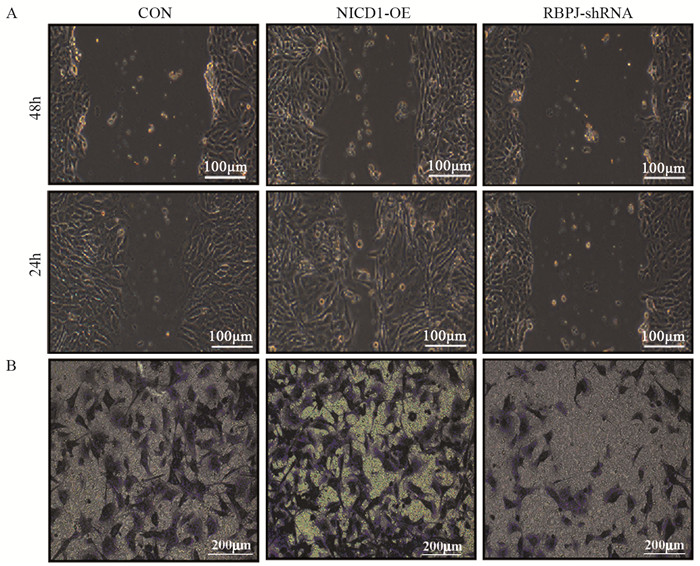
2.3 Notch信号通路促进骨肉瘤细胞体内成瘤小鼠注射骨肉瘤143B细胞后, 与control组相比, NICD1组达到同样肿瘤体积所需的成瘤时间缩短, DAPT组成瘤时间明显延长, 见图 3A。8周后NICD1组、control组和DAPT组肿瘤体积分别为(1715±127)、(633±42)和(104±14)mm3, 差异有统计学意义(NICD1 vs. control, P=0.002; DAPT vs. control, P=0.0005), 见图 3B; 三组肿瘤重量分别为(2080.0±45.8)、(693.3±15.3)和(617.0±13.5)mg, 差异有统计学意义(NICD1 vs. control, P=0.0001; DAPT vs. control, P=0.0029), 见图 3C。
|
| 图 3 Notch通路促进骨肉瘤细胞体内成瘤 Figure 3 Notch pathway promoted tumorigenesis in vivo of osteosarcoma cells |
qRT-PCR结果显示, NICD1组Slug和N-cadherin在离体骨肉瘤组织内的表达量明显升高, DAPT组显著下降, 差异均有统计学意义(Slug:NICD1 vs. control:P=3.28E-05, DAPT vs. control:P=0.002; N-cadherin:NICD1 vs. control:P=5.35E-08, DAPT vs. control:P=0.002), 见图 3D~E。
2.4 敲除Slug可反转Notch信号通路对骨肉瘤上皮-间质转化调控作用qRT-PCR和Western blot结果显示, 敲除Slug基因后blank组和mock组中Slug相对表达量分别为1.010±0.099和1.068±0.042, 差异无统计学意义(P=0.612);siRNA组Slug相对表达量为0.135±0.024, 与mock组相比显著降低(P=0.0004), 见图 4A~B。
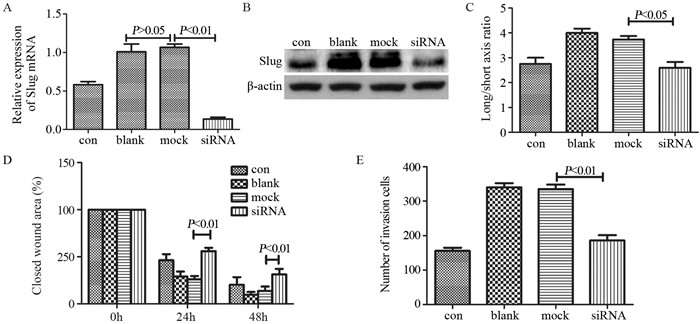
|
| 图 4 敲除Slug可逆转Notch信号通路对骨肉瘤上皮-间质转化的调控作用 Figure 4 Slug knockout reversed regulatory effect of Notch signaling pathway on EMT of osteosarcoma cells |
相差显微镜观察结果显示siRNA组细胞长/短轴比率为3.735±0.137, mock组为2.593±0.239, 差异有统计学意义(P=0.022), 见图 4C。
细胞划痕实验结果显示, 与mock相比, siRNA组细胞的迁移率显著增高, 差异有统计学意义(24 h, P=0.005; 48 h, P=0.003), 见图 4D。
Transwell实验结果显示, mock组侵袭细胞数目平均值为335.2±13.0个, siRNA组为185.7±15.9个, 差异有统计学意义(P=0.0009), 见图 4E。
3 讨论骨肉瘤生长迅速, 早期发生肺转移是目前世界上骨肉瘤相关致死的主要原因之一, 研究骨肉瘤的侵袭转移分子机制对治疗骨肉瘤和提高患者生存率有重要意义。研究表明肿瘤发生侵袭和转移是一个复杂、多因素、多步骤、多阶段、涉及多基因调节异常改变的生物学过程[15-18]。在此过程中上皮细胞原有的正常极性消失, 并失去与基底膜连接的上皮细胞表型(E-cadherin、α-Catenin、β-Catenin等), 从而获得抗凋亡和降解细胞外基质的能力及较高迁移与侵袭能力等间质细胞表型(vimentin、纤维连蛋白、N-cadherin等)[15, 19]。
有研究显示Notch信号通路参与肿瘤细胞EMT过程, 与肿瘤的侵袭转移过程有着密切的关系[20-21]。Yang等[14]发现Notch信号通路对低浓度阿霉素诱导骨肉瘤细胞EMT发挥着重要作用, 但具体机制尚未见报道。本研究通过慢病毒转染骨肉瘤143B细胞, 成功获得Notch信号通路激活或抑制的稳转骨肉瘤细胞系, 并进行体内外实验研究。在体外实验中, 通过免疫荧光染色观察EMT相关标志物E-cadherin及N-cadherin的表达, N-cadherin表达在Notch信号通路激活组显著升高, 在抑制组显著下调; 而E-cadherin表达在各组间并无显著变化, 与Fang等[22]研究结果一致。观察各组细胞形态变化发现, Notch信号通路激活后细胞形态呈梭形, 长短轴比率显著升高。应用qRT-PCR和Western blot检测结果显示Slug和Twist表达在Notch信号通路激活后显著上调, 并且Slug表达量更高。以上表明Notch信号通路激活能够促进骨肉瘤上皮细胞转化。然后我们通过细胞划痕实验和Transwell侵袭实验观察各组骨肉瘤细胞侵袭和转移的能力, 发现Notch信号通路激活后骨肉瘤侵袭和迁移能力显著增强, 而在通路抑制后侵袭和迁移能力显著降低。
为探讨Notch信号通路激活后的骨肉瘤细胞体内致瘤作用, 我们开展了动物实验, 于小鼠右背部皮下注射成瘤细胞, 选取瘤体大小较一致的老鼠, 剔除未接种成功的老鼠。成瘤实验结果表明小鼠成瘤率为70%~80%, Notch信号通路激活组肿瘤生长速度更快, 肿瘤的体积和重量显著增大。对离体的肿瘤组织进行qRT-PCR检测发现, Notch信号激活组的EMT标记蛋白Slug和N-cadherin表达量显著升高, 进一步证实Notch信号通路激活对骨肉瘤EMT具有促进作用。
为进一步探讨Notch信号通路激活促进骨肉瘤EMT的具体机制, 我们利用RNAi技术敲除Slug基因, 得到Slug基因缺失的骨肉瘤细胞系。对此细胞系进行相差显微镜观察, 发现其细胞长/短轴比率较未敲除Slug的NICD1-OE组细胞降低, 形态上偏球形。细胞划痕实验和Transwell实验结果发现敲除Slug基因后, 骨肉瘤细胞的侵袭和转移能力都有所减弱, 表明抑制Slug表达可以反转Notch信号通路激活诱导的EMT表型。
综上可知, Notch信号通路激活后可通过调控Slug表达促进骨肉瘤EMT, 影响细胞侵袭和转移能力, 靶向调控Slug表达或者其他EMT转录因子可能有助于阻止骨肉瘤在患者体内发生转移或恶化, 为临床治疗骨肉瘤提供新的策略。
作者贡献
陈敬腾:实验设计与实施、文章执笔
余铃:实验设计、文章审校
方硕、郭良煜:实验实施
郭卫春:实验评估及指导
| [1] |
Isakoff MS, Bielack SS, Meltzer P, et al. Osteosarcoma:Current Treatment and a Collaborative Pathway to Success[J]. J Clin Oncol, 2015, 33(27): 3029-3035. DOI:10.1200/JCO.2014.59.4895 |
| [2] |
王勃霖, 姜晓玲, 卢斌, 等. 骨肉瘤中miR-17-92基因簇作用的研究进展[J]. 肿瘤防治研究, 2019, 46(7): 635-638. [Wang BF, Jiang XL, Lu B, et al. Research Progress in Effect of miR-17-92 Cluster in of Osteosarcoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2019, 46(7): 635-638. DOI:10.3971/j.issn.1000-8578.2019.18.1988] |
| [3] |
李华杰, 宗治贤, 陈祝明, 等. 骨肉瘤的保肢治疗研究进展[J]. 系统医学, 2019, 4(4): 196-198. [Li HJ, Zong ZX, Chen ZM, et al. Research Progress in Conservative Treatment of Osteosarcoma[J]. Xi Tong Yi Xue, 2019, 4(4): 196-198.] |
| [4] |
Simpson S, Dunning MD, de Brot S, et al. Comparative review of human and canine osteosarcoma:morphology, epidemiology, prognosis, treatment and genetics[J]. Acta Vet Scand, 2017, 59(1): 71. DOI:10.1186/s13028-017-0341-9 |
| [5] |
Persa OD, Niessen CM. Epithelial polarity limits EMT[J]. Nat Cell Biol, 2019, 21(3): 299-300. DOI:10.1038/s41556-019-0284-7 |
| [6] |
Owusu-Akyaw A, Krishnamoorthy K, Goldsmith LT, et al. The role of mesenchymal-epithelial transition in endometrial function[J]. Hum Reprod Update, 2019, 25(1): 114-133. DOI:10.1093/humupd/dmy035 |
| [7] |
Nakaya Y, Sheng G. EMT in developmental morphogenesis[J]. Cancer Lett, 2013, 341(1): 9-15. DOI:10.1016/j.canlet.2013.02.037 |
| [8] |
Wushou A, Hou J, Zhao YJ, et al. Twist-1 up-regulation in carcinoma correlates to poor survival[J]. Int J Mol Sci, 2014, 15(12): 21621-21630. DOI:10.3390/ijms151221621 |
| [9] |
Zhang M, Wang D, Zhu T, et al. RASSF4 Overexpression Inhibits the Proliferation, Invasion, EMT, and Wnt Signaling Pathway in Osteosarcoma Cells[J]. Oncol Res, 2017, 25(1): 83-91. DOI:10.3727/096504016X14719078133447 |
| [10] |
Aster JC, Pear WS, Blacklow SC. The Varied Roles of Notch in Cancer[J]. Annu Rev Pathol, 2017, 12: 245-275. DOI:10.1146/annurev-pathol-052016-100127 |
| [11] |
Ito T, Kudoh S, Ichimura T, et al. Small cell lung cancer, an epithelial to mesenchymal transition (EMT)-like cancer:significance of inactive Notch signaling and expression of achaetescute complex homologue 1[J]. Hum Cell, 2017, 30(1): 1-10. |
| [12] |
Zhang J, Kuang Y, Wang Y, et al. Notch-4 silencing inhibits prostate cancer growth and EMT via the NF-kappaB pathway[J]. Apoptosis, 2017, 22(6): 877-884. DOI:10.1007/s10495-017-1368-0 |
| [13] |
De Francesco EM, Maggiolini M, Musti AM. Crosstalk between Notch, HIF-1alpha and GPER in Breast Cancer EMT[J]. Int J Mol Sci, 2018, 19(7): E2011. DOI:10.3390/ijms19072011 |
| [14] |
Yang J, Guo W, Wang L, et al. Notch signaling is important for epithelial-mesenchymal transition induced by low concentrations of doxorubicin in osteosarcoma cell lines[J]. Oncol Lett, 2017, 13(4): 2260-2268. DOI:10.3892/ol.2017.5708 |
| [15] |
胡涂, 杨庆诚, 程冬冬. 骨肉瘤转移侵袭机制研究进展[J]. 中国骨与关节杂志, 2015, 1: 41-44. [Hu T, Yang QC, Cheng DD. Research progress on the mechanism of metastasis and invasion of osteosarcoma[J]. Zhongguo Gu Yu Guan Jie Za Zhi, 2015, 1: 41-44. DOI:10.3969/j.issn.2095-252X.2015.01.011] |
| [16] |
Gou Y, Zhai F, Zhang L, et al. RUNX3 regulates hepatocellular carcinoma cell metastasis via targeting miR-186/E-cadherin/EMT pathway[J]. Oncotarget, 2017, 8(37): 61475-61486. |
| [17] |
Sharili AS, Allen S, Smith K, et al. Snail2 promotes osteosarcoma cell motility through remodelling of the actin cytoskeleton and regulates tumor development[J]. Cancer Lett, 2013, 333(2): 170-179. DOI:10.1016/j.canlet.2013.01.027 |
| [18] |
Yu Z, Zhang Y, Gao N, et al. Overexpression of miR-506 inhibits growth of osteosarcoma through Snail2[J]. Am J Transl Res, 2015, 7(12): 2716-2723. |
| [19] |
Goossens S, Vandamme N, Van Vlierberghe P, et al. EMT transcription factors in cancer development re-evaluated:Beyond EMT and MET[J]. Biochim Biophys Acta Rev Cancer, 2017, 1868(2): 584-591. DOI:10.1016/j.bbcan.2017.06.006 |
| [20] |
McManus MM, Weiss KR, Hughes DP. Understanding the role of Notch in osteosarcoma[J]. Adv Exp Med Biol, 2014, 804: 67-92. |
| [21] |
Saad S, Stanners SR, Yong R, et al. Notch mediated epithelial to mesenchymal transformation is associated with increased expression of the Snail transcription factor[J]. Int J Biochem Cell Biol, 2010, 42(7): 1115-1122. DOI:10.1016/j.biocel.2010.03.016 |
| [22] |
Fang S, Yu L, Mei H, et al. Cisplatin promotes mesenchymallike characteristics in osteosarcoma through Snail[J]. Oncol Lett, 2016, 12(6): 5007-5014. DOI:10.3892/ol.2016.5342 |
 2020, Vol. 47
2020, Vol. 47


