文章信息
- 表浅型食管癌经内镜黏膜下剥离术导致非治愈性切除的危险因素及长期生存分析
- Risk Factors of Non-curative Resection in Superficial Esophageal Cancer After Endoscopic Submucosal Dissection and Long-term Survival Analysis
- 肿瘤防治研究, 2020, 47(4): 278-282
- Cancer Research on Prevention and Treatment, 2020, 47(4): 278-282
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.0691
- 收稿日期: 2019-05-27
- 修回日期: 2019-12-16
2. 210009 南京,江苏省省级机关医院消化科;
3. 210029 南京,江苏省人民医院消化科
2. Department of Gastroenterology, Provincial Government Hospital of Jiangsu Province, Nanjing 210009, China;
3. Department of Gastroenterology, Jiangsu Provincial People's Hospital, Nanjing 210029, China
食管癌(esophageal cancer, EC)是全球发病率位列第八,死亡率第六位的癌症。我国是食管癌的高发国家[1]。食管癌主要分为两种类型:食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)和食管腺癌(esophageal adenocarcinoma, EA),我国以ESCC为主[1]。表浅型食管癌(superficial esophageal cancer, SEC)指的是局限于黏膜层和黏膜下层、无论有无淋巴结转移的食管癌[2]。由于早期缺乏特异性症状,食管癌在确诊时已属于晚期,确诊后的EC患者总体5年生存率仅15%~25%[3]。因此,为了改善食管癌患者的预后和生存,早期诊断、早期治疗是食管癌的主要防控措施。Oyama等从2000年开始将内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)引入早期食管癌的治疗[4]。经过多年的发展,ESD治疗SEC已日趋成熟。它是一种微创治疗,在有适应证的患者中具有很好的疗效,可以获得比开放手术更好的安全性和术后生活质量[5]。然而,ESD治疗也存在缺陷。绝大多数ESD是治愈性切除,但也有部分患者术后为非治愈性切除。因此,了解导致ESD非治愈性切除的危险因素,有助于今后为SEC患者选择较理想的治疗方法。本研究对导致非治愈性切除的SEC患者行危险因素分析,并评估非治愈性切除之后接受不同治疗患者的预后。
1 资料与方法 1.1 一般资料回顾性收集2010年6月—2017年4月在江苏省人民医院行食管ESD治疗、术后病理证实为SEC的207例患者(214处病变部位)的临床资料及相关检查结果,其中7例患者有2处病变部位。生存期为手术日至死亡日期或随访终点,随访截至2018年10月。其中男146例,女61例;年龄(62.65±7.36)岁。所有病例治疗前均行超声内镜(endoscopic ultrasound, EUS)检查,确认病变位于黏膜层,最深不超过黏膜下层。所有病例均经胸腹部CT检查初步排除局部和全身淋巴结转移。
纳入标准:(1)绝对适应证:病变局限于上皮层或黏膜固有层(M1、M2);(2)相对适应证:排除淋巴结转移情况下,病变局限于黏膜肌层或黏膜下浅层(M3、SM1)[2];(3)姑息性治疗:病变浸润深度超过SM1、心肺功能差的高龄患者以及拒绝手术者,ESD术后辅以放疗者。
排除标准:(1)有淋巴管、血管浸润和转移的患者;(2)有严重心肺功能疾病者;(3)有全身麻醉及内镜操作禁忌证者。
服用抗凝剂的患者,治疗前1周需停用。术前检查血尿粪三大常规、生化、凝血功能、输血前八项(乙肝五项加HIV、HCV及梅毒)等,指标均未见明显异常。治疗前禁食8~10 h。治疗前告知手术风险,签署知情同意书。由经验丰富的内镜医师行ESD治疗。
1.2 治疗方法 1.2.1 手术方法患者采用全身麻醉,予碘染,显示病灶边界。病灶周边氩气标记,基底部注射0.9%氯化钠溶液+靛胭脂+肾上腺素,病灶抬举征良好或欠佳。钩刀切开病灶边缘,绝缘头电切(insulated tip, IT)刀逐步分离病灶,完整或分块切除病灶。
1.2.2 评价标准整块切除指的是完整大块切除。完全切除指的是在整块切除的基础上,水平切缘及基底切缘均为阴性。治愈性切除标准:(1)整块切除;(2)水平切缘及基底切缘均为阴性;(3)黏膜下浸润深度不超过200 μm;(4)无脉管浸润;(5)组织学类型为高、中分化。不能满足以上条件者纳为非治愈性切除[2]。
1.2.3 术后随访治疗后第3、6、12月复查胃镜,以后每年复查胃镜,必要时进行活检。对于非治愈性切除患者,常规进行瘢痕活检。如发现复发或残留病灶,予以再次行ESD或放化疗或外科开放性手术治疗。
1.3 统计学方法所有数据采用SPSS25.0软件进行统计学分析,在具有独立性的组间比较连续变量样本采用t检验;分类变量使用χ2检验或Fisher精确检验。构建多变量逻辑回归模型,以确定非治愈性切除的危险因子。使用Kaplan-Meier法行长期生存分析。P < 0.05为差异有统计学意义。
2 结果 2.1 ESD治疗后的结果及并发症全组患者平均手术时间(81.06±46.53)min。整块切除率89.25%(191/214),完整切除率80.84%(173/214),非治愈性切除率29.91%(64/214),切除标本最大长径110 mm。出血发生率为1.9%(4/214),穿孔发生率为3%(7/214),所有不良事件均保守处理后得到有效控制。
2.2 非治愈性切除的短期结局及危险因素分析 2.2.1 ESD后患者治疗情况64处病变部位(63例患者)经ESD导致非治愈性切除,其中25例接受食管癌根治术,12例接受放化疗,其余26例患者(27处病变部位)未追加其他额外治疗,定期复查。
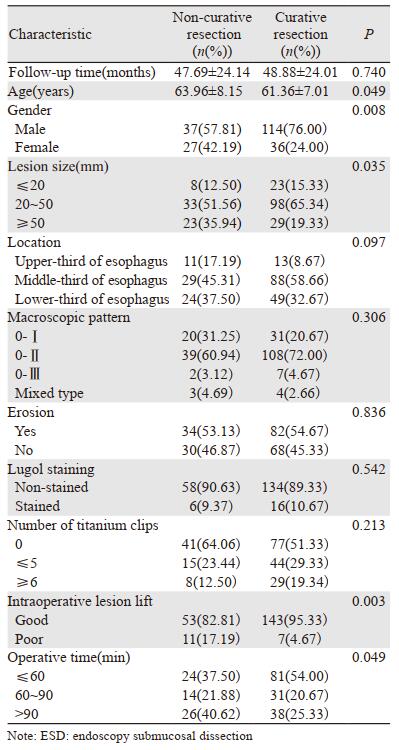
2.2.2 导致非治愈性切除的危险因素214处表浅型食管癌病变部位临床特征及导致ESD非治愈性切除危险的单因素分析结果见表 1。单因素分析结果显示:年龄较大、女性、肿瘤尺寸较大、术时病灶抬举欠佳和手术时间较长与导致非治愈性切除相关(P < 0.05)。多因素分析结果显示:女性(P=0.016)、肿瘤长径≥50 mm(P=0.009)和术时病灶抬举欠佳(P=0.019)是导致非治愈性切除的危险因素,见表 2。
|

|
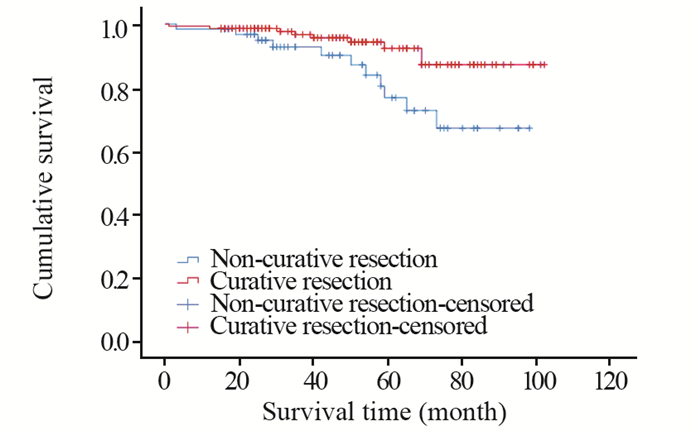
207例SEC患者经ESD治疗后最短随访时间为15月,最长随访时间达102月,中位随访48月。与治愈性切除组相比,非治愈性切除组患者的生存期显著缩短(χ2=5.966, P=0.015),见图 1。
|
| 图 1 治愈性和非治愈性切除患者总体生存分析 Figure 1 Overall survival of SEC patients with curative and non-curative resection |
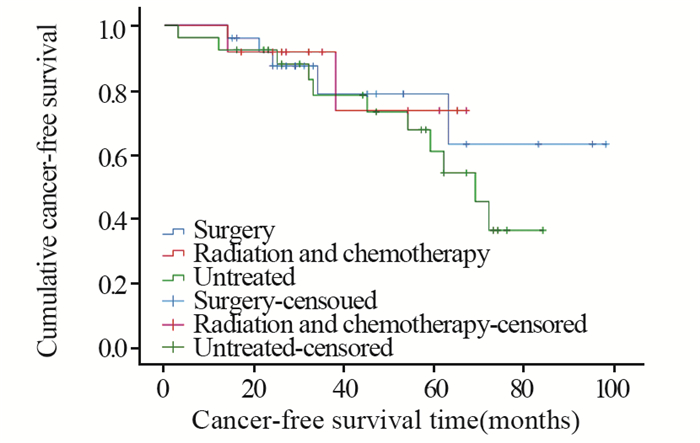
26例未追加其他治疗的患者与25例追加食管癌根治术组和12例放化疗组的患者比较,长期无癌生存期差异无统计学意义(χ2=1.006, P=0.605),见图 2。
|
| 图 2 非治愈性切除患者追加食管癌根治术、放化疗和及未追加其他治疗的无癌生存分析 Figure 2 Cancer-free survival of SEC patients with non-curative resection in three groups |
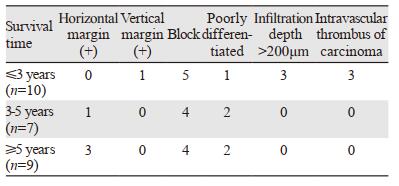
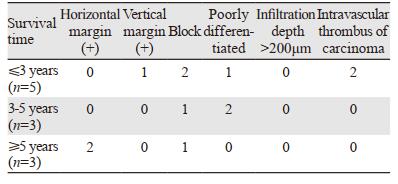
26例未追加其他治疗的非治愈性切除患者,随访期间共有11例复发,结果见表 3,部分病例包含多个非治愈性切除因素。
|
11例复发的患者中,均无浸润深度 > 200 μm的患者,见表 4。
|
随访期间,共有22例患者死亡,死亡率10.63%(22/207)。其中2例胰腺癌死亡、1例胆管癌死亡、1例胃癌死亡、3例自然死亡、15例食管癌复发出现多处淋巴结转移后死亡。共32例复发,复发率15.46%(32/207)。
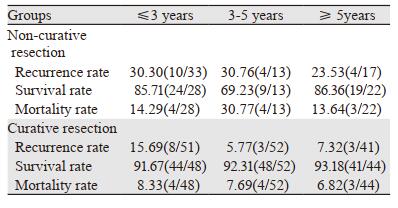
非治愈性切除组中,11例死亡,其中9例因食管癌复发死亡,1例胰腺癌死亡,1例自然,死亡率17.46%(11/63)。非治愈性切除组中有18例复发,复发率28.57%(18/63)。207例患者的生存率、死亡率、复发率见表 5。
|
207位SEC患者中,非治愈性切除组复发率28.57%(18/63),治愈性切除组复发率9.72%(14/144),两组复发率差异有统计学意义(P=0.00),说明非治愈性切除组的复发率高于治愈性切除组。207位SEC的患者中,非治愈性切除组死亡率17.46%(11/63),治愈性切除组死亡率7.64%(11/144),两组死亡率差异有统计学意义(P=0.04),说明非治愈性切除组的死亡率高于治愈性切除组。进一步按梯度划分为≥5年、3~5年、≤3年,只有3~5年组的非治愈性切除和治愈性切除组的复发率差异有统计学意义(P=0.028),其余时间梯度的复发率、死亡率差异均无统计意义(均P > 0.05)。
3 讨论随着新型内镜技术的应用和普及,食管病变的检出率逐渐增加[6]。尽管开放性手术可以根治SEC,但并发症的发生率高。随着内镜治疗技术的日趋成熟,在无淋巴结转移的情况下,ESD可以有效的切除局限于黏膜下浅层以上的食管病变组织,避免开放性手术后的并发症及创伤。目前ESD已发展成为SEC的重要治疗方式[7]。
本研究发现,单因素分析中,年龄较大、女性、肿瘤尺寸较大、术时病灶抬举欠佳和手术时间较长与非治愈性切除相关。多因素分析表明,女性、肿瘤长径≥50 mm和术时病灶抬举欠佳是非治愈性切除的独立危险因素。年龄与非治愈性切除的关联可能是由选择偏倚引起的[8],因为年龄较大的患者手术风险较高,更倾向于选择内镜下治疗。本研究中男女发病比例2.43:1,与之前研究相似[9],Libânio等研究表明,男性与治疗失败相关[8],与本研究结果相反。未来仍需扩大样本量来证明性别是否与非治愈性切除相关。本研究结果显示的肿瘤大小与非治愈性切除有关,可能是尺寸较大的病变组织,增加了剥离的难度。有研究表明,非治愈性切除的可能性随着肿瘤大小的增加而增加[10]。本研究发现术时病灶抬举欠佳也可能导致非治愈性切除,这可能由于肿瘤基底部与周围黏膜层粘连,致使病灶不易剥离。本研究认为较长的手术时间可能是非治愈性切除的风险因素,这可能因为较长的手术时间通常提示病变更为严重,手术切除更加困难。分析造成非治愈性切除的危险因素有助于患者选择较理想的治疗方法。
分析26例未追加其他治疗的非治愈性切除的患者资料发现,存活超过3年的患者均无基底切缘阳性、浸润黏膜下层深度均未超过200 μm以及均未出现脉管内癌栓等。这26例患者中11例复发,分析复发患者资料,发现超过3年无癌生存的患者均无基底切缘阳性以及脉管内癌栓等。这也提示基底切缘阳性以及脉管内癌栓为非治愈性切除相对危险的因素,这类患者3年内易复发。
未追加其他治疗的非治愈性切除的11例复发患者均未见浸润黏膜下层深度超过200 μm,既往研究表明,浸润深度超过200 μm具有较高的淋巴结转移发生率,建议追加治疗[2, 11]。而本研究发现,若患者只存在术后浸润黏膜下层深度超过200 μm、分块切除这两项非治愈性切除因素的患者,都有较长的无癌生存期,提示这类患者可考虑定期复查方式来提高患者的生活质量,不一定需要追加治疗。
本研究有16例患者病灶浸润黏膜下层超过200 μm,这些患者ESD术后有5例接受放化疗,8例行食管癌根治术,3例未处理。经过中位随访25.5月,均无复发。Maes等研究也同样发现,通过内窥镜切除术可以安全地治疗具有黏膜下浸润和低转移风险的肿瘤[12]。欧洲指南表明,对于没有淋巴或血管侵犯的高度或中度分化的黏膜内癌,内镜下切除是有效的。对于浸润深度 > 200 μm的肿瘤,可根据患者一般情况再决定进一步治疗(放化疗和或手术)[11]。
Min等研究证实SEC患者经ESD后可获得与开放性食管癌切除术疗效相当的长期预后。ESD应被视为无法行外科手术患者的一线治疗手段[13]。Zhang等发现接受ESD与开放性食管癌切除术治疗的T1a或T1b ESCC患者的总生存期、癌症复发及转移差异无统计学意义[14]。Lee等研究也表明,未经治愈性切除的SEC患者表现出良好的长期生存状况。以上结果显示,对于非治愈性切除的SEC患者,密切随访可能也是一种选择[15]。本文也同样发现,尽管非治愈性切除的患者长期生存率明显小于治愈性切除的患者,但在非治愈性切除组中,ESD术后未追加其他治疗患者与追加开放性手术或者放疗患者的生存率差异无统计学意义。定期随访而无需额外治疗可能被认为是经ESD治疗后非治愈性切除的SEC老年患者的另一种选择[16]。
本研究也存在一些限制。首先,患者术后未集中管理,复查医院水平级别不同,最后统计结果稍有差异。其次,样本量较少,今后也会逐步扩大样本量,相继完善。
综上,本文随访时间相对较长,对ESD的远期疗效具有一定参考意义。此外,长期随访表明,在不严格符合ESD治疗适应证的患者中,定期复查内镜是可行的。总之,ESD是SEC患者有效和安全的治疗方法。对于一般身体条件差的非治愈性切除患者,个体化患者管理和定期内镜检查亦不失为一个可能的选择。
作者贡献
陈梦雪:数据收集、统计,文章撰写
桑楠:病理诊断
葛献:数据收集
陈嘉希、黄倩:数据统计
李学良:数据校对及文章修改
| [1] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [2] |
国家卫生健康委员会. 食管癌诊疗规范(2018年版)[J]. 肿瘤综合治疗电子杂志, 2019, 5(2): 50-86. [National Health Commission. Esophageal cancer diagnosis and treatment standard (2018 edition)[J]. Zhong Liu Zong He Zhi Liao Dian Zi Za Zhi, 2019, 5(2): 50-86.] |
| [3] |
Ohashi S, Miyamoto S, Kikuchi O, et al. Recent Advances From Basic and Clinical Studies of Esophageal Squamous Cell Carcinoma[J]. Gastroenterology, 2015, 149(7): 1700-1715. DOI:10.1053/j.gastro.2015.08.054 |
| [4] |
Oyama T, Tomori A, Hotta K, et al. Endoscopic Submucosal Dissection of Early Esophageal Cancer[J]. Clin Gastroenterology Hepatology, 2005, 3(7): S67-S70. DOI:10.1016/S1542-3565(05)00291-0 |
| [5] |
Alsop BR, Sharma P. Esophageal Cancer[J]. Gastroenterol Clin North Am, 2016, 45(3): 399-412. DOI:10.1016/j.gtc.2016.04.001 |
| [6] |
Choi JH, Kim ES, Lee YJ, et al. Comparison of quality of life and worry of cancer recurrence between endoscopic and surgical treatment for early gastric cancer[J]. Gastrointest Endosc, 2015, 82(2): 299-307. |
| [7] |
Barret M, Prat F. Diagnosis and treatment of superficial esophageal cancer[J]. Ann Gastroenterol, 2018, 31(3): 256-265. |
| [8] |
Libanio D, Pimentel-Nunes P, Afonso LP, et al. Long-Term Outcomes of Gastric Endoscopic Submucosal Dissection: Focus on Metachronous and Non-Curative Resection Management[J]. GE Port J Gastroenterol, 2017, 24(1): 31-39. |
| [9] |
Zhang HZ, Jin GF, Shen HB. Epidemiologic differences in esophageal cancer between asian and western populations[J]. Chin J Cancer, 2012, 31(6): 281-286. DOI:10.5732/cjc.011.10390 |
| [10] |
Toyokawa T, Inaba T, Omote S, et al. Risk Factors for Non-Curative Resection of Early Gastric Neoplasms with Endoscopic Submucosal Dissection: Analysis of 1, 123 Lesions[J]. Exp Ther Med, 2015, 9(4): 1209-1214. DOI:10.3892/etm.2015.2265 |
| [11] |
Pimentel-Nunes P, Dinis-Ribeiro M, Ponchon T, et al. Endoscopic submucosal dissection: European Society of Gastrointestinal Endoscopy(ESGE) Guideline[J]. Endoscopy, 2015, 47(9): 829-854. DOI:10.1055/s-0034-1392882 |
| [12] |
Maes S, Haidry R, Bisschops R. Can the depth of invasion of early esophageal cancer be predicted based on endoscopic appearances?[J]. Minerva Chir, 2018, 73(4): 385-393. |
| [13] |
Min YW, Lee H, Song BG, et al. Comparison of endoscopic submucosal dissection and surgery for superficial esophageal squamous cell carcinoma: a propensity score-matched analysis[J]. Gastrointest Endosc, 2018, 88(4): 624-633. DOI:10.1016/j.gie.2018.04.2360 |
| [14] |
Zhang Y, Ding H, Chen T, et al. Outcomes of Endoscopic Submucosal Dissection vs. Esophagectomy for T1 Esophageal Squamous Cell Carcinoma in a Real-world Cohort[J]. Clin Gastroenterol Hepatol, 2019, 17(1): 73-81. |
| [15] |
Lee JW, Cho CJ, Kim DH, et al. Long-Term Survival and Tumor Recurrence in Patients with Superficial Esophageal Cancer after Complete Non-Curative Endoscopic Resection: A Single-Center Case Series[J]. Clin Endosc, 2018, 51(5): 470-477. DOI:10.5946/ce.2018.025 |
| [16] |
Qi ZP, Chen T, Li B, et al. Endoscopic submucosal dissection for early esophageal cancer in elderly patients with relative indications for endoscopic treatment[J]. Endoscopy, 2018, 50(9): 839-845. DOI:10.1055/a-0577-2560 |
 2020, Vol. 47
2020, Vol. 47


