文章信息
- 经内镜黏膜下剥离术治疗直肠神经内分泌肿瘤的疗效及安全性
- Safety and Efficacy of Endoscopic Submucosal Dissection for Rectal Neuroendocrine Tumor
- 肿瘤防治研究, 2020, 47(3): 181-184
- Cancer Research on Prevention and Treatment, 2020, 47(3): 181-184
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.0689
- 收稿日期: 2019-05-27
- 修回日期: 2019-09-02
2. 210029 南京,江苏省人民医院消化科
2. Department of Gastroenterology, Jiangsu Provincial People's Hospital, Nanjing 210029, China
神经内分泌肿瘤(neuroendocrine tumor, NET)是一组起源于全身的肽能神经元和神经内分泌细胞的罕见肿瘤,具有复杂的临床表现,胃肠胰神经内分泌肿瘤(gastro-entero-pancreatic neuroendocrine tumor, GEP-NET)临床较为常见[1]。随着诊疗技术的发展和人们健康意识的提高,GEP-NET的检出率在近十年中不断提高[2]。在亚洲直肠神经内分泌肿瘤(rectal neuroendocrine tumor, RNET)发病率占GEP-NET的37.4%。直肠是胃肠道神经内分泌肿瘤(gastrointestinal neuroendocrine tumor, GI-NET)的好发部位。
内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)是一种内镜下的微创治疗,在治疗早期消化道癌及癌前病变中比外科手术具有更好的安全性和术后生活质量[3]。本研究拟对ESD术治疗RNET的效果及预后进行回顾性评价。
1 资料与方法 1.1 一般资料收集2011年1月—2017年12月因直肠黏膜下肿瘤在江苏省人民医院行直肠ESD治疗、治疗后免疫组织化学证实为RNET的80例患者为研究对象;回顾性分析患者临床资料(91处病变)及检查结果。其中男48例,女32例,平均年龄52.65±11.59岁。仅1处病变患者72例,多处病变患者8例,肿瘤直径2~20 mm。
所有病灶均完整切除。所有病例治疗前均行超声内镜(endoscopic ultrasound, EUS)检查确认病变位置,超声内镜显示3例病变局灶浸润至固有肌层,其余均位于黏膜下层以内,即T1期占96.7%,T2期占3.3%。均经全腹部CT检查排除淋巴结转移。
1.2 临床症状80例患者中,57例表现为非特异性临床症状,部分患者有多发症状,表现为大便次数增多(5/57)、大便不成形(15/57)、腹痛(23/57)、腹胀(5/57)、腹泻(8/57)、肛门坠胀(7/57),少数患者有纳差(1例)、血便(3例)等症状;首发症状从出现到确诊的中位时间为4月(2天~20年不等)。余23例为体检时发现。
1.3 治疗方法患者均采用静脉麻醉,病灶周边氩气标记,基底部抬举后,dual刀切开病灶边缘,逐步分离,完整切除病灶。标本四周固定,测量大小后送病理检测。本研究根据经验将肿瘤组织距切缘 < 100 μm纳为切缘可疑阳性。
1.4 诊断及治疗标准根据世界卫生组织(World Health Organization, WHO)2010年分级及2018年美国国家综合癌症网(NCCN)NET指南,G1级核分裂相数 < 2个/10高倍视野和(或)Ki-67≤2%。G2级核分裂相数高至(2~20个)/10高倍视野和(或)Ki-67为3%~20%。G3级核分裂相数 > 20个/10高倍视野和(或)Ki-67 > 20%。当两者不一致时,取高者[4-5]。根据2016年中国GEP-NET专家共识,推荐直径 < 10 mm的G1、G2级RNET T1期采用内镜下切除,T2期采用局部完整切除。直径10~20 mm的G1、G2级RNET T1期患者采用经肛切除,T2期及以上患者及存在区域淋巴结转移患者采用直肠前切除术(anterior resection, AR)或者全直肠系膜切除术(total mesorectal excision, TME)[6]。
1.5 随访方法通过电话咨询方式,对患者的生存状态、复发及死亡情况进行随访。生存时间为病理确诊至死亡时间或末次随访时间。随访截止至2018年12月。
1.6 统计学方法采用SPSS22.0软件进行统计学分析,具有独立性的组间使用方差分析比较连续变量,分类变量运用χ2检验或连续校正χ2检验。构建多变量逻辑回归模型,以确定切缘可疑阳性及阳性的危险因子。P < 0.05为差异具有统计学意义。
2 结果 2.1 近期疗效 2.1.1 并发症术中部分患者少量出血,经处理停止。未发生术中严重出血、术后出血、穿孔、狭窄甚至死亡等并发症。
2.1.2 病理分级91处病变,G1级占80.22%(73/91),G2级占19.78%(18/91),无G3级病变。
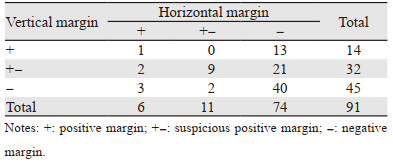
2.1.3 切缘情况切缘阳性19例,切缘可疑阳性32例,40处基底切缘及侧切缘均为阴性,见表 1。
有症状的患者术后3天~2月症状均有不同程度缓解。
2.2.2 复发及死亡情况中位随访时间34(12~94)月。2例患者分别因垂直切缘阳性、垂直切缘可疑阳性ESD术后行经肛门内镜微创手术(transanal endoscopic microsurgery, TEM),术后定期复查,未复发。
随访期间,1例患者因肺癌死亡,1例自然死亡,死亡率2.20%(2/91)。3例患者(4处病变)复发,其中1例患者2处复发,复发率4.40%(4/91)。复发的时间分别为术后13、26、30月。4处病变中,2处术后病理证实为垂直切缘阳性、水平切缘阴性,2处为水平、垂直切缘均可疑阳性。3例患者均再次行直肠ESD治疗。复发的3例患者中,2例男性,1例女性。有2例患者本身为多处病变,其中1例2处病变,1例4处病变。3例复发患者随访至今,均无再次复发。
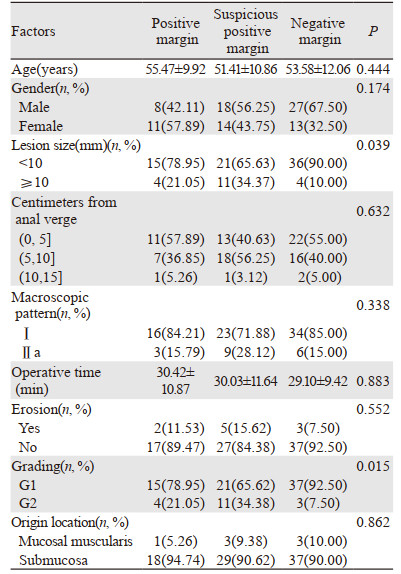
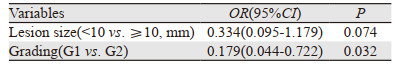
2.3 安全性本研究切缘可疑阳性及阳性率达56.04%(51/91)。根据切缘情况分为切缘阳性(19/91)、切缘可疑阳性(32/91)、切缘阴性(40/91)三组,分析临床病理因素与切缘情况的关系,见表 2。单因素分析结果显示,肿瘤≥10 mm、肿瘤处于G2级与切缘可疑阳性及阳性相关(P < 0.05)。多因素分析中,肿瘤处于G2级为切缘可疑阳性及阳性的独立危险因素,见表 3。
|
|
以往认为RNET是少见病,其生化、肿瘤指标等均无特异性,影像学检查也无法很好地与其他疾病鉴别。RNET患者无明显家庭聚集倾向,无特异性临床表现,多数患者为体检时无意发现[7]。近年来,内镜技术革新,使得该疾病得到越来越多的诊断和治疗,其主要治疗方法为ESD及TEM。由于该疾病大多起源于黏膜下层,术前往往无法诊断,最终依赖术后病理及免疫组织化学才能明确诊断。本研究中也仅有1例患者术前证实为RNET。如果术前想要获得明确的病理诊断结果,需要深挖活检。但是,有研究表明,深挖活检后的病变,因局部形成纤维化而影响治疗时的完整切除,因此建议对于考虑行内镜下切除的病变,尽量少咬检[8]。另一方面,因其直径大多数不超过10 mm,易造成漏诊。
本研究中发现切缘阳性和可疑阳性组中各有2处病变复发,切缘阴性组中无病变复发。Jeon等的研究中,10例切缘阳性未接受额外治疗的患者在22.4±16.7月的随访期间均未显示局部复发或转移[9]。本研究也有47例切缘阳性及紧邻阳性的无额外治疗患者随访期间均未复发或转移。这可能归因于在手术期间发生的电灼效应。
本研究发现肿瘤直径≥10 mm、肿瘤处于G2级与切缘可疑阳性或阳性相关。尺寸较大的病变增加了剥离的难度,可能导致剥离时有残留。本文18处病变处于G2级,其中7处肿瘤直径≥10 mm。73处病变处于G1级,其中12处直径≥10 mm,G2级中肿瘤直径≥10 mm的病变数量与G1级差异具有统计学意义(P=0.036),说明处于G2级的肿瘤较G1级更易导致肿瘤直径变大。肿瘤分级和肿瘤大小这两者是否有因果关系,还有待继续扩大样本量进行探讨。因RNET均处于较好的临床分级,本研究复发的病例少,2例男性,1例女性。未凸显出男女预后优势。有研究显示女性患者的预后优于男性患者,性别可能是影响患者预后的独立危险因素[10],这可能与女性性激素对免疫系统的作用有一定关系。
Untch等发现,肿瘤分级和肿瘤大小是重要的预后变量。对于大多数分化良好/低度分化、肿瘤长径 < 20 mm的NET患者,预计长期存活[11]。本研究纳入的RNET病例均处于G1、G2级,无G3级。相较于其他部位的神经内分泌肿瘤,RNET的恶性程度稍低[12]。随访期间,3例患者复发,复发的4处病变均处于T1期,其中3处病变直径小于10 mm,1处直径等于10 mm。复发的时间分别为13、26、30月,尽管存在切缘阳性,因残留肿瘤组织较小,复发时间均超过1年。91处病变,71处病变符合2016年中国GEP-NET专家共识推荐的治疗方案,20处病变超出ESD推荐的治疗范围。20处病变中,3处病变处于T2期,其中2处直径≥10 mm。T1期中有17处病变直径≥10 mm;采用ESD治疗后经过15~91月随访,患者均未复发。ESD方法治疗RNET,大部分安全有效,但存在残留可能,由于肿瘤多数位于黏膜下层,部分与固有肌层紧贴,导致手术时为避免伤及固有肌层而产生切缘残留,须引起注意。考虑到本文中标本切缘阳性率达20.88%,可能与未严格掌握适应证及ESD早期手术技术不成熟有关。
本研究证实,ESD在直径小于20 mm的无淋巴结转移的T1期直肠G1级和G2级的患者中具有良好疗效,与Nakamura等的研究相似[13]。尽管透射电子显微镜显示出比ESD和内镜下黏膜切除术更高的疗效,但对于RNET,内镜治疗似乎是TEM的可替代方案[9]。本研究发现,单发的患者占90%(72/80),多发的占10%(8/80),复发的3例患者中,有2例为多发病变(P=0.04),多发病变者更易复发。这也提示,多发的患者术后复发的风险高,行ESD治疗时应扩大切除范围。
总之,ESD在治疗直径小于20 mm的G1级和G2级的RNET患者中具有良好疗效。对于ESD术后显示切缘阳性及可疑阳性的RNET患者,密切随访暂不实施其他治疗似乎是一个可行方案。
作者贡献
陈梦雪:数据收集、统计及文章撰写
葛献:数据收集
周诛妍:病理诊断
陈嘉希、黄倩:数据统计
李学良:数据校对及文章修改
| [1] |
Fang C, Wang W, Zhang Y, et al. Clinicopathologic characteristics and prognosis of gastroenteropancreatic neuroendocrine neoplasms: a multicenter study in South China[J]. Chin J Cancer, 2017, 36(1): 51. |
| [2] |
Cives M, Strosberg J. An update on gastroenteropancreatic neuroendocrine tumors[J]. Oncology (Williston Park), 2014, 28(9): 749-756. |
| [3] |
Friedel D, Stavropoulos SN. Introduction of endoscopic submucosal dissection in the West[J]. World J Gastrointest Endosc, 2018, 10(10): 225-238. DOI:10.4253/wjge.v10.i10.225 |
| [4] |
Nagtegaal ID, Odze RD. The 2019 WHO classification of tumours of the digestive system[J]. Histopathology, 2019. |
| [5] |
Shah MH, Goldner WS, HAlfdanarson TR, et al. NCCN Guidelines Insights: Neuroendocrine and Adrenal Tumors, Version 2.2018[J]. J Natl Compr Canc Netw, 2018, 16(6): 693-702. DOI:10.6004/jnccn.2018.0056 |
| [6] |
中国临床肿瘤学会神经内分泌肿瘤专家委员会. 中国胃肠胰神经内分泌肿瘤专家共识(2016年版)[J]. 临床肿瘤学杂志, 2016, 21(10): 927-946. [Committee of Neuroendocrine Oncology, Chinese Society of Clinical Oncology. Consensus of Chinese gastrointestinal and pancreatic neuroendocrine oncologists (2016 edition)[J]. Lin Chuang Zhong Liu Xue Za Zhi, 2016, 21(10): 927-946.] |
| [7] |
Ko SH, Baeg MK, Ko SY, et al. Clinical characteristics, risk factors and outcomes of asymptomatic rectal neuroendocrine tumors[J]. Surg Endosc, 2017, 31(10): 3864-3871. DOI:10.1007/s00464-016-5413-9 |
| [8] |
Lee SP, Sung IK, Kim JH, et al. The Effect of Preceding Biopsy on Complete Endoscopic Resection in Rectal Carcinoid Tumor[J]. J Korean Med Sci, 2014, 29(4): 512-518. DOI:10.3346/jkms.2014.29.4.512 |
| [9] |
Jeon JH, Cheung DY, Lee SJ, et al. Endoscopic resection yields reliable outcomes for small rectal neuroendocrine tumors[J]. Dig Endosc, 2014, 26(4): 556-563. DOI:10.1111/den.12232 |
| [10] |
寇玉, 高业博, 马杰, 等. 胃神经内分泌癌42例预后分析[J]. 中华胃肠外科杂志, 2013, 16(6): 570-573. [Kou Y, Gao YB, Ma J, et al. Prognostic analysis of 42 patients with gastric neuroendocrine carcinoma[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2013, 16(6): 570-573. DOI:10.3760/cma.j.issn.1671-0274.2013.06.018] |
| [11] |
Untch BR, Bonner KP, Roggin KK, et al. Pathologic Grade and Tumor Size are Associated with Recurrence-Free Survival in Patients with Duodenal Neuroendocrine Tumors[J]. J Gastrointest Surg, 2014, 18(3): 457-462. DOI:10.1007/s11605-014-2456-x |
| [12] |
邱旭东, 刘猛, 刘青, 等. 903例神经内分泌肿瘤发病部位与病理特征分析[J]. 中华胃肠外科杂志, 2017, 20(9): 993-996. [Qiu XD, Liu M, Liu Q, et al. Analysis of primary site and pathology on 903 patients with neuroendocrine neoplasms[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2017, 20(9): 993-996. DOI:10.3760/cma.j.issn.1671-0274.2017.09.008] |
| [13] |
Nakamura K, Osada M, Goto A, et al. Short- and long-term outcomes of endoscopic resection of rectal neuroendocrine tumours: analyses according to the WHO 2010 classification[J]. Scand J Gastroenterology, 2016, 51(4): 448-455. DOI:10.3109/00365521.2015.1107752 |
 2020, Vol. 47
2020, Vol. 47