文章信息
- CEA、PAK5联合循环肿瘤细胞对Ⅲ B期胃癌患者术后复发转移的早期精准预测
- Early and Accurate Prediction of Postoperative Recurrence and Metastasis in Stage Ⅲ B Gastric Cancer Patients by Combination of CEA, PAK5 and Circulating Tumor Cells
- 肿瘤防治研究, 2020, 47(9): 672-675
- Cancer Research on Prevention and Treatment, 2020, 47(9): 672-675
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.0494
- 收稿日期: 2019-12-19
- 修回日期: 2020-06-07
2. 443002 宜昌,三峡大学科技学院临床医学系
2. Department of Clinical Medicine, College of Science and Technology of China Three Gorges University, Yichang 443002, China
Competing interests: The authors declare that they have no competing interests.
中国胃癌患者平均死亡率高达20/10万,占恶性肿瘤的第一位[1]。究其原因可能与原发肿瘤致病基因突变、药物的敏感度反应、耐药机制多样性等异质性相关[2],为此,探求早期预测生物学进展标志物成为研究热点。本研究应用ELISA法、多重RNA/DNA原位分析等方法,对ⅢB期胃癌术后患者辅助化疗后随访期内进行动态检测外周血癌胚抗原(carcino-embryonic antigen, CEA)、p21活化激酶5(p21-activated kinase 5, PAK5)、循环肿瘤细胞(circulating tumor cells, CTC)以及同时期CT检查,以期达到早期生物学预测复发转移的目的。
1 资料与方法 1.1 临床资料收集2015年1月—2017年12月河北医科大学第四医院肿瘤内科胃癌根治术后完全缓解的患者150例。入组条件:术前晨空腹肘部外周静脉血CEA值超过正常值的5倍、术后病理诊断为胃腺癌ⅢB期(T4bN1-2M0、T4aN2M0、T3N3M0)(按照AJCC第七版)。治疗方案以奥沙利铂或紫杉醇为主的方案辅助化疗6周期,其中多西他赛为主方案72例,奥沙利铂为主方案78例。后续定期随访,每3月进行CEA检测和影像学评估。
分组标准:随访期内血浆CEA检测正常患者设为对照组,共50例。随访期内第一次CEA升高超过正常值5倍患者为实验组,共100例,同时按CEA水平增高不同情况,再分为两组:CEA进行性增高组(实验A组)和无规律增高组(实验B组)。
入组患者基线情况:入组时患者整体分期、化疗周期数、血浆癌胚抗原CEA、PAK5、CTC和影像学检查肿瘤病情评估差异均无统计学意义(P > 0.05)。所有患者按照住院或门诊评估的方式进行随访,随访截至2017年12月31日。
1.2 检测方法和频次应用ELISA、多重RNA/DNA原位分析等方法,分别采集两组患者不同时刻的晨空腹肘部外周静脉血,检测血浆中癌胚抗原CEA、PAK5和CTC的水平。CEA由我院生化室完成检测。PAK5和CTC均由广州益善公司协助完成检测。
动态检测时间点的选择:T0:术前癌胚抗原超过正常值5倍; T1:术后辅助化疗6周期后; T2:CEA首次超过正常值5倍,本研究将其确定为生物学进展时间; T3:首次CT证实进展和(或)无影像学进展的患者随访截止时间。实验组动态检测三次(T1、T2、T3),对照组动态检测两次(T1、T3)。
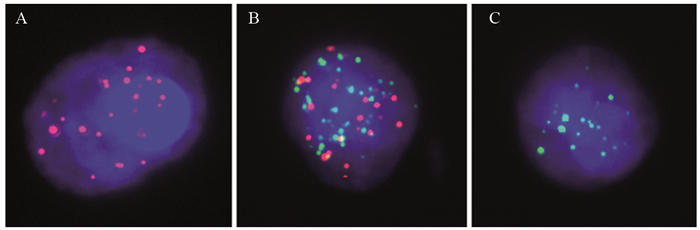
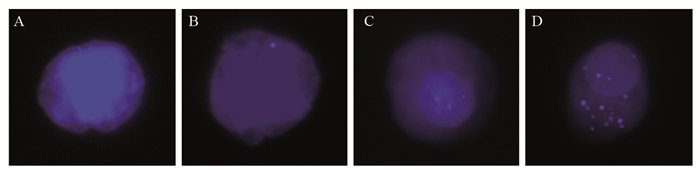
1.3 各指标阳性判定标准癌胚抗原CEA阳性标准:CEA的正常值为 < 5 ng/ml。超过正常值的5倍为生物学进展阳性。CTC阳性标准:CTC检测分为上皮型、混合型、间质型,其中上皮型认定为良性,混合型认定为生物学进展,间质型认定为恶性复发转移,即为影像学进展,见图 1。PAK5检测标准:根据表达强度分为无表达、低表达、中表达、高表达。本研究判定标准:无表达和低表达为阴性,中表达和高表达为阳性,其中中表达/总细胞数的比率判定为生物学进展; 高表达/总细胞数的比率判定为影像进展,见图 2。
|
| A: Epithelial type; B: Mixed type; C: Interstitial type. 图 1 循环血肿瘤细胞CTC分型表达 Figure 1 CTC typing of circulating tumor cells in blood |
|
| A: No expression; B: Low expression; C: Medium expression; D: High expression. 图 2 多重RNA原位分析PAK5表达情况 Figure 2 In situ analysis of PAK5 expression by multiple RNA |
截至随访时间,对照组50例患者中均未见CEA增高,影像学未见明确病灶。实验两组中,按照生物学进展时间(T2):实验A组为3~24月,中位时间13月。实验B组为4~32月,中位时间22月。按照影像进展时间(T3):实验A组39例(78%)进展,出现时间为5~8月,中位时间为6.2月。实验B组12例(24%)进展,出现时间为4~15月,中位时间为10.6月。实验A组较B组更能提示复发转移。
2.2 CTC变化情况与胃癌术后疾病进展关系T2时,实验A组混合型和间质型之和/总单细胞数比值大于30%,提示生物学进展; 间质型细胞数≥1在两实验组之间有差异,但无统计学意义。T3时,实验A组混合型和间质型之和/总单细胞数比值大于50%,提示影像学进展。间质型细胞数≥1在两实验组之间有差异,但病例数尚少,未行统计学分析,见表 1。

|
T2时,无表达、低表达、中表达数据没有偏移,两组间高表达数据有偏移; T3无表达、低表达数据没有偏移,两组间中、高表达数据有偏移。因为病例数尚少,未行统计学分析,见表 2。

|
对明确影像学进展的51例患者的CTC细胞进行PAK5检测,中表达数值为13.6%~83%,高表达数值为37.8%~100%。
2.4 实验组CEA、PAK5、CTC三者阳性表达一致性由于实验B组仅有12例(24%)患者影像学提示进展,病例数尚少,未行统计学分析。对实验A组39例影像学提示进展患者进行比较,T2时,CTC和PAK5、CEA判定的一致性为82%。T3时,和PAK5、CEA判定的一致性为94%。
3 讨论中国ⅢB期胃癌术后5年生存率仅为15%~35%,究其原因在于部分患者术后即发生早期转移。临床上常常将癌胚抗原(CEA)作为ⅢB期胃癌术后随访复发转移的生物标志物[3]。本研究CEA进行性增高组(实验A组)有78%的患者肿瘤影像证实进展,有利于早期诊断复发转移。而CEA无规律增高组(实验B组)仅有24%提示肿瘤影像学进展,单指标检测存在假阳性,与文献报道CEA具有非特异性、易受炎性反应性疾病的干扰相一致。因此,提高预测指标的准确性成为临床研究的趋势,才能更好地避免给患者带来精神压力和过度治疗的可能性。
有研究报道CTC的间质型细胞具有恶性行为[4-6],但对于混合型的恶性度报道不一,实体瘤的异质性导致的胃癌CTC的阳性标准不同于乳腺癌,尚无明确共识。本研究数据表明间质型细胞数大于1可早期预测影像学进展。但对于混合型的恶性度报道不一,本研究考虑混合型细胞具有恶性变的趋势,疾病进展演变成间质型,其演变过程是从肿瘤生物学进展发展到影像学进展的过程,可以很好地预测影像学进展。本研究应用统计学分析(混合型+间质型)/总单细胞数比值大于30%可早期预测生物学进展可能; (混合型+间质型)/总单细胞数比值大于50%可早期预测影像学进展可能。由于混合型细胞中有良性细胞成分和恶性成分,因本研究例数尚少,目前尚无更好的方法区分生物学进展,待扩大样本数后进一步进行验证。
为了更好的推算混合型向间质型细胞的演化时间,本研究增加检测了一种上游癌基因P21活化激酶亚型PAK5,有学者对恶性肿瘤组织标本检测数据表明PAK5过度表达或突变激活,参与了部分恶性实体瘤发生、发展[7-14],但在胃癌中的研究较少[15-16]。本研究数据表明PAK5参与了胃癌细胞生长增殖的调节。PAK5的无/中表达表明肿瘤细胞进入复制分裂期的增殖数目较少、恶性度低; PAK5的中/高表达表明肿瘤细胞进入增殖期数目多、恶性度高。本研究明确影像学进展的51例患者生物学进展时刻时PAK5的中表达数值为13.6%~83%,高表达数值为37.8%~100%。结果显示PAK5的中/高表达可预测生物学进展,实验数据范围较广,我们考虑PAK5检测的敏感度和特异性可能会导致假阳性/假阴性。但因为例数较少,未行统计学分析。
本研究数据单因素检测存在误差,对癌培抗原进行性增高组影像学进展确定进展的39例患者进行CEA、PAK5、CTC三者联合检测的一致性上,预测生物学进展的一致率为82%;预测肿瘤影像学进展的一致率为94%,联合检测可提高预测率,降低检测误差。
因此,联合动态检测CEA、PAK5、CTC预测ⅢB期胃癌术后生物学进展,更早于影像进展诊断,可降低单一指标的假阳/阴性率,提高检出阳性率,防止漏诊、误诊的发生。
作者贡献
史健:论文设计、数据审核及论文撰写
袁梦:文献查询和数据录入
| [1] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. |
| [2] |
何琪杨. 肿瘤异质性与抗肿瘤靶向药物的耐药性[J]. 药学学报, 2016, 51(2): 197-201. [He QY. Tumor heterogeneity and drug resistance of targeted antitumor agents[J]. Yao Xue Xue Bao, 2016, 51(2): 197-201.] |
| [3] |
刘中娟, 张瑞丽, 刘娟娟, 等. 多种血清肿瘤标志物联合检测对胃癌辅助诊断的研究[J]. 标记免疫分析与临床, 2016, 23(1): 1-4. [Liu ZJ, Zhang RL, Liu JJ, et al. Combined detection of multiple tumor markers in assistance diagnosis of gastric cancer[J]. Biao Ji Mian Yi Fen Xi Yu Lin Chuang, 2016, 23(1): 1-4.] |
| [4] |
Yu M, Bardia A, Aceto N, et al. Cancer therapy. Ex vivo culture of circulating breast tumor cells for individualized testing of drug susceptibility[J]. Science, 2014, 345(6193): 216-220. DOI:10.1126/science.1253533 |
| [5] |
Yauch RL, Januario T, Eberhard DA, et al. Epithelial versus Mesenchymal Phenotype Determines In vitro Sensitivity and Predicts Clinical Activity of Erlotinib in Lung Cancer Patients[J]. Clin Cancer Res, 2005, 11(24 Pt 1): 8686-8698. |
| [6] |
Nel I, Baba HA, Ertle J, et al. Schlaak and Andreas-Claudius Hoffmann. Individual Profiling of Circulating Tumor Cell Composition and Therapeutic Outcome in Patients with Hepatocellular Carcinoma[J]. Transl Oncol, 2013, 6(4): 420-428. DOI:10.1593/tlo.13271 |
| [7] |
Ye DZ, Field J. PAK signaling in cancer[J]. Cell Logist, 2012, 2(2): 105-116. |
| [8] |
Coleman N, Kissil J. Recent advances in the development of p21-activated kinase inhibitors[J]. Cell Logist, 2012, 2(2): 132-135. DOI:10.4161/cl.21667 |
| [9] |
Gu J, Li K, Li M, et al. A role for p21-activated kinase 7 in the development of gastric cancer[J]. FEBS J, 2013, 280(1): 46-55. DOI:10.1111/febs.12048 |
| [10] |
Köhler T, Schill C, Deininger MW, et al. High Bad and Bax mRNA expression correlate with negative outcome in acute myeloid leukemia (AML)[J]. Leukemia, 2002, 16(1): 22-29. DOI:10.1038/sj.leu.2402340 |
| [11] |
Radu M, Semenova G, Kosoff R, et al. Pak signaling in the development and progression of cancer[J]. Nat Rev Cancer, 2014, 14(1): 13-25. DOI:10.1038/nrc3645 |
| [12] |
Giroux V, Iovanna J, Dagorn JC. Probing the human kinome for kinases involved in pancreatic cancer cell survival and gemcitabine resistance[J]. FASEB J, 2006, 20(12): 1982-1991. DOI:10.1096/fj.06-6239com |
| [13] |
Gong W, An Z, Wang Y, et al. P21-activated kinase 5 is overexpressed during colorectal cancer progression and regulates colorectal carcinoma cell adhesion and migration[J]. Int J Cancer, 2009, 125(3): 548-555. |
| [14] |
Wang X, Gong W, Qing H, et al. p21-activated kinase 5 inhibits camptothecin-induced apoptosis in colorectal carcinoma cells[J]. Tumor Biol, 2010, 31(6): 575-582. DOI:10.1007/s13277-010-0071-3 |
| [15] |
Liu Y, Ling Y, Qi Q, et al. Prognostic value of circulating tumor cells in advanced gastric cancer patients receiving chemotherapy[J]. Mol Clin Oncol, 2017, 6(2): 235-242. |
| [16] |
高德海. 胃癌循环肿瘤细胞的研究进展[J]. 国际外科学杂志, 2018, 45(4): 272-279. [Gao DH. Research progress of gastric cancer circulating tumor cells[J]. Guo Ji Wai Ke Xue Za Zhi, 2018, 45(4): 272-279.] |
 2020, Vol. 47
2020, Vol. 47
