文章信息
- 上调LncRNA RP11-173C1.1对甲状腺癌B-CPAP细胞增殖和侵袭能力的影响
- Effect of LncRNA RP11-173C1.1 Overexpression on Proliferation and Invasion of Thyroid Carcinoma B-CPAP Cells
- 肿瘤防治研究, 2020, 47(3): 170-174
- Cancer Research on Prevention and Treatment, 2020, 47(3): 170-174
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.0457
- 收稿日期: 2019-04-08
- 修回日期: 2019-12-25
2. 442000 十堰,湖北医药学院附属人民医院甲状腺乳腺外科
2. Department of Thyroid and Breast Surgery, Renmin Hospital, Hubei University of Medicine, Shiyan 442000, China
我国是甲状腺癌高发国家之一,其发生率逐年上升[1]。虽然甲状腺癌的治疗手段近年来得到了较快发展,但其具体发病机制至今仍不明确。甲状腺癌的发生发展是多分子通路参与的复杂过程,寻找甲状腺的分子靶点是近年来研究热点[2]。长链非编码RNA(long-chain non-coding RNA, lncRNA)最初被认为是基因组的“转录噪音”,无生物学功能,然而近年来大量研究证实lncRNA在人类包括肿瘤在内的多种疾病的发生发展中发挥重要作用[3]。lncRNA数量众多,只有少数lncRNA在甲状腺癌中被研究报道[4]。RP11-173C1.1是一种新确定的lncRNA。本研究通过分析RP11-173C1.1在甲状腺癌组织和细胞株中的表达量,探究RP11-173C1.1在甲状腺癌发生发展中的作用,并通过上调甲状腺癌细胞中RP11-173C1.1的表达,探讨上调RP11-173C1.1干扰甲状腺癌细胞增殖和侵袭的作用机制,为靶向lncRNA治疗甲状腺癌提供一定参考依据。
1 资料与方法 1.1 临床资料收集2016年6月—2018年7月湖北医药学院附属人民医院肿瘤中心42例甲状腺癌手术切除的癌组织和相应的癌旁组织标本,于液氮中冷冻保存。男7例、女35例, 年龄20~62岁,平均(38.28±5.37)岁。甲状腺乳头状癌37例,甲状腺滤泡癌5例。临床分期:Ⅰ期20例、Ⅱ期14例、Ⅲ期8例。手术标本均经该院病理科专家确认。所有患者术前均未行放化疗,本研究经本院伦理委员会同意,患者均签署知情同意书。
1.2 细胞与主要试剂胎牛血清、DMEM/F12培养基和RPMI 1640培养基购自美国Gibco公司。Lipofectamine 3000购自美国Invitrogen公司。引物(RP11-173C1.1、GAPDH、miR-376c-3p、U6和OPCML)购自上海生物工程股份有限公司。一抗OPCML、α-Tubulin、CDK2、Cyclin E2、MMP-2和MMP-9及二抗均购自美国CST公司。甲状腺乳头状癌细胞(B-CPAP、SW579)、滤泡状癌细胞(TPC-1、MDA-T32、TT)和正常甲状腺滤泡上皮细胞Nthy-ori3-1均购自中国科学院上海生命科学研究院细胞资源中心。CCK-8试剂盒购自美国Sigma公司。阴性对照质粒及RP11-173C1.1表达载体购自上海吉凯基因化学技术有限公司。Transwell小室购自美国Corning公司。qRT-PCR相关试剂盒购自日本TaKaRa公司。
1.3 RNA提取和实时荧光定量PCR42例组织标本和细胞株均采用TRIzol氯仿提取法提取总RNA。根据TaKaRa试剂盒说明书配制反应体系进行qRT-PCR检测,RP11-173C1.1上游引物为:5’-GGTTAGTGCAGGCCTCTCG-3’,下游引物为:5’-GGAGCGCCTTAGTGGAAGTT-3’;GAPDH上游引物为:5’-ACAACTTTGGTATCGTGGAAGG-3’,下游引物为:5’-GCCATCACGCCACAGTTTC-3’;OPCML上游引物为:5’-ATCTCTGACATCAAGCGAGACC-3’,下游引物为:5’-CTTCTGACCGACTGAAACACC-3’;miR-376c-3p上游引物为:5’-GGGGAACATAGAGGAAATT-3’,下游引物为:5’-CAGTGCGTGTCGTGGAGT-3’;U6上游引物为:5’-CTCGCTTCGGCAGCACA-3’,下游引物为:5’-AACGCTTCACGAATTTGCGT-3’。反应体系为:20 µl。扩增参数:94℃预变性10 min,60℃ 25 s,72℃ 25 s,40个循环。利用2-ΔΔCt方法计算,以U6为内参检测miR-376c-3p的表达,以GAPDH为内参检测RP11-173C1.1和OPCML mRNA的表达。
1.4 细胞培养及质粒转染B-CPAP、Nthy-ori3-1和MDA-T32细胞采用含10%胎牛血清的RPMI 1640培养基培养,TPC-1、SW579和TT细胞采用含10%胎牛血清的DMEM/F12培养基培养,细胞均在培养箱(37℃、5%CO2)中培养。根据LipofectamineTM 3000说明书进行转染,分别转染携带无意义序列的阴性对照质粒(对照组)和RP11-173C1.1表达质粒(实验组),以对数生长期的B-CPAP细胞为转染对象。常规培养转染细胞24 h后,更换新鲜RPMI 1640培养基。
1.5 CCK-8检测转染后B-CPAP细胞增殖胰酶消化、收集对照组和实验组对数生长期的B-CPAP细胞,制成细胞悬液,以2×103个/孔(200 µl)细胞接种于96孔板,隔天换液。检测时,每孔加入15 μl CCK-8溶液,37℃、5%CO2培养箱中培养4 h,使用酶标仪测定在450 nm波长处每组细胞的吸光度(OD)值,每天检测1次,连续监测5天。
1.6 Transwell侵袭实验检测转染后B-CPAP细胞侵袭采用Matrigel胶(15 μg/ml)均匀铺在Transwell上室,待其凝固后,胰酶消化、收集对照组和实验组对数生长期的B-CPAP细胞,无血清RPMI 1640培养基制成细胞悬液,以4×104个/室(每室200 µl)细胞接种于Transwell上室。Transwell下室加600 µl含10%胎牛血清的RPMI 1640培养基。培养24 h后弃去培养基,1 ml 4%多聚甲醛固定20 min,1 ml 0.1%结晶紫染色20 min。流水轻轻洗去染液,棉签擦去未穿过孔膜的B-CPAP细胞。倒置显微镜下,取多个视野计数穿膜细胞数,取均值后统计分析。
1.7 生物信息学技术预测RP11-173C1.1的作用机制利用LncBase Predicted v.2软件预测RP11-173C1.1互补结合的miRNA,利用TargetScan Release 3.1软件预测miRNA互补结合的基因。
1.8 Western blot实验检测OPCML蛋白的表达水平胰酶消化、收集、裂解对照组和实验组对数生长期的B-CPAP细胞,提取总蛋白后制备蛋白样品50 µg。制备十二烷基硫酸钠-聚丙烯酰胺凝胶,蛋白上样恒压(100 V)电泳,聚偏氟乙烯膜恒流(200 mA)转膜。5%脱脂牛奶封闭80 min,一抗:OPCML(1:1 000稀释)、CDK2(1:1 000稀释)、Cyclin E2(1:2 000稀释)、MMP-2(1:500)、MMP-9(1:500)及α-Tubulin(1:500),4℃孵育过夜。采用二抗在室温下孵育80 min,ECL显影液显影,凝胶成像系统拍照。
1.9 统计学方法使用SPSS18.0统计软件进行统计学分析,定量资料采用均数±标准差(x±s)表示,以独立样本t检验进行分析,P < 0.05为差异有统计学意义。
2 结果 2.1 RP11-173C1.1在甲状腺癌组织和细胞株中低表达qRT-PCR结果显示,RP11-173C1.1在42例甲状腺癌组织中的表达量与癌旁组织相比明显下降(1.20±0.32 vs. 4.82±0.84, P=0.007);与正常甲状腺滤泡上皮细胞株Nthy-ori3-1细胞相比,RP11-173C1.1在甲状腺癌细胞株SW579细胞(P < 0.001)、TT细胞(P < 0.001)、B-CPAP细胞(P < 0.001)、TPC-1细胞(P=0.001)、MDA-T32细胞(P=0.002)中的表达量明显下降,其中在B-CPAP细胞中下降的最显著,见图 1。
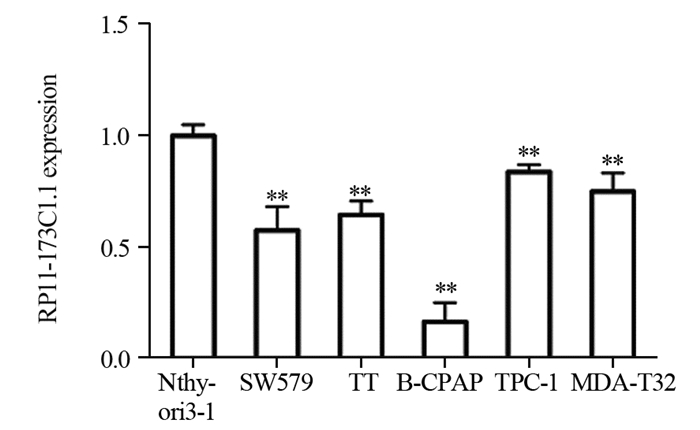
|
| **: P < 0.01, compared with normal thyroid follicular epithelial cell line Nthy-ori3-1. 图 1 RP11-173C1.1在甲状腺癌细胞株和正常甲状腺滤泡上皮细胞中的表达水平 Figure 1 Expression levels of RP11-173C1.1 in thyroid cancer cell lines and normal thyroid follicular epithelial cells |
转染RP11-173C1.1表达质粒后48 h,qRT-PCR结果显示,实验组B-CPAP细胞中RP11-173C1.1表达量与对照组相比明显增加(10.39±0.80 vs. 1.00±0.03, P < 0.001)。
2.3 上调RP11-173C1.1抑制B-CPAP细胞的增殖CCK-8法检测结果显示,在第2、3、4、5天,上调RP11-173C1.1的实验组B-CPAP细胞OD值明显低于对照组(P=0.026、P=0.002、P < 0.001、P=0.003),表明上调RP11-173C1.1可抑制B-CPAP细胞的增殖能力,见图 2。
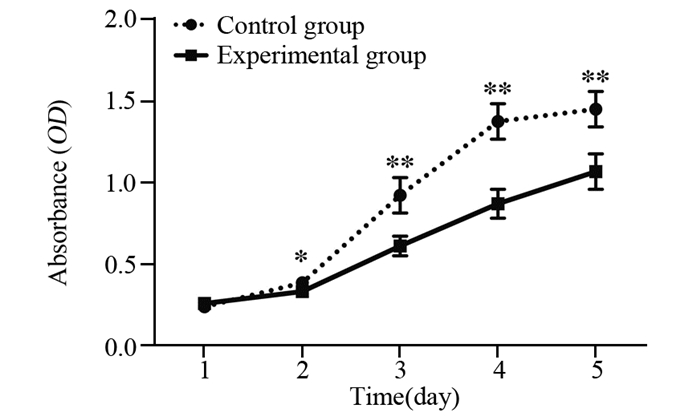
|
| *: P < 0.05, **: P < 0.01, compared with Control group. 图 2 上调RP11-173C1.1对B-CPAP细胞增殖能力的影响 Figure 2 Effect of RP11-173C1.1 overexpression on proliferation of B-CPAP cells |
Transwell侵袭实验结果显示,实验组B-CPAP细胞穿过底膜的细胞数明显少于对照组(43.06±13.41 vs. 106.60±14.08个,P=0.017),表明上调RP11-173C1.1可抑制B-CPAP细胞的侵袭能力,见图 3。

|
| 图 3 上调RP11-173C1.1对B-CPAP细胞侵袭能力的影响 Figure 3 Effect of RP11-173C1.1 overexpression on invasion of B-CPAP cells |
采用LncBase Predicted v.2软件预测显示,RP11-173C1.1可互补结合miR-376c-3p;TargetScan Release 3.1软件预测显示,miR-376c-3p可互补结合OPCML mRNA,见图 4。
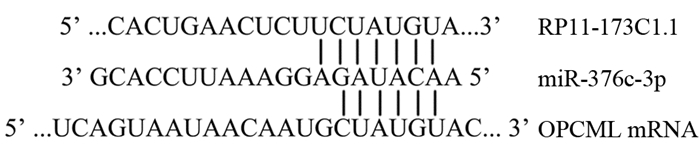
|
| 图 4 生物信息学技术预测RP11-173C1.1下游分子机制 Figure 4 RP11-173C1.1 complementarity predicted by bioinformatics software |
qRT-PCR结果显示,实验组B-CPAP细胞中miR-376c-3p mRNA表达水平明显低于对照组(0.20±0.02 vs. 1.00±0.03, P < 0.001),OPCML mRNA表达水平明显高于对照组(1.00±0.02 vs. 5.90±0.74, P < 0.001),表明上调RP11-173C1.1可下调miR-376c-3p mRNA的表达,上调OPCML mRNA的表达。
2.7 上调RP11-173C1.1对OPCML蛋白表达的影响Western blot结果显示,上调RP11-173C1.1后,OPCML蛋白表达水平升高,B-CPAP细胞周期调控蛋白如CDK2、Cyclin E2的表达水平降低,B-CPAP细胞侵袭调控蛋白如MMP-2和MMP-9蛋白表达降低,表明上调RP11-173C1.1后B-CPAP细胞增殖和侵袭能力降低,见图 5。
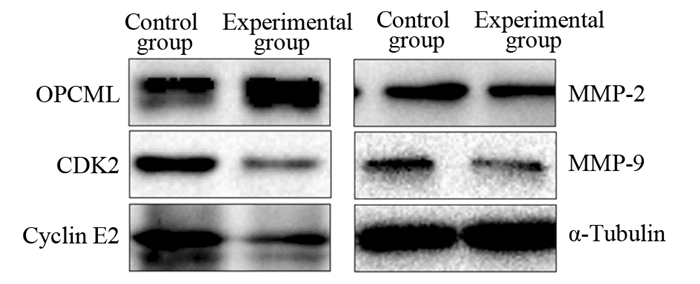
|
| 图 5 上调RP11-173C1.1对B-CPAP细胞OPCML相关蛋白表达的影响 Figure 5 Effect of RP11-173C1.1 overexpression on expression of OPCML-related proteins in B-CPAP cells |
lncRNA是一类转录本长度 > 200个核苷酸的长链非编码RNA,在人体多种生命过程中具有重要调节作用[5]。肿瘤的发生发展是多步骤、多因素作用的复杂过程,lncRNA参与调控染色质重塑、基因转录等多种生物学功能,在肿瘤细胞的增殖、分化、凋亡、转移等过程发挥抑癌基因或癌基因的作用[6]。CCND2-AS1、SPRY4-IT、HOTTIP、SNHG12等lncRNA与甲状腺癌的发生发展密切相关,促进甲状腺癌的增殖和侵袭,发挥癌基因的作用[7-9]。H19、GAS8-AS1、LINC01186等lncRNA是甲状腺癌重要的分子标志物,通过抑制癌基因的表达、干扰甲状腺癌的增殖和侵袭、发挥抑癌基因的作用[10-12]。然而,RP11-173C1.1是一种新发现的lncRNA,其在甲状腺癌中的表达和作用机制尚不明确。
本研究qRT-PCR结果表明,在甲状腺癌组织中RP11-173C1.1的表达水平较癌旁组织明显下调,提示RP11-173C1.1的低表达可能参与甲状腺癌的发生、发展。本研究通过CCK-8法和Transwell侵袭实验表明,上调RP11-173C1.1可干扰甲状腺癌细胞增殖和侵袭能力。“海绵效应”是lncRNA调节下游基因表达的重要作用机制,通过互补结合对应的微小RNA(miRNA),抑制miRNA的表达[13]。miRNA可在转录后抑制靶基因mRNA的翻译或者直接导致其降解。lncRNA抑制miRNA表达后,可干扰miRNA对靶基因miRNA的抑制作用,从而促进靶基因mRNA的表达[14]。生物信息学方法结果显示,RP11-173C1.1可互补结合miR-376c-3p,miR-376c-3p可互补结合阿片类结合蛋白/细胞黏附样分子(opioid binding protein/cell adhesion molecule like, OPCML)。Wang等[15]研究发现,miR-376c-3p在肝癌组织和细胞株中表达明显升高,与肝癌的不良预后密切相关,miR-376c-3p可促进肝癌细胞的生长和转移,发挥致癌作用。本研究结果表明,过表达RP11-173C1.1可明显降低甲状腺癌细胞中miR-376c-3p的表达。OPCML基因位于人类染色体11q25区域,通过激活腺苷酸环化酶调节细胞间黏附和细胞生长的作用[16]。OPCML表达缺失与乳腺癌、卵巢癌、胃癌等多种肿瘤的发生发展密切相关,被鉴定为抑癌基因,具有抑制肿瘤生长和转移生长的作用[16-18]。本研究结果表明,RP11-173C1.1降低miR-376c-3p的表达后,OPCML基因的表达明显增加,表明RP11-173C1.1可能是通过靶向负调控miR-376c-3p,间接促进OPCML基因的表达,从而抑制甲状腺癌的进展。OPCML基因表达上调后,B-CPAP细胞周期调控蛋白,如CDK2、Cyclin E2的表达水平下调,B-CPAP细胞侵袭调控蛋白,如MMP-2和MMP-9蛋白表达下调,表明B-CPAP细胞增殖和侵袭能力降低。
综上所述,本研究证实RP11-173C1.1在甲状腺癌组织和甲状腺癌细胞株表达下调。在B-CPAP细胞中,RP11-173C1.1可能首先影响miR-376c-3p的表达, 随后上调OPCML的表达,发挥抑制甲状腺癌细胞增殖和侵袭的作用。RP11-173C1.1有望成为一种具有重要潜在价值的肿瘤分子靶标。
作者贡献
王群:课题设计及文章撰写
袁杰:标本收集及实验操作
黄军:实验数据统计及文章审核
梅虹:课题设计、文章撰写、标本收集及实验操作
| [1] |
Shen Y, Xia E, Bhandari A, et al. LncRNA PROX1-AS1 promotes proliferation, invasion, and migration in papillary thyroid carcinoma[J]. Biosci Rep, 2018, 38(5). pii: BSR20180862. https://www.researchgate.net/publication/326710107_LncRNA_PROX1-AS1_promotes_proliferation_invasion_and_migration_in_Papillary_thyroid_carcinoma/fulltext/5b602a18a6fdccf0b202a5d0/326710107_LncRNA_PROX1-AS1_promotes_proliferation_invasion_and_migration_in_P
|
| [2] |
Murugan AK, Munirajan AK, Alzahrani AS. Long noncoding RNAs: emerging players in thyroid cancer pathogenesis[J]. Endocr Relat Cancer, 2018, 25(2): R59-R82. DOI:10.1530/ERC-17-0188 |
| [3] |
Huang JK, Ma L, Song WH, et al. LncRNA-MALAT1 Promotes Angiogenesis of Thyroid Cancer by Modulating Tumor-Associated Macrophage FGF2 Protein Secretion[J]. J Cell Biochem, 2017, 118(12): 4821-4830. DOI:10.1002/jcb.26153 |
| [4] |
Zhang H, Cai Y, Zheng L, et al. LncRNA BISPR promotes the progression of thyroid papillary carcinoma by regulating miR-21-5p[J]. Int J Immunopathol Pharmacol, 2018, 32: 2058738418772652. |
| [5] |
Liu H, Li R, Guan L, et al. Knockdown of lncRNA UCA1 inhibits proliferation and invasion of papillary thyroid carcinoma through regulating miR-204/IGFBP5 axis[J]. Onco Targets Ther, 2018, 11: 7197-7204. DOI:10.2147/OTT.S175467 |
| [6] |
Lu HW, Liu XD. UCA1 promotes papillary thyroid carcinoma development by stimulating cell proliferation via Wnt pathway[J]. Eur Rev Med Pharmacol Sci, 2018, 22(17): 5576-5582. |
| [7] |
Yuan Q, Liu Y, Fan Y, et al. LncRNA HOTTIP promotes papillary thyroid carcinoma cell proliferation, invasion and migration by regulating miR-637[J]. Int J Biochem Cell Biol, 2018, 98: 1-9. DOI:10.1016/j.biocel.2018.02.013 |
| [8] |
Xia E, Bhandari A, Shen Y, et al. LncRNA CCND2-AS1 promotes proliferation, migration, and invasion in papillary thyroid carcinoma[J]. Biochem Biophys Res Commun, 2018, 496(2): 628-632. DOI:10.1016/j.bbrc.2018.01.102 |
| [9] |
Zhou H, Sun Z, Li S, et al. LncRNA SPRY4-IT was concerned with the poor prognosis and contributed to the progression of thyroid cancer[J]. Cancer Gene Ther, 2018, 25(1-2): 39-46. DOI:10.1038/s41417-017-0003-0 |
| [10] |
Wang N, Duan H, Zhang C, et al. The LINC01186 suppresses cell proliferation and invasion ability in papillary thyroid carcinoma[J]. Oncol Lett, 2018, 16(5): 5639-5644. |
| [11] |
Qin Y, Sun W, Zhang H, et al. LncRNA GAS8-AS1 inhibits cell proliferation through ATG5-mediated autophagy in papillary thyroid cancer[J]. Endocrine, 2018, 59(3): 555-564. DOI:10.1007/s12020-017-1520-1 |
| [12] |
Lan X, Sun W, Dong W, et al. Downregulation of long noncoding RNA H19 contributes to the proliferation and migration of papillary thyroid carcinoma[J]. Gene, 2018, 646: 98-105. DOI:10.1016/j.gene.2017.12.051 |
| [13] |
Wu DM, Wang S, Wen X, et al. LncRNA SNHG15 acts as a ceRNA to regulate YAP1-Hippo signaling pathway by sponging miR-200a-3p in papillary thyroid carcinoma[J]. Cell Death Dis, 2018, 9(10): 947. DOI:10.1038/s41419-018-0975-1 |
| [14] |
Yang T, Zhai H, Yan R, et al. lncRNA CCAT1 promotes cell proliferation, migration, and invasion by down-regulation of miR-143 in FTC-133 thyroid carcinoma cell line[J]. Braz J Med Biol Res, 2018, 51(6): e7046. DOI:10.1590/1414-431x20187046 |
| [15] |
Wang Y, Chang W, Chang W, et al. MicroRNA-376c-3p Facilitates Human Hepatocellular Carcinoma Progression via Repressing AT-Rich Interaction Domain 2[J]. J Cancer, 2018, 9(22): 4187-4196. DOI:10.7150/jca.27939 |
| [16] |
Zanini E, Louis LS, Antony J, et al. The Tumor-Suppressor Protein OPCML Potentiates Anti-EGFR- and Anti-HER2-Targeted Therapy in HER2-Positive Ovarian and Breast Cancer[J]. Mol Cancer Ther, 2017, 16(10): 2246-2256. DOI:10.1158/1535-7163.MCT-17-0081 |
| [17] |
Xing X, Cai W, Ma S, et al. Down-regulated expression of OPCML predicts an unfavorable prognosis and promotes disease progression in human gastric cancer[J]. BMC Cancer, 2017, 17(1): 268. DOI:10.1186/s12885-017-3203-y |
| [18] |
Zhou F, Tao G, Chen X, et al. Methylation of OPCML promoter in ovarian cancer tissues predicts poor patient survival[J]. Clin Chem Lab Med, 2014, 52(5): 735-742. |
 2020, Vol. 47
2020, Vol. 47


