文章信息
- 乳腺癌中组蛋白去甲基化酶JMJD3与上皮间质转化相关蛋白表达的相关性及临床意义
- Correlation of JMJD3 and Epithelial-mesenchymal Transition-related Protein Expression in Breast Cancer and Clinical Significance
- 肿瘤防治研究, 2020, 47(4): 268-272
- Cancer Research on Prevention and Treatment, 2020, 47(4): 268-272
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2020.19.0433
- 收稿日期: 2019-04-02
- 修回日期: 2019-08-09
2. 450000 郑州,郑州人民医院院士工作站
2. Academy of Sciences Expert Workstation, People's Hospital of Zhengzhou, Zhengzhou 450000, China
目前,乳腺癌严重威胁着女性的健康。在乳腺癌的转移机制中,上皮间质转化(epithelial-mesenchymal transition, EMT)是其中一个核心的生物学进程,与乳腺癌的侵袭和转移密切相关。JMJD3又称赖氨酸去甲基化酶6B(lysine demethylase 6B, KDM6B)作为一种Lys27位点三甲基化组蛋白H3(histone H3 methylated Lys27,H3K27me3)去甲基化酶[1],其异常表达与多种肿瘤的发生、发展密切相关[2-3]。JMJD3在肿瘤中是促癌基因还是抑癌基因研究报道尚不一致,有关JMJD3在乳腺癌中的作用,以及JMJD3与上皮间质转化的相关性尚未见类似报道。本研究收集120例乳腺浸润性导管癌组织标本,采用免疫组织化学法检测JMJD3和上皮间质转化相关蛋白E-cadherin、Vimentin和N-cadherin的表达,并分析其相关性及临床病理意义,以拓展和丰富人们对乳腺癌发病机制的认识。
1 资料与方法 1.1 病例资料收集郑州人民医院2014年1月—2015年12月间收治的120例乳腺原发浸润性导管癌及相应的癌旁病理活检标本和相关临床资料。患者术前均未接受放疗或化疗。按照2012年WHO乳腺癌组织病理分级分类法对其进行分组。所有标本均经10%的甲醛固定,石蜡包埋,并经郑州人民医院病理科确诊。
1.2 主要试剂JMJD3一抗兔抗人多克隆抗体购自英国Abcam公司,E-cadherin、Vimentin和N-cadherin一抗兔抗人单克隆抗体(即用型)、二抗及二氨基联苯胺(DAB)均为福州迈新公司产品。
1.3 免疫组织化学染色主要步骤如下:(1)石蜡组织切片、烤片、脱蜡并水化;(2)EDTA抗原修复;(3)兔抗人单克隆抗体一抗37℃孵育2 h;(4)二抗37℃孵育20~30 min;(5)DAB显色5~10 min;(6)脱水、透明和封片。用已知JMJD3、E-cadherin、Vimentin和N-cadherin阳性的乳腺癌组织和PBS分别代替一抗作为阳性和空白对照。
1.4 免疫组织化学结果判断JMJD3阳性信号呈棕褐色,表达于细胞核;E-cadherin和N-cadherin阳性信号为棕黄色,表达于细胞膜;Vimentin阳性信号为棕黄色,表达于细胞质。按样本中JMJD3、E-cadherin、Vimentin及N-cadherin阳性细胞占总细胞的比例分为4个等级[4]:< 5%为阴性、5%~ < 25%为弱阳性、25%~50%为中等阳性、≥50%为强阳性。其中阴性和弱阳性判断为低表达,中等阳性和强阳性判断为高表达,阳性表达率=(中等阳性+强阳性样本量)/总样本量,免疫组织化学的判读由两位高年资病理医师采用双盲法进行。
1.5 统计学方法采用SPSS17.0统计软件进行数据处理与统计分析,JMJD3、E-cadherin、Vimentin和N-cadherin阳性表达率和病理因素的相关性采用χ2检验,蛋白间的相关性采用Spearman相关分析,以P < 0.05为差异有统计学意义。
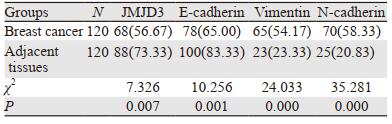
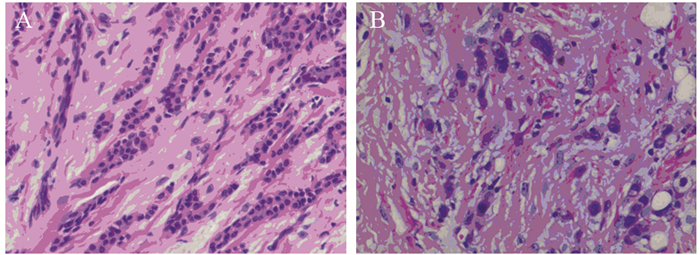
2 结果 2.1 乳腺浸润性导管癌中JMJD3、E-cadherin、Vimentin和N-cadherin的表达JMJD3主要定位于细胞核,在乳腺浸润性导管癌及癌旁组织中呈棕褐色,在导管癌中的阳性表达率明显低于癌旁组织,差异有统计学意义(χ2=7.326, P=0.007),见图 1、表 1。JMJD3表达较高者,组织学分化程度高,细胞黏附性强,极性较好,JMJD3表达较低者,组织学分化程度差,细胞黏附性下降,失去极性,细胞梭形更为明显,见图 2。

|
| A: adjacent tissues; B: breast cancer. 图 1 JMJD3、E-cadherin、Vimentin和N-cadherin在乳腺浸润性导管癌及癌旁组织中的表达(IHC ×200) Figure 1 Expression of JMJD3, E-cadherin, Vimentin and N-cadherin in breast cancer tissues and adjacent tissues (IHC ×200) |
|
|
| A: high expression of JMJD3; B: low expression of JMJD3. 图 2 乳腺癌JMJD3表达对细胞形态的影响(HE ×200) Figure 2 Effects of JMJD3 expression on morphology of breast cancer cells (HE ×200) |
E-cadherin在乳腺浸润性导管癌及癌旁组织中主要定位于细胞膜,为粗细相对均匀的棕褐色颗粒,乳腺浸润性导管癌中E-cadherin阳性表达率明显低于癌旁组织,差异有统计学意义(χ2=10.256, P=0.001)。Vimentin主要表达于上皮周围的间质细胞中,在癌及癌旁组织中主要定位于细胞质,为粗细不等的棕褐色颗粒,乳腺浸润性导管癌中Vimentin阳性表达率明显高于癌旁组织,差异有统计学意义(χ2=24.033, P=0.000)。N-cadherin在癌及癌旁组织中主要定位于细胞膜,为粗细相对均匀的棕褐色颗粒,乳腺浸润性导管癌中N-cadherin阳性表达率为明显高于癌旁组织,差异有统计学意义(χ2=35.281, P=0.000),见图 1、表 1。
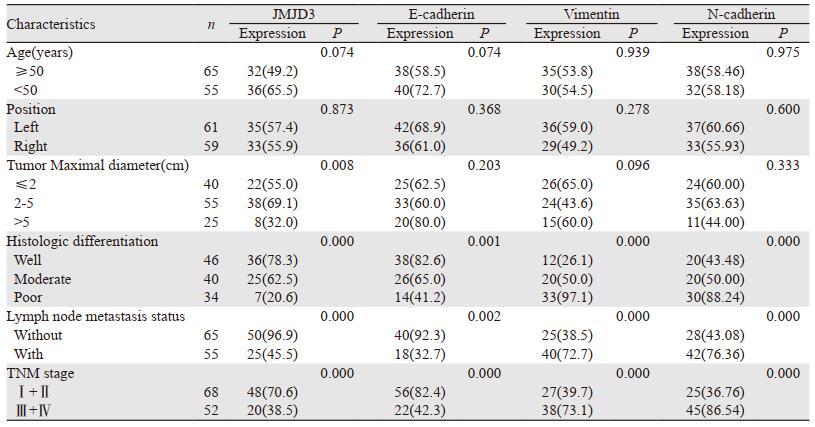
2.2 JMJD3、E-cadherin、Vimentin和N-cadherin与乳腺浸润性导管癌临床病理特征的关系在乳腺浸润性导管癌中,JMJD3与肿瘤直径(χ2=9.697, P=0.008)、组织学分级(χ2=27.313, P=0.000)、淋巴结转移(χ2=12.587, P=0.000)TNM分期有关(χ2=12.385, P=0.000),与乳腺癌患者年龄和肿瘤位置均无关(均P > 0.05)。E-cadherin在高分化、中分化和低分化乳腺癌中表达率依次降低,差异具有统计学意义(χ2=14.152, P=0.001);其在淋巴结有转移组中低于无淋巴结转移组,差异有统计学意义(χ2=9.903, P=0.002);其在TNM Ⅲ期、Ⅳ期组别低于Ⅰ期、Ⅱ期组别,差异具有统计学意义(χ2=20.771, P=0.000)。E-cadherin与乳腺癌患者年龄、肿瘤位置和肿瘤直径均无关(均P > 0.05)。Vimentin在高分化、中分化和低分化乳腺癌中表达率依次升高,差异具有统计学意义(χ2=28.410, P=0.000);其在淋巴结有转移组中高于无淋巴结转移组(χ2=14.090, P=0.000),TNMⅢ期、Ⅳ期组高于Ⅰ期、Ⅱ期组(χ2=13.218, P=0.000),与年龄、肿瘤位置和肿瘤直径均无关(均P > 0.05)。N-cadherin在高分化、中分化和低分化中表达率依次升高(χ2=28.410, P=0.000);其在淋巴结有转移组中高于无淋巴结转移组(χ2=17.678, P=0.000),在TNM Ⅲ期、Ⅳ期组高于Ⅰ期、Ⅱ期组(χ2=30.035, P=0.000)。N-cadherin与乳腺癌患者年龄、肿瘤位置及肿瘤直径均无关(均P > 0.05),见表 2。
|
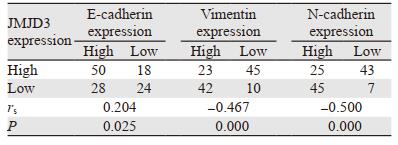
采用Spearman相关分析,结果显示JMJD3和E-cadherin表达呈正相关(r=0.204, P=0.025)。JMJD3和Vimentin表达呈负相关(r=-0.467, P=0.000)。JMJD3和N-cadherin表达呈负相关(r=-0.500, P=0.000),见表 3。
|
JMJD3编码基因位于人类第17号染色体上,其异常表达与肿瘤的发生发展有密切关系。Tokunaga等[5]对151例结肠癌患者的术后生存分析结果表明,JMJD3低表达者术后生存期普遍较短,且回归分析表明JMJD3的低表达是患者不良预后的独立危险因素之一。国内有研究发现JMJD3过表达对胃癌细胞的增殖具有抑制作用,对细胞凋亡具有促进作用[6]。胡贺芳等[7]研究发现JMJD3表达降低可能促进肺癌的发生发展。李彦伟等[8]发现胶质瘤细胞中JMJD3较瘤旁组织表达降低,其过表达可增强胶质瘤细胞迁移能力,该机制通过影响SNAIL基因调控区H3K27me3水平而调节胶质瘤侵袭过程[9]。
JMJD3是促癌基因还是抑癌基因研究报道尚不一致,本研究采用免疫组织化学方法发现JMJD3在乳腺浸润性导管癌组织表达率较癌旁组织低,其在组织学分化差、有淋巴结转移及较高TNM分期的组织中表达率减低,提示JMJD3在乳腺癌的浸润转移中扮演了抑癌基因的角色。此外本研究结果还显示JMJD3低表达与肿瘤直径相关,肿瘤直径的大小反映细胞增殖能力,我们推测JMJD3对乳腺癌细胞增殖具有抑制作用,这与以往其在胃癌研究报道观点一致[6]。
在乳腺癌的转移机制中,EMT是其中一个核心的生物学进程。EMT的过程中,上皮细胞标志性蛋白E-cadherin减少,而间质细胞标志性蛋白Vimentin和N-cadherin表达量上升[10-12]。E-cadherin主要分布于胚胎组织和成熟组织的上皮细胞中,除具有调节胚胎组织的发育、组织形成、参与细胞与细胞间信息传递交流等作用外,对促进细胞的黏附聚集、维持上皮形态结构完整性、极性和参与分化调节也至关重要。Vimentin主要表达于间叶组织和淋巴造血细胞,在上皮中几乎不表达,当细胞出现上皮间质转化时可有表达。N-cadherin表达于神经外胚层和中胚层来源的组织,正常上皮组织不表达或低表达。N-cadherin在上皮组织中的异位表达可以影响上皮细胞的形态和行为,诱导其向间质转化,即产生EMT。
本研究结果显示从乳腺癌旁组织到乳腺癌组织JMJD3和E-cadherin阳性率逐渐减少,而Vimentin和N-cadherin阳性率逐渐增高;同时它们均与乳腺癌分化程度、TNM分期和淋巴结转移相关,表明JMJD3和EMT相关蛋白共同参与乳腺癌的发生、发展,其可能机制是通过降低肿瘤细胞间的黏附力,使乳腺癌更容易发生浸润和转移。本研究中E-cadherin、Vimentin和N-cadherin的表达情况与以往文献报道的结果基本一致[13-14]。
通过查阅国内外文献,我们发现JMJD3表达对上皮间质转化的影响在胶质瘤细胞[15]、肝癌细胞[16-17]、肾癌细胞[18]和弥漫大B细胞淋巴瘤[19]已有研究报道,其在乳腺癌中尚未见研究报道。上述研究均表明JMJD3过表达能够促进上皮间质转化过程进而促进肿瘤的浸润转移。本研究相关分析结果发现JMJD3与E-cadherin表达呈正相关,与Vimentin和N-cadherin表达呈负相关,表明JMJD3低表达可能通过下调E-cadherin及上调Vimentin和N-cadherin的表达使乳腺癌上皮细胞获得间质细胞的特性,进而促进EMT的发生。提示JMJD3阳性率较低的乳腺癌患者更易发生淋巴结转移和较差的组织学分化,而组织学分化较差的乳腺癌细胞在形态学上细胞极性消失,细胞梭形明显,黏附性下降,从形态学上表明JMJD3可能通过上皮间质转化途径参与乳腺癌的发生发展。本研究从蛋白水平对乳腺癌中JMJD3、E-cadherin和Vimentin表达进行分析,尚缺少分子生物学调节实验,还需进一步深入研究。
综上所述,乳腺浸润性导管癌中组蛋白去甲基化酶JMJD3与E-cadherin呈正相关,与Vimentin和N-cadherin呈负相关,JMJD3可能通过调节乳腺癌细胞上皮间质转化,调控乳腺癌侵袭转移,其具体机制有待后续深入研究。
作者贡献
徐小艳:标本收集、论文撰写及免疫组织化学判读
王建君、冯智坤:免疫组织化学染色技术工作
门颖丽、王慧:数据统计
杨金花:课题指导及免疫组织化学判读
| [1] |
Sakaki H, Okada M, Kuramoto K, et al. GSKJ4, A Selective Jumonji H3K27 Demethylase Inhibitor, Effectively Targets Ovarian Cancer Stem Cells[J]. Anticancer Res, 2015, 35(12): 6607-6614. |
| [2] |
Daures M, Idrissou M, Judes G, et al. A new metabolic gene signature in prostate cancer regulated by JMJD3 and EZH2[J]. Oncotarget, 2018, 9(34): 23413-23425. DOI:10.18632/oncotarget.25182 |
| [3] |
胡姗, 韩聪, 胡建宏, 等. 组蛋白去甲基化酶JMJD3研究进展[J]. 生物技术通报, 2017, 33(9): 64-72. [Hu S, Han C, Hu JH, et al. Research progress on Histone Demethylase JMJD3[J]. Sheng Wu Ji Shu Tong Bao, 2017, 33(9): 64-72.] |
| [4] |
张连美, 仲纪祥, 孙苏安, 等. 乳腺癌中转录因子DLX4与EMT相关蛋白的表达及意义[J]. 临床与实验病理学杂志, 2016, 32(7): 731-734. [Zhang LM, Zhong JX, Sun SA, et al. Analysis of correlation and expression between DLX4 and EMT related protein in breast cancer[J]. Lin Chuang Yu Shi Yan Bing Li Xue Za Zhi, 2016, 32(7): 731-734.] |
| [5] |
Tokunaga R, Sakamoto Y, Nakagawa S, et al. The Prognostic Significance of Histone Lysine Demethylase JMJD3/KDM6B in Colorectal Cancer[J]. Ann Surg Oncol, 2016, 23(2): 678-685. DOI:10.1245/s10434-015-4879-3 |
| [6] |
彭晨, 覃刚, 吴莉莉, 等. 组蛋白去甲基化酶JMJD3对胃癌细胞增殖凋亡的影响[J]. 实用医学杂志, 2017, 33(4): 517-520. [Peng C, Qin G, Wu LL, et al. The expression of JMJD3 and its role for cell proliferation and apoptosis in Human gastric carcinoma[J]. Shi Yong Yi Xue Za Zhi, 2017, 33(4): 517-520. DOI:10.3969/j.issn.1006-5725.2017.04.004] |
| [7] |
胡贺芳, 时辉, 车国卫, 等. 肺癌组织中含十字形结构域蛋白3表达的意义[J]. 中国呼吸与危重监护杂志, 2011, 10(2): 168-170. [Hu HF, Shi H, Che WG, et al. The Expression of Jumonji Domain-Containing Protein 3 in Lung Cancer Tissue[J]. Zhongguo Hu Xi Yu Wei Zhong Jian Hu Za Zhi, 2011, 10(2): 168-170. DOI:10.3969/j.issn.1671-6205.2011.02.015] |
| [8] |
李彦伟, 王哲. 胶质瘤细胞组蛋白去甲基化酶JMJD3表达降低[J]. 细胞与分子免疫学杂志, 2014, 30(5): 525-526, 529. [Li YW, Wang Z. Histone Lysine Demethylase JMJD3 decreased in gloma cells[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi, 2014, 30(5): 525-526, 529.] |
| [9] |
Sui A, Xu Y, Li Y, et al. The pharmacological role of histone demethylase JMJD3 inhibitor GSK-J4 on glioma cells[J]. Oncotarget, 2017, 8(40): 68591-68598. DOI:10.18632/oncotarget.19793 |
| [10] |
Ye X, Brabletz T, Kang Y, et al. Upholding a role for EMT in breast cancer metastasis[J]. Nature, 2017, 547(7661): E1-E3. DOI:10.1038/nature22816 |
| [11] |
Qiu Y, Liu Y, Li WH, et al. P2Y2 receptor promotes the migration and invasion of breast cancer cells via EMT-related genes Snail and E-cadherin[J]. Oncol Rep, 2018, 39(1): 138-150. |
| [12] |
Grosse-Wilde A, Kuestner RE, Skelton SM, et al. Loss of inter-cellular cooperation by complete epithelial-mesenchymal transition supports favorable outcomes in basal breast cancer patients[J]. Oncotarget, 2018, 9(28): 20018-20033. DOI:10.18632/oncotarget.25034 |
| [13] |
桂安萍, 姚和瑞, 凌飞海. 三阴性乳腺癌细胞中上皮间质转化与EGFR单抗治疗效果的相关性[J]. 肿瘤防治研究, 2016, 43(4): 249-252. [Gui AP, Yao HR, Ling FH. Correlation Between Epithelial-mesenchymal Transition and Sensitivity to EGFR Targeted Monoclonal Antibody in Tripe Negative Breast Cancer Cells[J]. Zhong Liu Fang Zhi Yan Jiu, 2016, 43(4): 249-252. DOI:10.3971/j.issn.1000-8578.2016.04.002] |
| [14] |
霍莉莉, 李慧, 魏枫, 等. 乳腺癌中FoxP3表达与上皮间质转化的相关性及其意义[J]. 中国肿瘤临床, 2014, 41(3): 158-161. [Huo LL, Li H, Wei F, et al. Clinical significance of FoxP3 and the correlation of FoxP3 expression with epithelial-mesenchymal transition in breast cancer[J]. Zhongguo Zhong Liu Lin Chuang, 2014, 41(3): 158-161. DOI:10.3969/j.issn.1000-8179.20131533] |
| [15] |
邹爽, 徐忠伟, 张妍. 胶质瘤细胞U87中JMJD3表达对上皮细胞间质转化及细胞迁移的影响[J]. 武警后勤学院学报(医学版), 2017, 26(9): 737-741. [Zou S, Xu ZW, Zhang Y. Effect of JMJD3 expression on epithelial-mesenchymal transition and cell migration in glioma U87 cells[J]. Wu Jing Hou Qin Xue Yuan Xue Bao(Yi Xue Ban), 2017, 26(9): 737-741.] |
| [16] |
Tang B, Qi G, Tang F, et al. Aberrant JMJD3 expression upregulates Slug to promote migration, invasion and stem cell-like behaviors in hepatocellular carcinoma[J]. Cancer Res, 2016, 76(22): 6520-6532. DOI:10.1158/0008-5472.CAN-15-3029 |
| [17] |
陈青松, 万磊, 周壮, 等. GSK-J4通过抑制STAT3磷酸化对HepG2肝癌细胞凋亡和侵袭的影响[J]. 第三军医大学学报, 2018, 536(9): 7-13. [Chen QS, Wan L, Zhou Z, et al. JMJD3 inhititor GSK-J4 induces apoptosis and attenuates invasion in HepG2 cells by inhibiting STAT3 phosphorylation[J]. Di San Jun Yi Da Xue Xue Bao, 2018, 536(9): 7-13.] |
| [18] |
Li Q, Hou L, Ding G, et al. KDM6B induces epithelial-mesenchymal transition and enhances clear cell renal cell carcinoma metastasis through the activation of SLUG[J]. Int J Clin Exp Pathol, 2015, 8(6): 6334-6344. |
| [19] |
Zhang Y, Shen L, Stupack DG, et al. JMJD3 promotes survival of diffuse large B-cell lymphoma subtypes via distinct mechanisms[J]. Oncotarget, 2016, 7(20): 29387-29399. DOI:10.18632/oncotarget.8836 |
 2020, Vol. 47
2020, Vol. 47


