文章信息
- 达芬奇机器人胃癌根治术对患者胃肠动力及胃肠激素的影响
- Effect of Da Vinci Robot Radical Gastrectomy on Gastrointestinal Motility and Gastrointestinal Hormones of Gastric Cancer Patients
- 肿瘤防治研究, 2019, 46(12): 1085-1090
- Cancer Research on Prevention and Treatment, 2019, 46(12): 1085-1090
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.1099
- 收稿日期: 2019-08-30
- 修回日期: 2019-10-18
2. 712000 咸阳,咸阳市中心医院肝胆外科;
3. 730050 兰州,解放军联勤保障部队第940医院普通外科
2. Department of Hepatobiliary Surgery, Xianyang Central Hospital, Xianyang 712000, China;
3. Department of General Surgery, 940 Hospital of PLA Joint Logistics Support Force, Lanzhou 730050, China
胃癌是消化道最常见的恶性肿瘤,全球的发病率约9%,在所有恶性肿瘤中排名第4,死亡率约8.8%,排名第2[1],而在我国,胃癌的发病率与死亡率分别排第2和第3[2]。继2002年报道了机器人辅助胃癌根治术后,该技术在全球迅速发展[3]。解放军联勤保障部队第940医院普外科自2016年12月开始行达芬奇机器人胃癌根治术,发现其疗效明显,安全性也较好[4]。多项研究表明达芬奇机器人胃癌根治术后胃肠动力恢复时间较传统开腹手术明显缩短,但未就其进一步机制进行研究[5-8]。据报道,术后胃肠动力的恢复与胃肠激素密切相关[9-10]。因此本研究以行达芬奇机器人胃癌根治术与开腹胃癌根治术进行比较,测定术前与术后患者胃肠激素变化情况,观察胃肠动力恢复时间,并进一步探讨胃肠动力恢复与胃肠激素变化情况的相互关系及影响胃肠激素分泌的可能因素,以期完善达芬奇机器人胃癌根治术相较传统手术具有优势的理论基础。
1 资料与方法 1.1 一般资料选取2018年1月—2019年5月于解放军联勤保障部队第940医院普外科行达芬奇机器人胃癌根治术的患者125例纳入达芬奇组,选取同期行开腹胃癌根治术的患者92例纳入开腹手术组。纳入标准:(1)行达芬奇机器人或开腹胃癌根治术+D2淋巴结清扫术;(2)术前未行新辅助化疗及放射治疗;(3)无腹部手术史;(4)未合并其他严重慢性病;(5)术后病理活检明确诊断为胃癌;(6)充分告知患者及家属术前及术后需采血测定胃肠激素,征得患者及家属同意。排除标准:(1)合并严重的基础疾病;(2)术前已行放化疗;(3)有远处转移;(4)行姑息性手术;(5)合并其他恶性肿瘤;(6)临床病理资料不全。术前向患者及家属告知达芬奇机器人手术的相关事宜,由其自行决定手术方式。本研究患者均签署知情同意书,并经本院伦理会审查通过,符合《赫尔辛基宣言》。
1.2 手术方式手术操作依照《日本胃癌治疗指南》2014版由同等高级别医生严格实施[11]。对癌肿位于胃中上部的行全胃切除术、D2淋巴结清扫术及Roux-en-Y吻合术。对癌肿位于胃中下部的行远端胃大部切除术、D2淋巴结清扫术及BillrothⅡ式吻合术。开腹组手术方式已很常见,无需赘述。达芬奇组不同手术方式的差异如上所述主要为吻合方式的差异性,具体如下。
根治性全胃切除术:用直线切割闭合器离断食管下段,需注意食管浸润型胃癌中,不必一定确保切缘距肿瘤 > 5 cm,但应进行切缘的病理活检。于距离屈氏韧带15 cm处将空肠切断,提起远端至食管闭合处,用直线切割闭合器行食管-空肠侧侧吻合,见图 1。之后将远侧空肠与近侧断端于距离吻合口40 cm处行侧侧吻合。
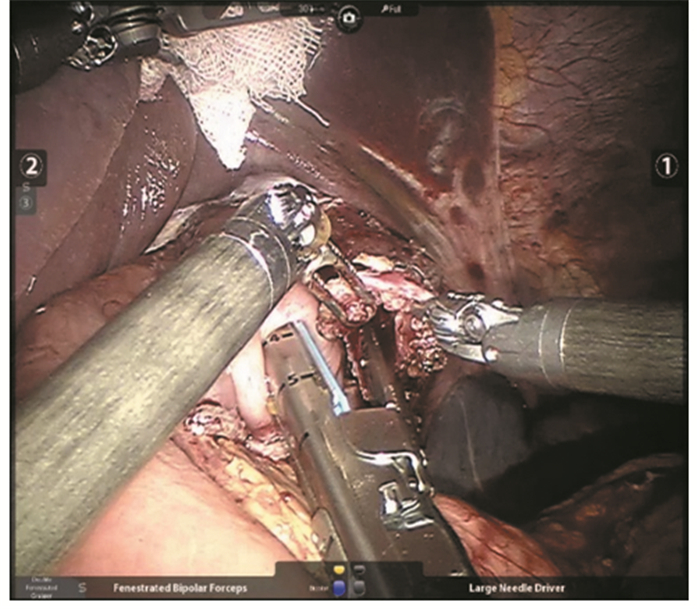
|
| ①, ②: No.1 and No.2 mechanical arms 图 1 达芬奇机器人食管-空肠侧侧吻合 Figure 1 Side-to-side esophagojejunostomy in Da Vinci robot radical gastrectomy |
根治性远侧胃切除术:使用直线切割闭合器断开胃的下部2/3。将距屈氏韧带15 cm处的空肠提起,并在残胃的大弯侧用直线切割闭合器行残胃-空肠侧侧吻合,见图 2。之后于距离吻合口10 cm处行Braun氏吻合,见图 3。
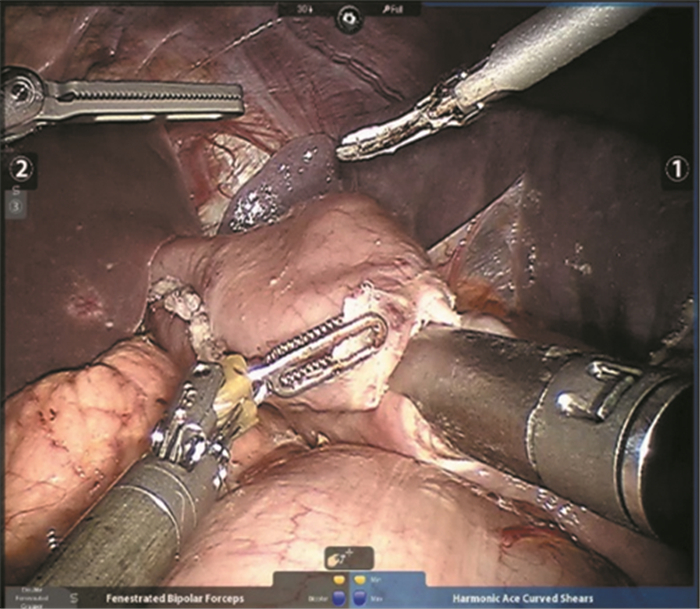
|
| 图 2 达芬奇机器人残胃-空肠侧侧吻合 Figure 2 Side-to-side gastrojejunostomy in Da Vinci robot radical gastrectomy |
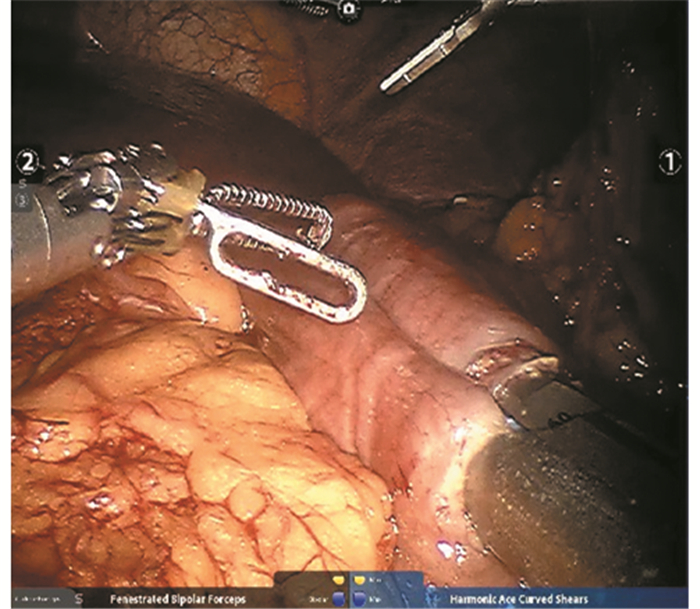
|
| 图 3 达芬奇机器人输入-输出袢Braun氏吻合 Figure 3 Braun's anastomosis in Da Vinci robot radical gastrectomy |
肠鸣音恢复时间:术后间隔3 h对患者根据腹部4分法所分4个区域听诊,每个区域每次听诊3 min,如果在≥2个区域肠鸣音≥每分钟3次,则确定肠鸣音已恢复并记下时间;首次肛门排气时间:告知患者及家属手术后记下肛门最早的排气时间(精确到分钟)。须注意即使患者肛门排气,腹胀无缓解,仍应继续观察,并记录腹胀缓解时肛门的排气时间。
1.3.2 胃肠激素测定取所有患者术前12 h、术后24 h空腹静脉血4 ml,置于试管中。每支试管加入30 μl 10%EDTA二钠和40 μl抑肽酶混匀。在4℃条件下将所有标本置于离心机中离心10 min(3000 r/min, r=13.5 cm)。将血浆均分2份置于-20℃冰箱保存。根据放射免疫法,利用液相竞争原理,采用非平衡法中的双管法对样品进行测定,即将之前分装的血浆各测定1次,取平均值。其检测方法严格按照说明书进行。
1.3.3 手术相关因素及炎性因子测定注意观察并记录所有患者手术时长、术中出血量、术后拔除引流管时间、术后24 h疼痛情况并进行VAS评分。采集所有患者术前12 h、术后24 h空腹静脉血4 ml,通过酶联免疫吸附法(ELISA)检测血清肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6、C反应蛋白(CRP)水平。
1.4 统计学方法采用SPSS22.0统计软件分析处理所有数据。符合正态分布的计量资料采用(x±s)表示,组间比较采用t检验(方差齐)或者t’检验(方差不齐);计数资料采用绝对数表示,组间比较采用χ2检验或Fisher精确检验;等级资料以秩和检验进行比较;相关性分析采用Pearson法。P < 0.05为差异有统计学意义。
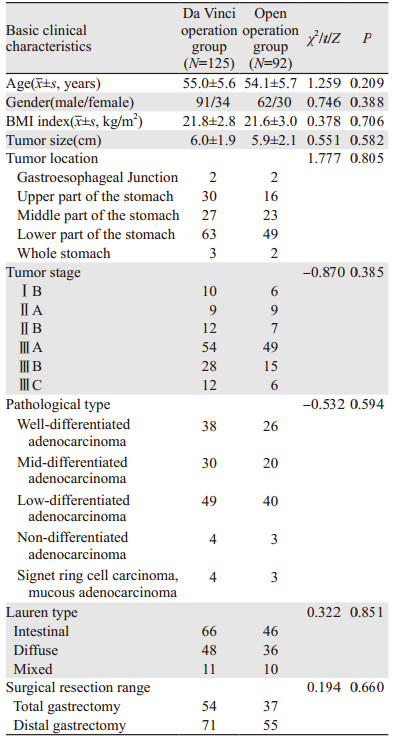
2 结果 2.1 一般情况达芬奇组和开腹手术组在性别、年龄、BMI指数、肿瘤大小、肿瘤部位、肿瘤分期、病理分型、Lauren分型、手术切除范围等之间差异无统计学意义(均P > 0.05),见表 1。
|
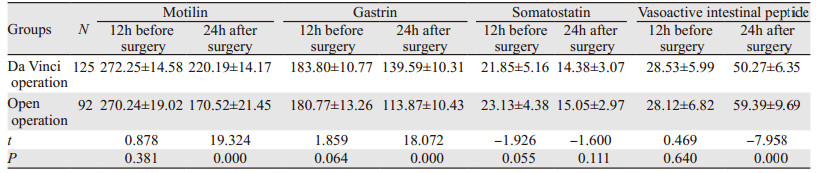
(1)将术前12 h达芬奇组和开腹手术组患者的血液胃动素、胃泌素、生长抑素和血管活性肠肽值分别进行组间比较,差异无统计学意义(均P > 0.05);(2)将术后24 h达芬奇组和开腹手术组患者的血液胃动素、胃泌素、生长抑素和血管活性肠肽值与术前12 h进行比较,胃动素、胃泌素、生长抑素值均较术前12 h明显下降(均P < 0.05),而血管活性肠肽值较术前12 h升高,差异有统计学意义(P < 0.05);(3)将术后24 h达芬奇组和开腹手术组患者的血液胃动素、胃泌素、生长抑素和血管活性肠肽值分别进行组间比较,发现达芬奇组胃动素和胃泌素值较开腹手术组高(均P < 0.05),生长抑素值差异无统计学意义(P > 0.05),而达芬奇组血管活性肠肽所测值较对开腹手术低(P < 0.05),见表 2。
|
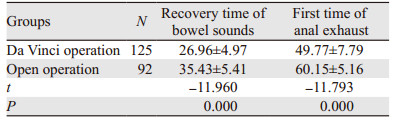
(1)术后肠鸣音恢复的时间达芬奇组比开腹手术组明显缩短(P < 0.05);(2)术后首次肛门的排气时间达芬奇组也比开腹手术组明显缩短(P < 0.05),见表 3。
|
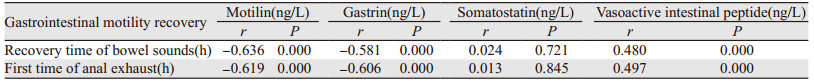
用Pearson法对术后24 h所测胃肠激素值与术后胃肠动力恢复情况进行相关性分析。结果发现:(1)术后24 h血液胃动素、胃泌素值与术后肠鸣音恢复时间、首次肛门排气时间存在负相关性(P < 0.05);(2)术后24 h血液生长抑素值与术后肠鸣音恢复时间、术后首次肛门排气时间无明显相关性(P > 0.05);(3)术后24 h血液血管活性肠肽值与术后肠鸣音恢复时间、术后首次肛门排气时间有正相关性(P < 0.05),见表 4。
|
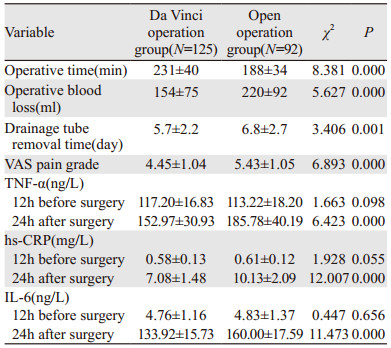
达芬器组手术时长比开腹手术组长(P < 0.05),但术中出血量,术后拔管时间、肿瘤坏死因子-α、超敏C反应蛋白、血清白介素-6水平均比开腹手术组少(P < 0.05),见表 5。
|
目前胃癌发病率与死亡率仍居所有恶性肿瘤前列,其不仅对个人和家庭造成极大危害和沉重经济负担,也加重了整个社会负担[12]。虽然胃癌的治疗近年来取得了重大进展,包括手术、放化疗、靶向治疗、生物学治疗,但胃癌切除+淋巴结清扫手术仍是主要治疗方法[13]。伴随微创技术的发展,现已被普遍接受,作为最新的微创技术,达芬奇机器人于2010年首次在中国用于胃癌根治性切除手术[14]。达芬奇机器人手术相比传统手术有明显优势:(1)达芬奇机器人手术的视野可放大10~15倍,且为三维,视野更加精准;(2)机器人手术系统的机械臂相比于外科医生的手,更加稳定;(3)内部关节腕在狭窄的手术领域提供了更大的灵活性[15]。同时有大量文献报道进一步佐证了达芬奇机器人在疗效上确有明显优势[4-8],其中包括术后胃肠动力恢复情况。术后胃肠动力的尽快恢复对于患者其他功能的尽早恢复及缩短住院时间有着重要作用[16]。
本研究结果表明达芬奇机器人胃癌根治术胃肠动力恢复较传统手术快。对于胃肠道手术,炎性细胞的激活,自主神经功能障碍(主要与手术应激反应有关),外源性麻醉药对肠道阿片受体的激动作用,以及电解质紊乱都会导致术后胃肠功能的下降。这些效应因子互相协作与影响,最后共同途径是收缩力、运动性受损[17]。而这些因素都会直接或间接引起机体神经-内分泌系统的变化进而导致胃肠道激素分泌状态的改变,因此胃肠激素有可能在术后胃肠功能恢复中发挥重要作用。
本研究结果表明,术后24 h达芬奇组血液胃动素、胃泌素下降幅度小;血液血管活性肠肽上升幅度小。之后对术后24 h胃肠激素值与术后胃肠动力恢复情况行Pearson相关性分析提示达芬奇机器人胃癌根治术后胃肠功能恢复更快较传统开腹手术更快,这与部分胃肠激素的变化有一定相关性。
为何两种术式胃肠激素分泌不同,结合他人报道,笔者认为具体因素可能如下:(1)传统开腹手术中,胃肠道于空气中长时间暴露导致体温下降、肠壁干燥脱水等,这些会导致更多的组织损伤,激活肠道肌层内的巨噬细胞从而引发无菌性炎性反应[18],而达芬奇机器人手术则避免了这些问题;(2)达芬奇机器人手术更加精细,从而对组织损伤小、减少了术中及术后出血量,同时术后疼痛减轻及拔除腹腔引流管时间提前[4-5, 19],而这些因素都与机体应激反应有关,机体的应激反应会刺激交感神经兴奋,进而刺激儿茶酚胺释放,儿茶酚胺可抑制胃泌素、胃动素的释放进而抑制胃肠道功能[20-21];(3)达芬奇机器人手术避免了肠管直接与纱布、手套接触,同时由于视野范围扩大及无损伤钳的使用减少对肠管的牵拉,从而对肠道干扰较少,因而降低了对胃肠道激素内分泌环境的影响,Kim等[22]则认为术中牵拉器官是引起术后炎性反应的重要因素。由上述各种因素可见手术创伤引起的炎性及应激反应对胃肠激素的释放有着重要作用。以上因素使得达芬奇机器人手术胃肠激素的分泌更有利胃肠功能的恢复,但达芬奇机器人手术时间更长会导致更大的创伤及更长的麻醉时间,有研究表明麻醉剂会影响胃肠激素的释放[23],也有研究表明术中麻醉影响患者术后胃肠功能的恢复[24]。笔者分析胃肠激素的分泌是创伤导致的炎性因子的释放、自主神经功能障碍(主要与手术应激反应有关)及外源性麻醉药等共同作用,而在达芬奇机器人胃癌根治术中它们的影响综合起来使胃肠激素的释放有利于胃肠功能恢复。为了验证两种手术方式中胃肠激素的影响因素是否有差异,本研究对两组手术时长、术中出血量、术后拔除引流管时间、术后24 h疼痛VAS评分以及炎性相关因子(肿瘤坏死因子-α、超敏C反应蛋白、血清白介素-6)进行统计比较,结果表明:达芬奇组手术时长比开腹手术组长(P < 0.05),但术中出血量,术后拔管时间、肿瘤坏死因子-α、超敏C反应蛋白、血清白介素-6水平均比对照组少(P < 0.05)。
综上,(1)达芬奇机器人胃癌根治术术后胃肠动力恢复时间较传统开腹手术缩短;(2)达芬奇机器人胃癌根治术相比传统手术可降低术后胃动素、胃泌素、血管活性肠肽水平的变化幅度,但对生长抑素影响不大;(3)达芬奇机器人胃癌根治术后胃肠功能恢复更快与部分胃肠激素的变化有一定相关性;(4)达芬奇机器人胃癌根治术创伤更小,而创伤引起的炎性反应、应激反应是影响达芬奇机器人胃癌根治术胃肠激素分泌的重要因素。但本研究为单中心研究,结果存在一定随机性。
本研究选取最常见的几种胃肠激素,对达芬奇机器人胃癌术后胃肠动力恢复进行了初步研究,那么其他胃肠激素是否有类似作用以及达芬奇机器人胃癌术后胃肠动力与胃肠激素间作用的具体机制、联系将是下一步研究方向。
作者贡献
韩博强:试验设计、病例收集、部分数据处理及论文撰写
马有伟:病例收集及部分论文撰写
张成:部分数据处理
周党军:文献查阅
刘宏斌:参与论文修改
韩晓鹏:对试验设计及论文修改提供指导意见
| [1] |
McGuire S. World Cancer Report 2014. Geneva, Switzerland: World Health Organization, International Agency for Research on Cancer, WHO Press, 2015[J]. Adv Nutr, 2016, 7(2): 418-419. |
| [2] |
Global Burden of Disease Cancer Collaboration, Fitzmaurice C, Allen C, et al. Global, Regional, and National Cancer Incidence, Mortality, Years of Life Lost, Years Lived With Disability, and Disability-Adjusted Life-years for 32 Cancer Groups, 1990 to 2015: A Systematic Analysis for the Global Burden of Disease Study[J]. JAMA Oncol, 2017, 3(4): 524-548. DOI:10.1001/jamaoncol.2016.5688 |
| [3] |
Hashizume M, Shimada M, Tomikawa M, et al. Early experiences of endoscopic procedures in general surgery assisted by a computer-enhanced surgical system[J]. Surg Endosc, 2002, 16(8): 1187-1191. DOI:10.1007/s004640080154 |
| [4] |
徐子鹏, 汪文杰, 熊诗萌, 等. 达芬奇机器人手术系统辅助胃癌根治术的临床疗效[J]. 中华消化外科杂志, 2019, 18(5): 453-458. [Xu ZP, Wang WJ, Xiong SM, et al. Clinical efficacy of Da Vinci robot-assisted radical gastrectomy for gastric cancer[J]. Zhonghua Xiao Hua Wai Ke Za Zhi, 2019, 18(5): 453-458. DOI:10.3760/cma.j.issn.1673-9752.2019.05.010] |
| [5] |
兰蕴平, 李春玲, 黎嘉嘉, 等. 达芬奇机器人与传统开腹手术在老年上腹部外科疾病中的应用比较[J]. 中华普通外科杂志, 2017, 32(7): 595-597. [Lan YP, Li CL, Li JJ, et al. Da Vinci robot surgical system versus traditional open surgery for old patients with upper abdominal surgical diseases: a case control study[J]. Zhonghua Pu Tong Wai Ke Za Zhi, 2017, 32(7): 595-597. DOI:10.3760/cma.j.issn.1007-631X.2017.07.015] |
| [6] |
马超, 李沛雨, 张楠, 等. 达芬奇机器人胃癌根治术与开腹胃癌根治术治疗胃癌近期疗效的对比研究[J]. 实用心脑肺血管病杂志, 2017, 25(9): 47-51. [Ma C, Li PY, Zhang N, et al. Comparative Study for Short-term Curative Effect on Gastric Carcinoma between Leonardo's Robotic and Open Radical Operation for Gastric Carcinoma[J]. Shi Yong Xin Nao Fei Xue Guan Bing Za Zhi, 2017, 25(9): 47-51. DOI:10.3969/j.issn.1008-5971.2017.09.011] |
| [7] |
van Boxel GI, Ruurda JP, van Hillegersberg R. Robotic-assisted gastrectomy for gastric cancer: a European perspective[J]. Gastric Cancer, 2019, 22(5): 909-919. DOI:10.1007/s10120-019-00979-z |
| [8] |
唐波, 曾冬竹, 赵永亮, 等. 达芬奇机器人胃癌及结直肠癌手术647例临床研究[J]. 中华外科杂志, 2016, 54(3): 177-181. [Tang B, Zeng DZ, Zhao YL, et al. Application of da Vinci robotic surgical system in radical resection of gastric and colorectal cancer: a report of 647 cases[J]. Zhonghua Wai Ke Za Zhi, 2016, 54(3): 177-181. DOI:10.3760/cma.j.issn.0529-5815.2016.03.005] |
| [9] |
Kitazawa T, Kaiya H. Regulation of Gastrointestinal Motility by Motilin and Ghrelin in Vertebrates[J]. Front Endocrinol (Lausanne), 2019, 10: 278. DOI:10.3389/fendo.2019.00278 |
| [10] |
Martinez EE, Panciotti C, Pereira LM, et al. Gastrointestinal hormone profiles associated with enteral nutrition tolerance and gastric emptying in pediatric critical illness: a pilot study[J]. JPEN J Parenter Enteral Nutr, 2019. |
| [11] |
Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2014 (ver.4)[J]. Gastric Cancer, 2017, 20(1): 1-19. DOI:10.1007/s10120-016-0622-4 |
| [12] |
Zhou M, Wang H, Zhu J, et al. Cause-specific mortality for 240 causes in China during 1990-2013: a systematic subnational analysis for the Global Burden of Disease Study 2013[J]. Lancet, 2016, 387(10015): 251-272. DOI:10.1016/S0140-6736(15)00551-6 |
| [13] |
Kiyokawa T, Fukagawa T. Recent trends from the results of clinical trials on gastric cancer surgery[J]. Cancer Commun (Lond), 2019, 39(1): 11. DOI:10.1186/s40880-019-0360-1 |
| [14] |
余佩武, 钱锋, 曾冬竹, 等. 应用达芬奇机器人手术系统治疗胃癌[J]. 中华消化外科杂志, 2010, 9(2): 114-115. [Yu PW, Qian F, Zeng DZ, et al. Application of Da Vinci surgical system in the treatment of gastric cancer[J]. Zhonghua Xiao Hua Wai Ke Za Zhi, 2010, 9(2): 114-115. DOI:10.3760/cma.j.issn.1673-9752.2010.02.012] |
| [15] |
Wang Y, Zhao X, Song Y, et al. A systematic review and meta-analysis of robot-assisted versus laparoscopically assisted gastrectomy for gastric cancer[J]. Medicine(Baltimore), 2017, 96(48): e8797. |
| [16] |
Munk-Madsen P, Eriksen JR, Kehlet H, et al. Why still in hospital after laparoscopic colorectal surgery within an enhanced recovery programme?[J]. Colorectal Dis, 2019, 21(12): 1438-1444. DOI:10.1111/codi.14762 |
| [17] |
Vather R, O'Grady G, Bissett IP, et al. Postoperative ileus: mechanisms and future directions for research[J]. Clin Exp Pharmacol Physiol, 2014, 41(5): 358-370. DOI:10.1111/1440-1681.12220 |
| [18] |
Gomez-Pinilla PJ, Binda MM, Lissens A, et al. Absence of intestinal inflammation and postoperative ileus in a mouse model of laparoscopic surgery[J]. Neurogastroenterol Motil, 2014, 26(9): 1238-1247. DOI:10.1111/nmo.12376 |
| [19] |
Li J, Xi H, Cui J, et al. Minimally invasive surgery for gastric cancer: A comparison between robotic, laparoscopic and open surgery[J]. Surg Endosc, 2018, 32(3): 1422-1433. DOI:10.1007/s00464-017-5826-0 |
| [20] |
田浩, 魏微微, 张雪梅, 等. 腹腔镜胃癌根治术对胃癌患者机体能量代谢及胃肠激素的影响[J]. 实用医学杂志, 2018, 34(20): 3426-3429. [Tian H, Wei WW, Zhang XM, et al. Effect of laparoscopic radical gastrectomy on energy metabolism and gastrointestinal hormones in patients with gastric cancer[J]. Shi Yong Yi Xue Za Zhi, 2018, 34(20): 3426-3429. DOI:10.3969/j.issn.1006-5725.2018.20.024] |
| [21] |
Baig MK, Wexner SD. Postoperative ileus: a review[J]. Dis Colon Rectum, 2004, 47(4): 516-526. DOI:10.1007/s10350-003-0067-9 |
| [22] |
Kim MC, Kim KH, Kim HH, et al. Comparison of laparoscopy-assisted by conventional open distal gastrectomy and extraperigastric lymph node dissection in early gastric cancer[J]. J Surg Oncol, 2005, 91(1): 90-94. DOI:10.1002/jso.20271 |
| [23] |
童博, 郑荣芝, 肖霞, 等. 盐酸右美托咪定对乳腺癌患者术后胃肠激素及恶心呕吐的影响[J]. 医药导报, 2018, 37(12): 1478-1480. [Tong B, Zheng RZ, Xiao X, et al. Effect of dexmedetomidine hydrochloride on gastrointestinal hormones and nausea and vomiting in patients with breast cancer after operation[J]. Yi Yao Dao Bao, 2018, 37(12): 1478-1480.] |
| [24] |
Schnoor J, Bartz S, Klosterhalfen B, et al. A long-term porcine model for measurement of gastrointestinal motility[J]. Lab Anim, 2003, 37(2): 145-154. DOI:10.1258/00236770360563796 |
 2019, Vol. 46
2019, Vol. 46


