文章信息
- 根治性外放射治疗与根治性前列腺切除术治疗局限性高危前列腺癌的疗效比较
- Efficacy of Definitive External-beam Radiotherapy Versus Radical Prostatectomy on Clinically Localized High-risk Prostate Cancer Patients: A Retrospective Study
- 肿瘤防治研究, 2019, 46(12): 1113-1117
- Cancer Research on Prevention and Treatment, 2019, 46(12): 1113-1117
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0965
- 收稿日期: 2019-07-26
- 修回日期: 2019-09-20
2. 44195 克利夫兰,美国克利夫兰医学中心格里克曼泌尿及肾脏研究所
2. Glickman Urologic and Kidney Institute, Cleveland Clinic, 9500 Euclid Ave. Q100, Cleveland, OH 44195, USA
高危前列腺癌(prostate cancer, PCa)约占所有类型PCa的30%[1]。针对高危PCa的局部根治性治疗策略可以获得良好的局部肿瘤控制,同时可以降低远处转移的概率[2]。通常情况下,我们使用根治性外放射治疗(external-beam radiotherapy, ExRT)和雄激素剥夺治疗(androgen-deprivation therapy, ADT)联合治疗高危PCa[3]。而一系列研究表明,根治性前列腺切除术(radical prostatectomy, RP)同样具有良好的局部肿瘤控制效果[4-6]。因此,美国泌尿外科协会和欧洲泌尿外科协会均支持RP联合盆腔淋巴结清扫(pelvic lymph node dissection, PLND)作为高危局限性前列腺癌的标准治疗方案之一[2, 7]。
目前已有多项有关ExRT或RP治疗高危前列腺癌的研究,但是尚无比较两种治疗方案差异的研究[8-9]。此外,两种治疗方案可能带来的不良反应也是我们需要讨论的重要内容。
本文是基于单中心的回顾性研究,通过比较ExRT和RP两种根治性方案治疗高危PCa患者的临床疗效差异,为高危前列腺癌的治疗选择作初步探索。
1 资料与方法 1.1 病例收集收集湖北省肿瘤医院2009年6月—2018年9月诊断为T2b~4N0M0的共150例接受ExRT或RP治疗的高危局限性前列腺癌患者。入选标准为未经治疗的、高危、无淋巴结转移及无远处转移,病理证实为前列腺腺泡腺癌的患者。PSA≥20 ng/ml、cT3以上、GS≥8三项中任意一条即满足高危定义。
所有患者均接受了完整的病史采集、体格检查及实验室检查。影像学检查包括CT或MRI,用以对疾病进行临床分期。此外,还有部分患者接受了PET/CT或前列腺特异性表面抗原(prostate specific membrane antigen, PSMA)PET/CT检查。
患者治疗后定期进行随访包括PSA、体格及影像学检查,通常PSA检查为术后半年内每月一次,半年之后每三月一次,两年之后每半年一次直至出现疾病进展;影像学检查为术后每半年一次,两年之后每年进行一次直至出现疾病进展,而体格检查在每次随访时进行,所有随访截止时间为2018年9月。当出现生化复发(biochemical failure, BF)或影像学进展时,患者将接受进一步的检查及治疗,包括ADT、放射或骨治疗。其中BF的定义为接受RP或ExRT治疗后,PSA降低至≤0.1 ng/ml,继续随访后当首次出现PSA≥0.2 ng/ml(RP)或2 ng/ml(ExRT),再次复查时仍高于此数值,则首次出现高值的时间点为BF的起点。
辅助放疗的概念是RP术后六月之内接受的放射治疗,此时没有证据表明BF或远处转移。而挽救性放疗则是在RP术后出现BF或影像学证实的疾病进展,但没有远处转移,此时接受的放射治疗称为挽救性放疗。此外,当患者出现切缘阳性或淋巴结阳性结果时需要接受辅助放疗。
1.2 终点事件收集患者年龄、既往史、随访时间、病理结果及PSA变化值等进行分析。此外,主要研究终点为患者的无生化复发生存期(biochemical failure-free survival, BFFS),次要研究终点为无远处转移生存期(distant metastasis-free survival, DMFS)、肿瘤特异性生存期(cancer-specific survival, CSS)及总生存期(overall survival, OS)。
1.3 统计学方法采用IBM SPSS19.0统计软件进行统计分析。所有数据均使用Kaplan-Meier方法进行比较。组间比较使用χ2检验。两组患者间不同变量的比较使用Mann-Whitney U检验。P < 0.05为差异有统计学意义,所有检验均为双侧。
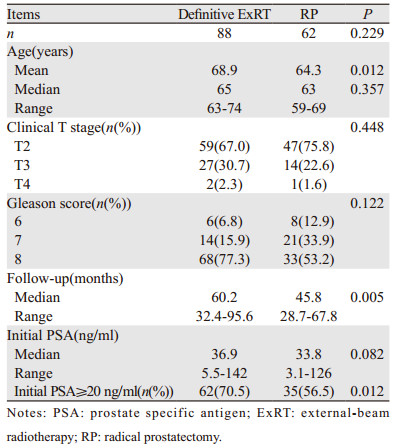
2 结果150例患者中有88例接受ExRT治疗,62例患者接受RP联合PLND治疗。患者的临床数据见表 1。两组患者的临床分期和GS差异无统计学意义。但是,初始PSA≥20ng/ml的患者中ExRT组显著高于RP组(P=0.012)。
|
88例接受ExRT治疗的患者中有86例同时接受了ADT治疗,另外两例患者由于心血管疾病等禁忌证未行ADT治疗。62例接受RP治疗的患者均同时进行了PLND治疗。62例RP治疗的患者中有58例术后病理结果提示高危因素,包括肿瘤分期≥T3和(或)切缘阳性和(或)淋巴结阳性和(或)GS≥8。
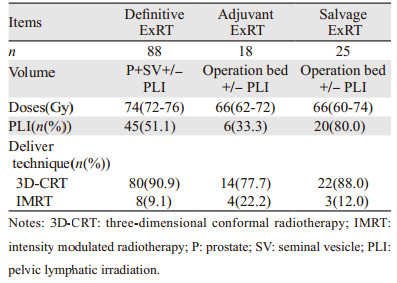
根治性、辅助性和挽救性ExRT的临床数据见表 2。三维适形放疗(three-dimensional conformal radiotherapy, 3D-CRT)或调强放疗(intensity modulated radiation therapy, IMRT)技术被用于所有接受ExRT治疗的患者。
|
在62例RP治疗的患者中有18例随后接受了辅助性放疗,另外有25例患者由于疾病进展或出现BF随后接受了挽救性放疗,见表 2。上述这些接受了辅助性/挽救性放疗的患者均同时联合使用ADT。
接受挽救性ExRT治疗的25例患者的中位PSA为1.68(0.32~58.6)ng/ml。其中PSA < 0.5 ng/ml、0.5 ng/ml < PSA < 1.5 ng/ml以及PSA > 1.5 ng/ml的患者分别为2(8.0%)、10(40.0%)和13(52.0%)例。
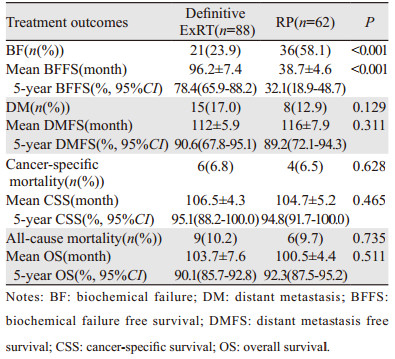
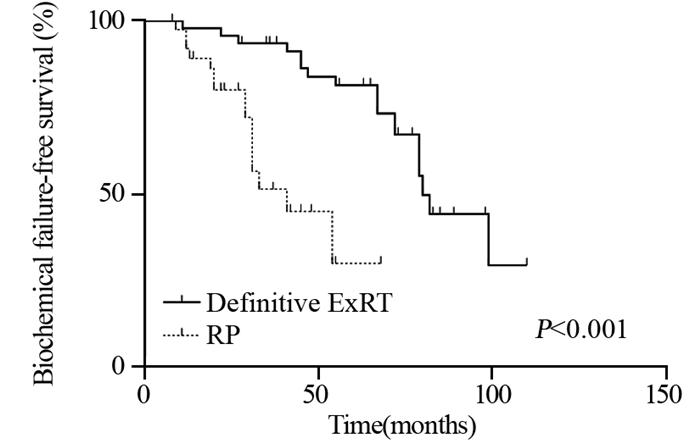
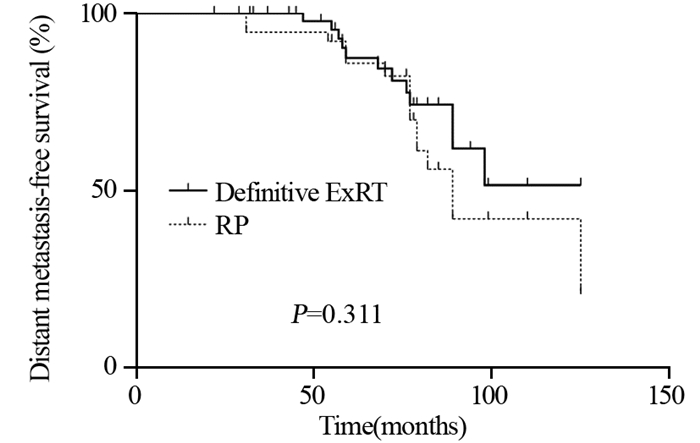
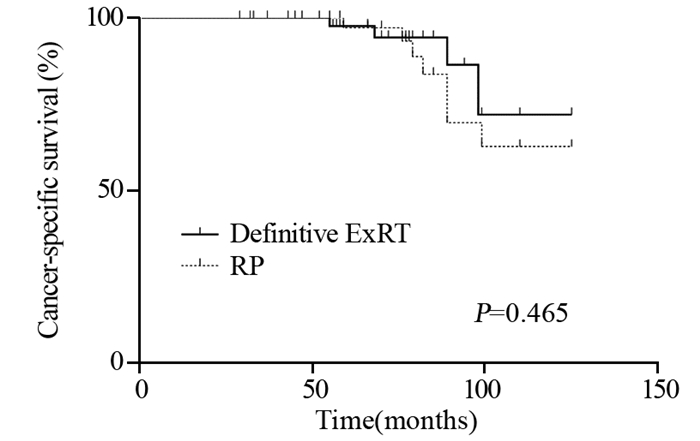
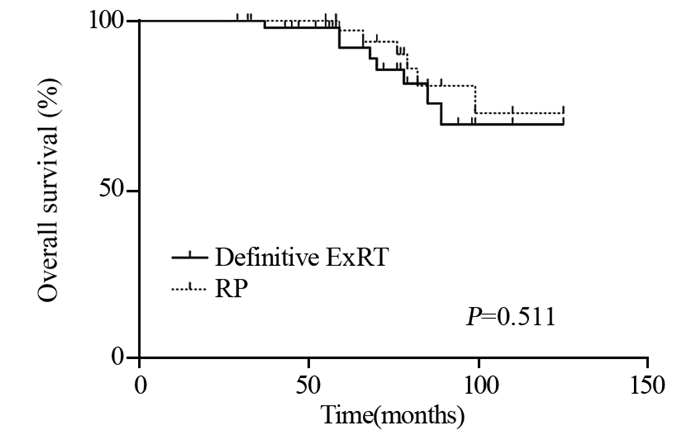
ExRT组患者BF显著低于RP组患者(23.9% vs. 58.1%, P < 0.001),见表 3,而BFFS显著延长(96.2±7.4 vs. 38.7±4.6月,P < 0.001),见图 1。但是两组间比较DMFS、CSS、OS差异均无统计学意义,见图 2~4。
|
|
| 图 1 两组局限性高危前列腺癌患者的无生化复发生存曲线图 Figure 1 Biochemical failure-free survival curves of localized high-risk prostate cancer patients treated with ExRT or RP |
|
| 图 2 两组局限性高危前列腺癌患者的无远处转移生存曲线图 Figure 2 Distant metastasis-free survival curves of localized high-risk prostate cancer patients treated with ExRT or RP |
|
| 图 3 两组局限性高危前列腺癌患者的癌症特异性生存曲线图 Figure 3 Cancer-specifc survival curves of localized highrisk prostate cancer patients treated with ExRT or RP |
|
| 图 4 两组局限性高危前列腺癌患者的总生存期生存曲线图 Figure 4 Overall survival curves of localized high-risk prostate cancer patients treated with ExRT or RP |
目前针对局限性高危PCa的治疗暂无统一的共识[5-6]。指南推荐的治疗方案包括根治性ExRT+ADT或RP+PLND+/-辅助放疗,根据患者是否有高危因素决定是否行术后辅助放疗[2, 7]。本研究结果表明接受RP治疗后的BF显著高于接受ExRT治疗的患者(58.1% vs. 23.9%, P < 0.001),而BFFS则显著缩短(38.7±4.6 vs. 96.2±7.4, P < 0.001)。但是,两组间比较DMFS、CSS和OS差异无统计学意义。
大量研究已证明RP是高危PCa的一线治疗方案,其中10年CSS达80%~90%,而五年BFFS为50%~70%[10-11]。但是,由于对高危PCa的定义有些许差别,各研究中心的数据有一些差距。本研究中,5年CSS为94.8%,5年BFFS为32.1%。
此外,针对RP术后出现BF或局部进展的患者,继续给予挽救性放疗联合ADT治疗也取得了不错的疗效[12-15]。本研究中,62例接受RP治疗的患者中有25例因为出现BF或局部进展而接受了挽救性放疗联合ADT辅助治疗。所有接受挽救性放疗的患者中有48.0%的患者PSA≤1.5 ng/ml。
高危PCa的患者通常伴随着淋巴结转移,而RP联合PLND可以提供完整的分期从而为预后预测和辅助治疗的选择提供重要参考[4, 10, 16]。研究显示扩大PLND可以提高阳性淋巴结的检出率同时可以提高患者的总生存期[16-18]。本研究中所有患者均接受了扩大PLND,而平均去除的淋巴结为12枚,范围为5~38枚。
放疗剂量的增加可以获得更好的无生化复发生存期[19-20]。此外,有研究报道放疗剂量的增加可以提高肿瘤的局部控制、降低远处转移并提高癌症特异性生存期[19, 21]。但是,上述研究中OS并未提高。因此,提示根治性放疗后给予长期ADT辅助治疗可能比单纯提高放疗剂量更能使患者获益。本研究中,平均根治性ExRT的放疗剂量为74 Gy(72~76 Gy),有97.7%的患者接受了长期ADT治疗,仅有两例患者因心血管疾病禁忌证而未行ADT治疗。此外所有接受外放射治疗的患者均接受了3D-CRT或IMRT治疗。
本研究的局限在于回顾性研究的内在缺陷以及相对较短的随访时间。此外,研究样本的初始治疗PSA分布不均以及两组患者年龄和随访时间存在的统计学差异导致了选择偏倚的产生。相较于RP组,ExRT组的患者年龄更大且具有更高的初始治疗PSA,这可能与患者年龄较大不愿接受手术治疗有关;而RP组患者的随访时间更短与近年来RP逐渐成为治疗高危PCa的一线方案有关。
本研究表明,与RP相比,接受根治性ExRT治疗的局限性高危PCa患者BF显著降低,而BFFS显著延长。但是,两组间五年DMFS、CSS和OS比较均无显著差异。未来需要设计随机对照的前瞻性临床研究来验证该结论,为高危PCa患者的治疗选择提供更高等级的证据。
作者贡献
邓康俐:论文设计,数据分析,论文撰写及修改
崔殿生、朱晖:论文设计、撰写及修改
罗波、魏少忠:论文指导、撰写及修改
贾全安:论文撰写
刘三河:统计分析
黄 雷:文献汇总,数据分析
| [1] |
Weiner AB, Matulewicz RS, Schaeffer EM, et al. Contemporary management of men with high-risk localized prostate cancer in the United States[J]. Prostate Cancer Prostatic Dis, 2017, 20(3): 283-288. DOI:10.1038/pcan.2017.5 |
| [2] |
Mottet N, Bellmunt J, Bolla M, et al. EAU-ESTRO-SIOG guidelines on prostate cancer. Part 1: screening, diagnosis, and local treatment with curative intent[J]. Eur Urol, 2017, 71(4): 618-629. DOI:10.1016/j.eururo.2016.08.003 |
| [3] |
Horwitz EM, Bae K, Hanks GE, et al. Ten-year follow-up of radiation therapy oncology group protocol 92-02: a phase Ⅲ trial of the duration of elective androgen deprivation in locally advanced prostate cancer[J]. J Clin Oncol, 2008, 26(15): 2497-2504. DOI:10.1200/JCO.2007.14.9021 |
| [4] |
Johnstone PA, Ward KC, Goodman M, et al. Radical prostatectomy for clinical T4 prostate cancer[J]. Cancer, 2006, 106(12): 2603-2609. DOI:10.1002/cncr.21926 |
| [5] |
Siddiqui SA, Boorjian SA, Blute ML, et al. Impact of adjuvant androgen deprivation therapy after radical prostatectomy on the survival of patients with pathological T3b prostate cancer[J]. BJU Int, 2011, 107(3): 383-388. DOI:10.1111/j.1464-410X.2010.09565.x |
| [6] |
Spahn M, Weiss C, Bader P, et al. Long-term outcome of patients with high-risk prostate cancer following radical prostatectomy and stage-dependent adjuvant androgen deprivation[J]. Urol Int, 2010, 84(2): 164-173. DOI:10.1159/000277593 |
| [7] |
Sanda MG, Cadeddu JA, Kirkby E, et al. Clinically localized prostate cancer: AUA/ASTRO/SUO guideline. PartⅠ: risk stratification, shared decision making, and care options[J]. J Urol, 2018, 199(3): 683-690. DOI:10.1016/j.juro.2017.11.095 |
| [8] |
Potosky AL, Davis WW, Hoffman RM, et al. Five-year outcomes after prostatectomy or radiotherapy for prostate cancer: the prostate cancer outcomes study[J]. J Natl Cancer Inst, 2004, 96(18): 1358-1367. DOI:10.1093/jnci/djh259 |
| [9] |
Sundi D, Tosoian JJ, Nyame YA, et al. Outcomes of very high-risk prostate cancer after radical prostatectomy: Validation study from 3 centers[J]. Cancer, 2019, 125(3): 391-397. DOI:10.1002/cncr.31833 |
| [10] |
Ward JF, Slezak JM, Blute ML, et al. Radical prostatectomy for clinically advanced (cT3) prostate cancer since the advent of prostate-specific antigen testing: 15-year outcome[J]. BJU Int, 2005, 95(6): 751-756. DOI:10.1111/j.1464-410X.2005.05394.x |
| [11] |
Zwergel U, Suttmann H, Schroeder T, et al. Outcome of prostate cancer patients with initial PSA > or =20 ng/ml undergoing radical prostatectomy[J]. Eur Urol, 2007, 52(4): 1058-1065. DOI:10.1016/j.eururo.2007.03.056 |
| [12] |
Bolla M, van Poppel H, Collette L, et al. Postoperative radiotherapy after radical prostatectomy: a randomised controlled trial (EORTC trial 22911)[J]. Lancet, 2005, 366(9485): 572-578. DOI:10.1016/S0140-6736(05)67101-2 |
| [13] |
Bolla M, van Poppel H, Tombal B, et al. Postoperative radiotherapy after radical prostatectomy for high-risk prostate cancer: long-term results of a randomised controlled trial (EORTC trial 22911)[J]. Lancet, 2012, 380(9858): 2018-2027. DOI:10.1016/S0140-6736(12)61253-7 |
| [14] |
Boorjian SA, Karnes RJ, Viterbo R, et al. Long-term survival after radical prostatectomy versus external-beam radiotherapy for patients with high-risk prostate cancer[J]. Cancer, 2011, 117(13): 2883-2891. DOI:10.1002/cncr.25900 |
| [15] |
Thompson IM, Valicenti RK, Albertsen P, et al. Adjuvant and salvage radiotherapy after prostatectomy: AUA/ASTRO Guideline[J]. J Urol, 2013, 190(2): 441-449. DOI:10.1016/j.juro.2013.05.032 |
| [16] |
Briganti A, Blute ML, Eastham JH, et al. Pelvic lymph node dissection in prostate cancer[J]. Eur Urol, 2009, 55(6): 1251-1265. DOI:10.1016/j.eururo.2009.03.012 |
| [17] |
Briganti A, Joniau S, Gontero P, et al. Identifying the best candidate for radical prostatectomy among patients with high-risk prostate cancer[J]. Eur Urol, 2012, 61(3): 584-592. DOI:10.1016/j.eururo.2011.11.043 |
| [18] |
Wagner M, Sokoloff M, Daneshmand S. The role of pelvic lymphadenectomy for prostate cancer--therapeutic?[J]. J Urol, 2008, 179(2): 408-413. DOI:10.1016/j.juro.2007.09.027 |
| [19] |
Kuban DA, Levy LB, Cheung MR, et al. Long-term failure patterns and survival in a randomized dose-escalation trial for prostate cancer. Who dies of disease?[J]. Int J Radiat Oncol Biol Phys, 2011, 79(5): 1310-1317. DOI:10.1016/j.ijrobp.2010.01.006 |
| [20] |
Zietman AL, Bae K, Slater JD, et al. Randomized trial comparing conventional-dose with high-dose conformal radiation therapy in early-stage adenocarcinoma of the prostate: long-term results from proton radiation oncology group/american college of radiology 95-09[J]. J Clin Oncol, 2010, 28(7): 1106-1111. DOI:10.1200/JCO.2009.25.8475 |
| [21] |
Zelefsky MJ, Eastham JA, Cronin AM, et al. Metastasis after radical prostatectomy or external beam radiotherapy for patients with clinically localized prostate cancer: a comparison of clinical cohorts adjusted for case mix[J]. J Clin Oncol, 2010, 28(9): 1508-1513. DOI:10.1200/JCO.2009.22.2265 |
 2019, Vol. 46
2019, Vol. 46


