文章信息
- 雄激素剥夺疗法和免疫疗法在前列腺癌治疗中的研究进展
- A Comprehensive Review of Androgen Deprivation Therapy and Immunotherapy on Prostate Cancer
- 肿瘤防治研究, 2019, 46(10): 867-872
- Cancer Research on Prevention and Treatment, 2019, 46(10): 867-872
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0787
- 收稿日期: 2019-06-14
- 修回日期: 2019-07-22
2. 430079 武汉,湖北省肿瘤医院泌尿外科
2. Department of Urology, Hubei Cancer Hospital, Huazhong University of Science and Technology, Wuhan 430079, China
前列腺癌是美国成年男性最常见的恶性肿瘤,在癌症相关致死中排名第二[1]。雄激素剥夺治疗(Androgen deprivation therapy, ADT)是使用手术或者药物达到去势效果,是目前前列腺癌治疗的基石和标准方法[2]。几乎所有的前列腺癌最终都会进展为去势抵抗性前列腺癌(Castration-resistant prostate cancer, CRPC),尽管新的治疗方法层出不穷,但是其中大部分新药物的作用靶点依旧是阻断雄激素的产生[3]。由此不难看出雄激素及其上下游信号通路在疾病发展过程中所起到的重要作用。ADT会直接作用于前列腺癌细胞,抑制其生长,而同时雄激素及ADT对免疫系统也有着重要的影响[4]。免疫治疗是当下最受关注的癌症治疗方法,主要的作用机制是激活机体的免疫系统以达到控制肿瘤生长的目的。第一个获得FDA批准临床应用的免疫治疗药物是sipuleucel-T(sip-T),它的诞生立即引起了医生和患者的关注,并为复发转移性高危性前列腺癌的治疗提供了全新的思路[5]。而其他类型的免疫治疗,如免疫检查点抑制剂CTLA-4单抗、PD-1单抗和PD-L1单抗也陆续得到批准并用于其他多种类型癌症的临床治疗[6]。研究表明ADT本身就能对免疫系统起到调节作用,考虑到ADT在几乎所有阶段的前列腺癌患者中持续使用,研究ADT如何与免疫治疗协同作用就显得尤为关键[7]。本文将系统阐述ADT治疗药物的分类及作用机制,以及ADT如何与免疫治疗协同影响抗癌效果,为前列腺癌的治疗提供新的思路。
1 雄激素在前列腺癌中的作用前列腺癌起源于前列腺上皮内瘤变(prostatic intraepithelial neoplasia, PIN),之后发展为高级别PIN(high grade PIN, HG-PIN),继续发展则最终变为腺癌,此时癌细胞已穿透上皮组织并侵犯基底细胞,最后会出现转移[8]。前列腺细胞的生长和功能高度依赖雄激素,因此抑制雄激素的产生或抑制雄激素受体(androgen receptor, AR)可以在前列腺癌的各阶段起到抗癌效果[4]。转移性前列腺癌是一种致死性疾病,需要接受长期ADT治疗,常见的有药物或手术去势。ADT治疗后会引起前列腺腺体退化并缩小前列腺癌体积,这是去势治疗的基本原理[4]。
在初始治疗中前列腺癌细胞对去势反应良好,但是几乎所有患者在治疗一段时间后无一例外地都对去势治疗出现抵抗,或称为CRPC[8]。过去我们曾把CRPC归为荷尔蒙不敏感或雄激素非依赖前列腺癌。然而,ADT治疗会引起肿瘤细胞的变异从而可在极低浓度雄激素条件下继续生长。这些变异包括AR基因的获得性高表达、AR基因突变、雄激素非依赖的AR激活、肿瘤细胞类固醇合成酶表达上调,及非腺体依赖下AR基因持续高表达[9]。
2 ADT药物的分类局限性前列腺癌的治疗,可以选择根治性前列腺切除术和(或)放射治疗(包括外放射或近距离放疗),增加或不增加ADT联合治疗[2]。尽管最初的疗效满意,但仍有超过三分之一的患者出现生化复发[10]。这些患者此时可以接受ADT治疗或进入主动监测阶段。当有证据表明出现肿瘤转移后,患者会接受ADT治疗和(或)多西他赛化疗,联合或不联合阿比特龙(Abiraterone, 一种新型内分泌药物)治疗,并同时保持去势状态[11]。去势状态的获得可以通过手术切除双侧睾丸或药物治疗(如促黄体生成素释放素LHRH激动剂或拮抗剂戈舍瑞林(Goserelin)、亮丙瑞林(Leuprolide)、地加瑞克(Degarelix)),联合或不联合AR拮抗剂(如比卡鲁胺(Bicalutamide)、氟他胺(Flutamide)、尼鲁米特(Nilutamide))[3]。
促黄体素释放激素(LHRH)激动剂包括戈舍瑞林和亮丙瑞林,两者在抑制睾酮产生上具有相同效果[12]。而LHRH抑制剂包括地加瑞克。上述药物均作用于人体性腺调节轴,由人工合成的LHRH激动剂或抑制剂降低促黄体生成素的释放从而导致下游的睾酮合成减少。而这些药物被认为与手术去势具有相同的疗效。尽管可以持续降低血清睾酮的浓度,但由肾上腺产生的雄激素却并不受影响。此外现在已经明确前列腺癌细胞自身就可以合成雄激素[9],因此需要其他类型的药物来进一步降低雄激素水平。非甾体类抗雄激素包括氟他胺、比卡鲁胺、尼鲁米特、恩杂鲁胺(Enzalutamide)和厄利达(Apalutamide)。这类药物可以直接结合AR从而阻断雄激素受体激活。阿比特龙是一类CYP17A1抑制剂,通过阻断非性腺组织的雄激素合成从而进一步降低血清睾酮水平[3]。5α还原酶抑制剂通过抑制睾酮转化为双氢睾酮DHT,而双氢睾酮DHT具有更强的AR亲和力,从而阻断AR激活,这类药物包括非那雄胺(Finasteride)和度他雄胺(Dutasteride)。
还有许多其他类型的AR靶向药物正在研发中,主要用来治疗高级别转移性CRPC。这些药物包括AR降解剂Galeterone以及雄激素受体N末端结构域抑制剂EPI-506,见表 1。Galeterone是一类新型AR降解剂,它通过抑制CYP17A1合成,竞争性抑制AR,阻断AR与DNA结合,以及同时增加野生型和突变型AR的降解来降低雄激素的产生[13]。然而,最近公布的GaleteroneⅢ期临床试验被叫停,原因是与恩杂鲁胺相比Galeterone并没有延长患者的生存期。另外一项AR降解剂是ASC-J9,能够同时降解野生型和F877L突变型AR,这种突变被认为与恩杂鲁胺耐药相关[14]。

|
综上,ADT通过诱导肿瘤细胞凋亡和程序性死亡从而缩小肿瘤体积。目前有多种方法可以降低雄激素水平,包括LHRH激动剂或抑制剂、CYP17A1抑制剂、5α还原酶抑制剂、AR拮抗剂、AR降解剂或联合应用多种药物。
3 ADT对免疫系统的影响当前大多数关于雄激素对免疫功能影响的探索几乎都来自于观察不同性别对免疫功能的反应[15]。例如,研究发现与男性相比,女性体内含有更多的IgM(一种免疫球蛋白)而且会产生更多的炎性因子如IL-1RA、C反应蛋白、GM-CSF以及IL-5[16]。动物实验发现与雄性小鼠相比,雌性小鼠或去势后的雄性小鼠体内的淋巴细胞对异体抗原的反应更加强烈。此外,女性患者自体免疫性疾病的患病概率显著高于男性[15]。接受雄激素替代疗法后,那些携带XXY性染色体的卡凡综合征患者体内的抗体合成显著降低,同时CD3+、CD4+T细胞的活性也显著降低[17]。由此不难看出,性激素如睾酮和雌激素对机体的免疫功能起到重要作用。
性激素对免疫系统具有重要影响。睾酮可以在5α还原酶的催化下变成DHT,或者被芳烃化变成雌激素,两者均具有免疫调节的作用。AR在胸腺上皮层和胸腺细胞都有表达,后者会分化为成熟T细胞,但是在胸腺上皮层表达的AR才是最终决定胸腺大小的因素。给予DHT会缩小胸腺体积并使之退化,相反地,去势后胸腺的体积和重量都会增加。
雄激素同样被认为对T细胞的功能具有负向调节作用。当体外培养的CD4+T细胞被给予睾酮或者DHT后,细胞分泌的免疫抑制因子IL-10的含量显著增加[18]。与调节性CD4+T细胞共培养会导致溶解性T细胞的活性明显下降,主要是因为后者CD25+Foxp3+的表达上调。而使用睾丸间质细胞的培养液或睾酮与CD4+T细胞共培养会导致CD25+ Foxp3+的表达增加,并使得调节性T细胞细胞因子IL-10的释放增加,而抗雄激素药物氟他胺可以阻碍IL-10的产生,上述结果表明CD4+CD25+Foxp3+ T细胞的功能高度依赖雄激素的刺激[19]。有趣的是,调节性CD4+T细胞数量的增加与PSA无复发生存率呈负相关,而与肿瘤细胞的级别和Ki67蛋白表达呈正相关[19]。总而言之,睾酮的免疫抑制作用与多种因素有关,包括胸腺退化和体积缩小、降低淋巴细胞的分化能力以及增加调节性CD4+T细胞的扩增和IL-10的表达。
动物实验证明,雄激素会抑制免疫系统的调节作用。雌性小鼠感染淋巴细胞水肿病毒(lymphacytic choriomeningitis virus, LCMV)并接受DHT治疗后其体内的LCMV T细胞和IFNγ的表达降低[20]。在一项诱导性自身免疫性疾病格氏病小鼠中,接受DHT处理的小鼠体内的胸腺激素表达显著降低,IL-2和IFNγ的表达也显著降低,说明DHT会抑制CD4+ Th1 T细胞的免疫活性[21]。
上述实验表明雄激素有免疫抑制作用,进一步说明去势治疗后雄激素水平的降低会增强机体的免疫功能。高龄小鼠行去势手术后其胸腺的体积增加,这与其胸腺细胞分化能力增强及凋亡减少有关。去势会导致机体外周T细胞绝对数量显著增加,同时也增强了机体对抗原特异性刺激反应的敏感度。接受环磷酰胺处理的小鼠体内淋巴细胞数量显著降低,而去势后其淋巴细胞升高的速度显著高于对照组[4]。对双侧睾丸切除后的小鼠给予DHT处理会导致LCMV T细胞和IFNγ的表达显著降低[20]。在临床研究中也有类似的发现,ADT会引起患者外周循环T细胞和Th-1表型T细胞的数量增加,而调节性CD4+T细胞的数量减少。
患者体内性激素水平的改变可以使睾酮芳烃化转变为雌激素,这同样也会改变患者的免疫功能[17]。研究发现人体CD8+T细胞表达雌激素受体,进一步的实验利用流式细胞仪和免疫荧光技术证明CD4+和CD8+T细胞表面均表达雌激素受体α和β[22]。在怀孕的女性患者体内的雌激素水平很高,与对照组相比她们体内的调节性CD4+T细胞数量显著增加[18]。相反地,雌激素分泌不足的女性患者体内CD8+T细胞的数量增加而调节性CD4+T细胞数量减少,说明雌激素在维持T细胞的内稳态中发挥重要作用。值得注意的是,在前列腺癌细胞系中加入雌激素会导致众多与T细胞识别相关基因的增加,包括β2微球蛋白和MHC分子簇。
有研究发现ADT会增加T细胞应答以及诱导巨噬细胞浸润前列腺[23]。多项研究表明ADT会增强免疫应答介导的T细胞杀伤作用,并促进前列腺癌细胞的AR过表达[4, 21]。此外,不断地涌现出新的研究发现ADT可以增强多种免疫治疗的效能[24],包括免疫检查点抑制剂和前列腺癌疫苗如Sipuleucel-T[25]和Prostvac[26]。
综上所述,性激素在调节免疫应答反应中扮演重要角色。与男性相比,女性体内性激素对免疫系统调节的双向作用与一系列免疫相关的抗体表达和T细胞活性的相关性更高。上述实验表明雄激素具有免疫抑制的作用。尽管去势可以增加T细胞数量,但是同时也会使得调节性CD4+T细胞数量增加。总而言之,接受AR拮抗剂治疗的前列腺癌患者体内的雌激素会显著升高,这与激素水平改变导致的睾酮芳烃化相关,同样会导致T细胞内稳态的改变而且会影响T细胞识别前列腺癌细胞。
4 ADT联合免疫疗法治疗前列腺癌的实验室和临床研究多项研究ADT联合免疫治疗疗效的实验正在开展。研究人员发现过继转染的前列腺特异性CD4+T细胞无法正常识别自身前列腺细胞。但是,当前列腺内出现肿瘤时,这些转染的CD4+T细胞开始分化,但是随后又被清除。当接受去势处理后这些细胞又开始分化并扩增。因此,他们认为前列腺癌的免疫治疗只有在去势水平下才能发挥最好的疗效[5]。另一项动物实验发现,在小鼠接受前列腺干细胞抗原(prostate stem cell antigen, PSCA)的DNA转染处理前后进行去势治疗,先转染再去势的小鼠体内的PSCA特异性T细胞数量要显著高于先去势再转染的小鼠[27]。
PTEN敲除前列腺癌小鼠模型中,当手术去势处理后小鼠体内的CD8+细胞毒T细胞和CD4+辅助T细胞出现瞬时升高并维持两周,五周后将达到对照组相同的水平[28]。此外,CD4+CD25+Foxp3+T细胞的数量在去势后2.5周时显著升高,随后在第10周时降至对照组水平。去除CD4+CD25+Foxp3+T细胞的同时将表达TNF受体超家族CD258激活的癌细胞注射到前列腺肿瘤内后,CD8+T细胞的细胞毒活性显著增强而且肿瘤体积明显缩小,这些均提示ADT联合原位免疫可以提高肿瘤细胞的免疫应答[28]。
Ardiani等[7]针对Twist抗原设计的疫苗联合ADT药物恩杂鲁胺开展了临床研究。Twist是一种螺旋形转录因子,与上皮间质转化过程相关,而且在转移性癌症中表达增高[29]。Twist的表达升高与肿瘤进展相关因此被认为是一种肿瘤抗原。在雄性小鼠接受ADT药物恩杂鲁胺处理后,其机体的T细胞功能没有发生改变,但是生殖系统体积和重量显著降低,而胸腺的重量显著增加。然而,联合使用Twist疫苗和恩杂鲁胺后小鼠体内CD4+T细胞的数量和分化能力显著增加,而且小鼠的总生存期增加[7, 29]。上述研究表明联合使用ADT与免疫疫苗可以提高抗癌效果。Adriani等[4]研究发现恩杂鲁胺和阿比特龙联合使用可以提高前列腺癌细胞系被细胞毒T细胞杀伤溶解的效率。
癌症的免疫治疗在2013年迎来了划时代的突破性进展,T细胞检查点抑制剂被正式批准用于多种癌症的治疗[6]。尽管单独使用这些免疫治疗的药物存在不足,2010年第一款用于治疗高级别转移性CRPC的免疫疫苗Sipuleucel-T仍获得FDA批准[5]。结合上文中我们提到的ADT对机体免疫调节的作用,联合使用这两种药物可能会提高他们的抗癌效果。尤其是目前招募的均为高级别转移性前列腺癌患者,他们大多数正在接受ADT治疗,而很少有研究探寻ADT与免疫治疗联合后的疗效变化。
目前唯一得到FDA批准用于前列腺癌治疗的免疫治疗药物Sipuleucel-T(sip-T)是一种自体细胞疫苗,将患者的外周血细胞富集后进行体外培养,其中抗原呈递细胞与PA2024共培育后激活,融合蛋白PAP抗原与GM-CSF进行融合培养。随后这些被激活的细胞被回输到患者体内,而被激活的抗原特异性T细胞开始扩增并定向杀伤肿瘤细胞[5]。在完成一项比较转移性CRPC患者生存期的Ⅲ期临床试验后,sip-T被批准用于临床应用[2]。与对照组相比,sip-T处理后的患者体内的抗原特异性T细胞分化能力和IFNγ的含量显著增加[30]。目前有两项研究比较了ADT联合sip-T治疗转移性CRPC的疗效,其中一项是先给予LHRH激动剂亮丙瑞林然后给予sip-T,或先给予sip-T治疗后,再给予亮丙瑞林治疗复发性前列腺癌。结果显示患者体内的PA2024特异性T细胞数量显著增加,但是组间比较差异无统计学意义。值得注意的是,T细胞的分化能力在先进行sip-T治疗后再进行ADT治疗组要比先进行ADT治疗后,再进行sip-T组高两倍[31]。该研究总结道ADT给予的时间先后不同可能会影响免疫治疗的疗效,推荐先给予sip-T治疗,再给予ADT治疗,见表 2。
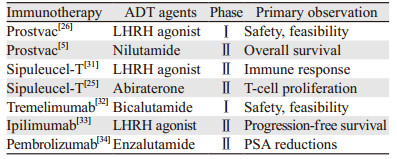
|
另外一项Ⅱ期临床研究比较了联合使用阿比特龙+泼尼松及sip-T或序贯使用sip-T和阿比特龙+泼尼松治疗转移性CRPC的疗效,并比较了两组患者中抗原呈递细胞的活性[25]。在69例患者中,联合使用或序贯使用两组患者的抗原呈递细胞活性,分化能力或记忆性T细胞激活相比较差异均无统计学意义。
Prostvac是一种治疗前列腺癌的免疫疫苗,目前正在进行Ⅲ期临床试验[26]。Prostvac-V/TRICOM是由一种表达PSA的转染病毒和三种共刺激分子B7.1、ICAM-1和LFA-3(TRICOM)组成。实验室结果显示在前列腺特异性PSA转染小鼠体内注入Prostvac并行去势手术能提高T细胞免疫应答的水平以及IFNγ的含量。另一项Ⅱ期临床研究比较了Prostvac与抗雄激素药物尼鲁米特的疗效。当出现PSA进展时,患者接受Prostvac和尼鲁米特联合治疗,结果提示单独使用Prostvac和尼鲁米特两组患者间的PSA下降率比较差异无统计学意义。在治疗后6.5年时接受Prostvac疫苗治疗的患者的总生存时间要高于尼鲁米特组(5.1年vs. 3.4年),但是差异无统计学意义[35]。
ADT对于非疫苗类免疫治疗药物的抗癌能力同样具有影响,比如免疫检查点抑制剂CTLA4单抗。目前已经有多个免疫检查点药物被批准用于临床治疗多种类型的癌症,比如Ipilimumab(CTLA4单抗)、Tremelimumab(CTLA4单抗)、Prembrolizumab(PD1单抗)和Nivolumamb(PD1单抗)。目前单用免疫检查点药物治疗转移性前列腺癌的临床研究均未得到阳性结果[33, 36-37]。一项Ⅱ期临床研究比较了联合使用Ipilimumab和ADT治疗复发性前列腺癌。112例患者在随访18月时均没有出现肿瘤进展的情况。而另外一项Ⅱ期临床试验评估Pembrolizumab和恩杂鲁胺治疗恩杂鲁胺耐药性转移性CRPC,20例患者中有4例出现PSA下降超过50%[34]。因此,联合使用ADT与免疫检查点药物可能会增加单独用药的抗癌效果。
5 结语ADT是目前治疗高级别前列腺癌的基石。由于ADT对免疫调节有重要作用,以及ADT会引起前列腺细胞的程序性死亡并诱导淋巴细胞浸润,ADT与免疫治疗联合使用是一项具有前景的探索,可能会为免疫治疗提供全新的思路。尽管目前已开展联合治疗效果的研究,但仍缺乏大量的证据来指导免疫治疗和ADT的联合治疗。我们期待未来有更多的临床和基础研究加入到相关研究中来,为探索前列腺癌的新治疗方法提供证据。
作者贡献
朱晖:论文撰写与修改
邓康俐:论文设计、数据分析和论文修改
| [1] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7–30. DOI:10.3322/caac.21442 |
| [2] | Mohler JL, Antonarakis ES, Armstrong AJ, et al. Prostate Cancer, Version 2.2019, NCCN Clinical Practice Guidelines in Oncology[J]. J Natl Compr Canc Netw, 2019, 17(5): 479–505. DOI:10.6004/jnccn.2019.0023 |
| [3] | Fizazi K, Tran N, Fein L, et al. Abiraterone plus Prednisone in Metastatic, Castration-Sensitive Prostate Cancer[J]. N Engl J Med, 2017, 377(4): 352–360. DOI:10.1056/NEJMoa1704174 |
| [4] | Ardiani A, Gameiro SR, Kwilas AR, et al. Androgen deprivation therapy sensitizes prostate cancer cells to T-cell killing through androgen receptor dependent modulation of the apoptotic pathway[J]. Oncotarget, 2014, 5(19): 9335–9348. |
| [5] | Kantoff PW, Higano CS, Shore ND, et al. Sipuleucel-T immunotherapy for castration-resistant prostate cancer[J]. N Engl J Med, 2010, 363(5): 411–422. DOI:10.1056/NEJMoa1001294 |
| [6] | Couzin-Frankel J. Breakthrough of the year 2013. Cancer immunotherapy[J]. Science, 2013, 342(6165): 1432–1433. DOI:10.1126/science.342.6165.1432 |
| [7] | Ardiani A, Farsaci B, Rogers CJ, et al. Combination therapy with a second-generation androgen receptor antagonist and a metastasis vaccine improves survival in a spontaneous prostate cancer model[J]. Clin Cancer Res, 2013, 19(22): 6205–6218. DOI:10.1158/1078-0432.CCR-13-1026 |
| [8] | Morse MD, McNeel DG. Prostate cancer patients on androgen deprivation therapy develop persistent changes in adaptive immune responses[J]. Hum Immunol, 2010, 71(5): 496–504. DOI:10.1016/j.humimm.2010.02.007 |
| [9] | Eisermann K, Wang D, Jing Y, et al. Androgen receptor gene mutation, rearrangement, polymorphism[J]. Transl Androl Urol, 2013, 2(3): 137–147. |
| [10] | Djavan B, Moul JW, Zlotta A, et al. PSA progression following radical prostatectomy and radiation therapy: new standards in the new Millennium[J]. Eur Urol, 2003, 43(1): 12–27. |
| [11] | Gravis G, Boher JM, Joly F, et al. Androgen Deprivation Therapy (ADT) Plus Docetaxel Versus ADT Alone in Metastatic Non castrate Prostate Cancer: Impact of Metastatic Burden and Long-term Survival Analysis of the Randomized Phase 3 GETUG-AFU15 Trial[J]. Eur Urol, 2016, 70(2): 256–262. |
| [12] | Dias Silva E, Ferreira U, Matheus W, et al. Goserelin versus leuprolide in the chemical castration of patients with prostate cancer[J]. Int Urol Nephrol, 2012, 44(4): 1039–1044. DOI:10.1007/s11255-012-0134-z |
| [13] | Njar VC, Brodie AM. Discovery and development of Galeterone (TOK-001 or VN/124-1) for the treatment of all stages of prostate cancer[J]. J Med Chem, 2015, 58(5): 2077–2087. DOI:10.1021/jm501239f |
| [14] | Yamashita S, Lai KP, Chuang KL, et al. ASC-J9 suppresses castration-resistant prostate cancer growth through degradation of full-length and splice variant androgen receptors[J]. Neoplasia, 2012, 14(1): 74–83. DOI:10.1593/neo.111436 |
| [15] | Whitacre CC. Sex differences in autoimmune disease[J]. Nat Immunol, 2001, 2(9): 777–780. DOI:10.1038/ni0901-777 |
| [16] | Furman D, Hejblum BP, Simon N, et al. Systems analysis of sex differences reveals an immunosuppressive role for testosterone in the response to influenza vaccination[J]. Proc Natl Acad Sci U S A, 2014, 111(2): 869–874. DOI:10.1073/pnas.1321060111 |
| [17] | Kocar IH, Yesilova Z, Ozata M, et al. The effect of testosterone replacement treatment on immunological features of patients with Klinefelter' s syndrome[J]. Clin Exp Immunol, 2000, 121(3): 448–452. DOI:10.1046/j.1365-2249.2000.01329.x |
| [18] | Fijak M, Schneider E, Klug J, et al. Testosterone replacement effectively inhibits the development of experimental autoimmune orchitis in rats: evidence for a direct role of testosterone on regulatory T cell expansion[J]. J Immunol, 2011, 186(9): 5162–5172. DOI:10.4049/jimmunol.1001958 |
| [19] | Walecki M, Eisel F, Klug J, et al. Androgen receptor modulates Foxp3 expression in CD4+CD25+Foxp3+ regulatory T-cells[J]. Mol Biol Cell, 2015, 26(15): 2845–2857. DOI:10.1091/mbc.E14-08-1323 |
| [20] | Lin AA, Wojciechowski SE, Hildeman DA. Androgens suppress antigen-specific T cell responses and IFN-gamma production during intracranial LCMV infection[J]. J Neuroimmunol, 2010, 226(1-2): 8–19. DOI:10.1016/j.jneuroim.2010.05.026 |
| [21] | Liu L, Wu L, Gao A, et al. The Influence of Dihydrotestosterone on the Development of Graves' Disease in Female BALB/c Mice[J]. Thyroid, 2016, 26(3): 449–457. DOI:10.1089/thy.2015.0620 |
| [22] | Pierdominici M, Maselli A, Colasanti T, et al. Estrogen receptor profiles in human peripheral blood lymphocytes[J]. Immunol Lett, 2010, 132(1-2): 79–85. DOI:10.1016/j.imlet.2010.06.003 |
| [23] | Escamilla J, Schokrpur S, Liu C, et al. CSF1 receptor targeting in prostate cancer reverses macrophage-mediated resistance to androgen blockade therapy[J]. Cancer Res, 2015, 75(6): 950–962. DOI:10.1158/0008-5472.CAN-14-0992 |
| [24] | Olson BM, Johnson LE, McNeel DG. The androgen receptor: a biologically relevant vaccine target for the treatment of prostate cancer[J]. Cancer Immunol Immunother, 2013, 62(3): 585–596. DOI:10.1007/s00262-012-1363-9 |
| [25] | Small EJ, Lance RS, Gardner TA, et al. A Randomized Phase Ⅱ Trial of Sipuleucel-T with Concurrent versus Sequential Abiraterone Acetate plus Prednisone in Metastatic Castration-Resistant Prostate Cancer[J]. Clin Cancer Res, 2015, 21(17): 3862–3869. DOI:10.1158/1078-0432.CCR-15-0079 |
| [26] | Gulley JL, Borre M, Vogelzang NJ, et al. Phase Ⅲ Trial of PROSTVAC in Asymptomatic or Minimally Symptomatic Metastatic Castration-Resistant Prostate Cancer[J]. J Clin Oncol, 2019, 37(13): 1051–1061. DOI:10.1200/JCO.18.02031 |
| [27] | Koh YT, Gray A, Higgins SA, et al. Androgen ablation augments prostate cancer vaccine immunogenicity only when applied after immunization[J]. Prostate, 2009, 69(6): 571–584. DOI:10.1002/pros.20906 |
| [28] | Akins EJ, Moore ML, Tang S, et al. In situ vaccination combined with androgen ablation and regulatory T-cell depletion reduces castration-resistant tumor burden in prostate-specific pten knockout mice[J]. Cancer Res, 2010, 70(9): 3473–3482. DOI:10.1158/0008-5472.CAN-09-2490 |
| [29] | Shiota M, Itsumi M, Takeuchi A, et al. Crosstalk between epithelial-mesenchymal transition and castration resistance mediated by Twist1/AR signaling in prostate cancer[J]. Endocr Relat Cancer, 2015, 22(6): 889–900. DOI:10.1530/ERC-15-0225 |
| [30] | Sheikh NA, Petrylak D, Kantoff PW, et al. Sipuleucel-T immune parameters correlate with survival: an analysis of the randomized phase 3 clinical trials in men with castration-resistant prostate cancer[J]. Cancer Immunol Immunother, 2013, 62(1): 137–147. DOI:10.1007/s00262-012-1317-2 |
| [31] | Antonarakis ES, Kibel AS, Yu EY, et al. Sequencing of Sipuleucel-T and Androgen Deprivation Therapy in Men with Hormone-Sensitive Biochemically Recurrent Prostate Cancer: A Phase Ⅱ Randomized Trial[J]. Clin Cancer Res, 2017, 23(10): 2451–2459. DOI:10.1158/1078-0432.CCR-16-1780 |
| [32] | McNeel DG, Smith HA, Eickhoff JC, et al. Phase Ⅰ trial of tremelimumab in combination with short-term androgen deprivation in patients with PSA-recurrent prostate cancer[J]. Cancer Immunol Immunother, 2012, 61(7): 1137–1147. DOI:10.1007/s00262-011-1193-1 |
| [33] | Kwon ED, Drake CG, Scher HI, et al. Ipilimumab versus placebo after radiotherapy in patients with metastatic castration-resistant prostate cancer that had progressed after docetaxel chemotherapy (CA184-043): a multicentre, randomised, double-blind, phase 3 trial[J]. Lancet Oncol, 2014, 15(7): 700–712. DOI:10.1016/S1470-2045(14)70189-5 |
| [34] | Graff JN, Alumkal JJ, Drake CG, et al. Early evidence of anti-PD-1 activity in enzalutamide-resistant prostate cancer[J]. Oncotarget, 2016, 7(33): 52810–52817. |
| [35] | Arredouani MS, Tseng-Rogenski SS, Hollenbeck BK, et al. Androgen ablation augments human HLA2.1-restricted T cell responses to PSA self-antigen in transgenic mice[J]. Prostate, 2010, 70(9): 1002–1011. |
| [36] | Beer TM, Kwon ED, Drake CG, et al. Randomized, Double-Blind, Phase Ⅲ Trial of Ipilimumab Versus Placebo in Asymptomatic or Minimally Symptomatic Patients With Metastatic Chemotherapy-Naive Castration-Resistant Prostate Cancer[J]. J Clin Oncol, 2017, 35(1): 40–47. DOI:10.1200/JCO.2016.69.1584 |
| [37] | Topalian SL, Hodi FS, Brahmer JR, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer[J]. N Engl J Med, 2012, 366(26): 2443–2454. DOI:10.1056/NEJMoa1200690 |
 2019, Vol. 46
2019, Vol. 46


