文章信息
- 18F-FDG PET/CT代谢参数与结直肠癌临床病理特征的关系
- Relation Between Metabolic Parameters of 18F-FDG PET/CT and Clinicopathological Features of Colorectal Cancer Patients
- 肿瘤防治研究, 2019, 46(11): 1006-1012
- Cancer Research on Prevention and Treatment, 2019, 46(11): 1006-1012
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0665
- 收稿日期: 2019-05-21
- 修回日期: 2019-08-14
2. 100142 北京,北京大学肿瘤医院暨北京市肿瘤防治研究所病理科;
3. 310021 杭州,浙江省肿瘤医院核医学科
2. Department of Pathology, Peking University Cancer Hospital & Institute, Beijing 100142, China;
3. Department of Nuclear Medicine, Zhejiang Cancer Hospital, Hangzhou 310021, China
在我国,结直肠癌(colorectal cancer, CRC)的发病率以每年2.4%速度递增[1],已成为第三位恶性肿瘤,死亡率也上升至第五位[2]。早期诊断复发、转移,全面评估全身肿瘤负荷情况,对尽早制定个性化治疗方案、改善预后非常重要。以18F标记氟代脱氧葡萄糖(18F-fluoro-2-deoxy-D-glucose, 18F-FDG)为示踪剂的正电子发射断层/计算机断层扫描技术(positron emission tomography/computed tomography, PET/CT)能够同时提供恶性肿瘤的代谢活性及解剖位置双重信息,已用于肿瘤的分期、再分期、疗效判定及预后评价。最近研究显示,肿瘤葡萄糖代谢参数与组织病理特征及TNM分期有一定相关性,有望成为影像生物标志物,指导个体化诊疗[3]。本研究回顾性分析358例初诊CRC患者18F-FDG PET/CT图像,旨在讨论CRC原发灶代谢参数与肿瘤位置、TNM分期及患者病理特征的关系,明确CRC异质性及葡萄糖定量显像的评估价值。
1 资料与方法 1.1 资料回顾性分析2010年1月至2017年12月在北京大学肿瘤医院核医学科行18F-FDG PET/CT检查的6 234例结直肠癌患者。纳入标准:(1)病理证实为结直肠癌患者;(2)行18F-FDG PET/CT检查前未经任何治疗;(3)18F-FDG PET/CT有可测量阳性病灶;(4)有完整的临床及病理资料。排除标准:(1)既往有其他恶性肿瘤病史;(2)伴有活动性或可疑活动性的或慢性不可控制的炎性反应或感染;(3)伴有心脏、肝脏或肾脏功能障碍;(4)伴有不可控的糖尿病;(5)妊娠或哺乳期妇女。符合入排标准的结直肠患者共358例。
1.2 病理特征依据2010版WHO结直肠癌组织学分级标准,将CRC分为普通型腺癌(低分化、中分化及高分化)及黏液腺癌。结直肠癌TNM分期按第8版美国癌症联合委员会(American Joint committee on Cancer, AJCC)/国际抗癌联盟(Union for International Cancer Control, UICC)标准进行。应用免疫组织化学染色法检测未经任何治疗的CRC病理标本的Ki-67指数(Ki-67试剂盒,克隆MIB-1,美国DAKO),< 75%肿瘤细胞染色为Ki-67低表达,≥75%肿瘤细胞染色为Ki-67高表达。
1.3 18F-FDG PET/CT图像采集患者检查前准备和18F-FDG PET/CT检查依据最新EANM指南[4]。患者检查前一天停用肠外营养支持及含有葡萄糖静脉注射液,禁食6~8 h,血糖≤8.3 mmol/L。静脉注射18F-FDG 3.7 MBq/kg,避光静卧(60±10)min,排尿后行常规PET/CT扫描(PHILIPS GEMINI TF)。扫描范围为颅顶至股骨上段。扫描参数为躯干1分钟/床位。头单独三维采集,8~10分钟/床位。同机CT参数为120 kV,100 mAs,扫描厚度3 mm。应用CT数据进行衰减校正,迭代法重建,获全身PET、CT及PET/CT融合图像,PHILIPS工作站显示。如果诊断需要,在静脉注射18F-FDG后120 min行局部延迟显像。
1.4 图像判读由两位核医学科医师在PHILIPS工作站独立判读CT、PET及PET/CT融合图像。应用感兴趣区(region of interest, ROI)技术,3D方式测量CRC原发灶的最大标准摄取值(maximum standardized uptake value, SUVmax)、平均标准摄取值(mean standardized uptake value, SUVmean)及肿瘤代谢体积(metabolic tumor volume, MTV)。采用SUVmax的40%阈值法,将CRC原发灶包括感兴趣体积(volume of interest, VOI)内。SUVmax及病灶糖酵解总量(total lesion glycolysis, TLG)计算公式如下:SUVmax =(衰减校正活性/组织体积)/(注射剂量/体重),TLG = SUVmean×MTV。
1.5 统计学方法采用SPSS22.0软件对数据进行统计分析。所有计量资料使用中位数(最小值——最大值)表示。使用Mann-Whitney U检验和Kruskal-Wallis检验比较不同原发灶位置、分期、病理类型及分化程度的SUVmax、SUVmean、MTV和TLG间差异。所有检验均为双侧检验,P < 0.05为差异有统计学意义。
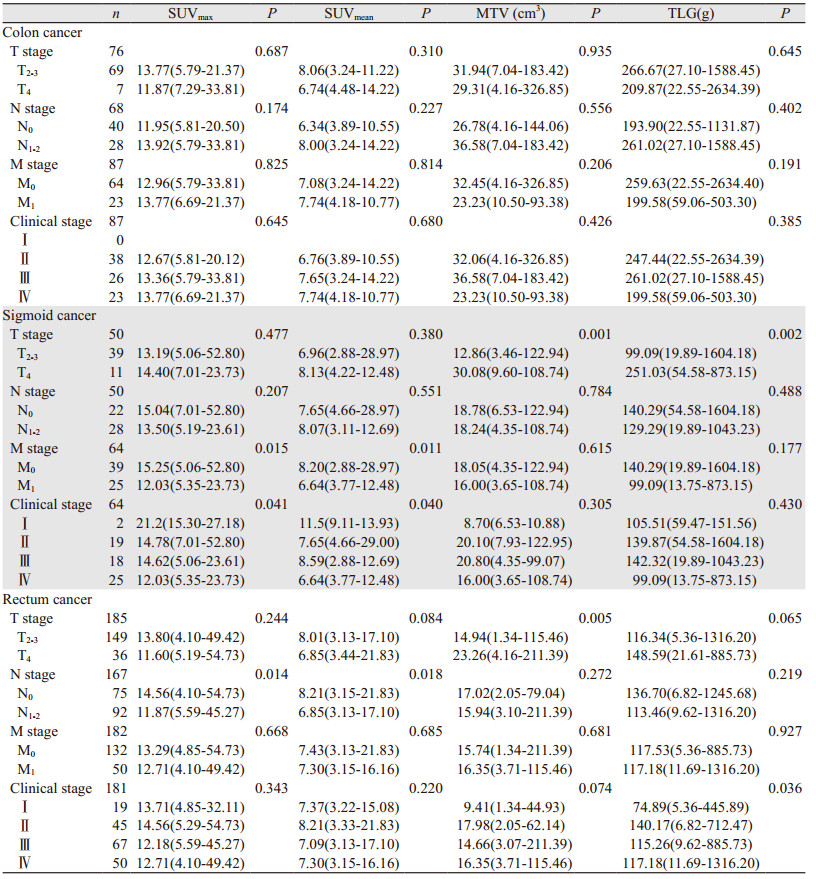
2 结果 2.1 临床病理数据358例结直肠癌患者中,男216例(60%)、女142例(40%),平均年龄为59.07(18~87)岁。结肠癌98例(27%),乙状结肠癌68例(19%),直肠癌192例(54%),见表 1。因病理数据资料时间较久,部分病例数未达358例,但不影响统计结果。

|
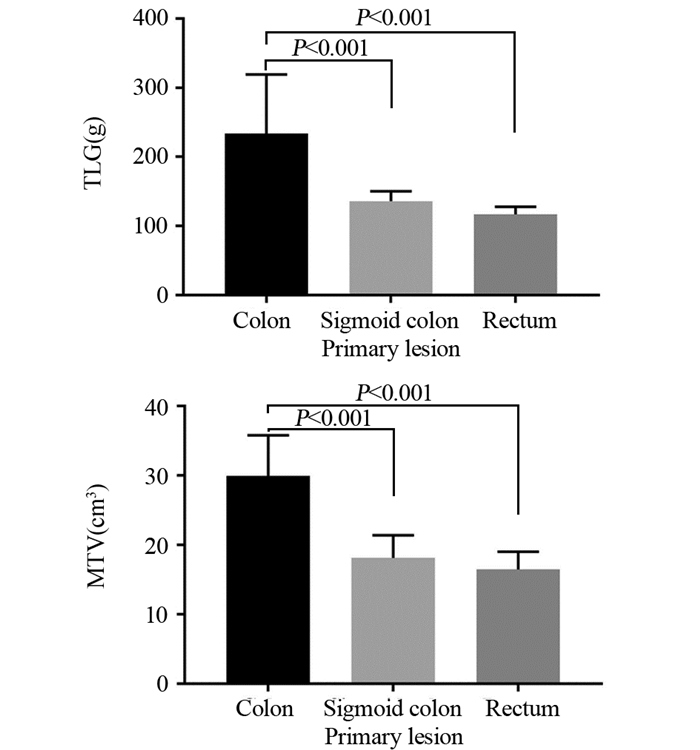
结肠癌原发灶的MTV及TLG值最高,分别为29.95(4.16~554.30)cm3和233.88(14.35~3586.35)g;乙状结肠癌次之[MTV: 18.18(2.75~122.94)cm3;TLG: 135.69(10.90~1604.18)g];直肠癌最低[MTV: 16.45(1.34~211.39)cm3;TLG: 117.45(5.36~1316.20)g],组间差异均有统计学意义(P < 0.001),见图 1。右半结肠MTV及TLG值较左半结肠高,差异有统计学意义(P < 0.001),见图 2。原发灶的SUVmax及SUVmean值与肿瘤位置无关(P=0.834; P=0.633)。
|
| MTV: metabolic tumor volume; TL6: total lesion glylolysis 图 1 结肠癌、乙状结肠癌及直肠癌原发灶的肿瘤负荷常数 Figure 1 Tumor load constant of primary lesions of colon cancer, sigmoid cancer and rectal cancer |

|
| 图 2 左右半结肠原发灶的肿瘤负荷常数 Figure 2 Tumor load constant of primary lesions of left and right hemicolon |
结直肠黏液腺癌原发灶MTV值为38.69(4.16~211.39)cm3,高于普通型腺癌的MTV[18.62(1.34~326.85)cm3],差异有统计学意义(P=0.023);两组间原发灶SUVmax、SUVmean及TLG值差异均无统计学意义(P=0.180、0.072、0.189)。
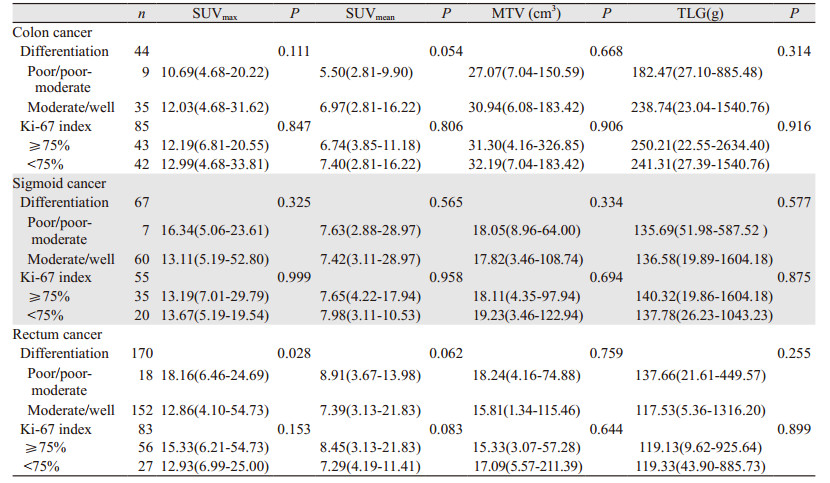
原发灶SUVmax、SUVmean、MTV和TLG值不能预测CRC的分化程度,相应数值差异均无统计学意义(P > 0.05),但直肠低/中低分化腺癌原发灶SUVmax值为18.16(6.46~24.69),高于中/高分化腺癌SUVmax[12.86(4.10~54.73)],差异有统计学意义(P=0.028),见表 2、图 3。在左半结肠及右半结肠中原发灶代谢参数与分化程度均无关(P > 0.05)。
|

|
| A: male, 52-year-old, 18F-FDG PET/CT showed thickening and high FDG uptake of the middle and lower rectum intestinal wall, with the thickness of 1.8cm, SUVmax of 23.76, and an involvement length of 4.7cm, poorly-differentiated adenocarcinoma; B: male, 72-year-old, 18F-FDG PET/CT showed thickening and high uptake of middle and lower rectum intestinal wall, with a thickness of 2.3cm, SUVmax of 13.71, and an up-down length of 7-8cm, well-differentiated adenocarcinoma 图 3 直肠癌分化程度与SUVmax值的关系 Figure 3 Relation between differentiation and SUVmax of rectal cancer |
CRC原发灶的SUVmax、SUVmean、MTV和TLG值均不能反映Ki-67指数表达状态(P > 0.05)。
2.4 TNM分期与原发灶代谢参数结直肠癌T4期病灶MTV及TLG值分别为26.85(4.16~326.85)cm3及187.53(21.61~2634.39)g,均高于T2及T3期病灶(P=0.0001, P=0.007)。原发灶SUVmax及SUVmean值不能评估肿瘤T分期(P > 0.05)。乙状结肠癌T4期原发灶MTV及TLG值大于T2-3期原发灶,差异有统计学意义(P=0.001, P=0.002);直肠癌T4期原发灶的MTV值大于T2-3期原发灶数值,差异有统计学意义(P=0.005)。在结肠癌中,原发灶的MTV及TLG值不能评估病灶T分期(P > 0.05)。
CRC原发灶SUVmax、SUVmean、MTV及TLG值不能预测局部淋巴结状态,差异无统计学意义(P > 0.05)。
在有远处转移的CRC患者中,原发灶SUVmax、SUVmean、MTV及TLG值亦不能预测远处转移状态,差异无统计学意义(P > 0.05)。然而,有远处转移的乙状结肠癌原发灶SUVmax值及SUVmean值低于无远处转移者,差异有统计学意义(P=0.015, P=0.011)。不同M分期直肠癌及结肠癌原发灶的代谢常数差异均无统计学意义(P > 0.05)。
不同临床分期CRC原发灶MTV及TLG值差异有统计学意义(P=0.003, P=0.004),SUVmax及SUVmean值差异无统计学意义(P > 0.05)。直肠癌中Ⅰ期CRC原发灶MTV及TLG分别为9.41(1.34~44.93)cm3及74.89(5.36~445.89)g,明显低于其他组数值[Ⅱ期病灶MTV及TLG分别为20.00(2.05~326.85)cm3及155.94(6.82~2634.40)g,Ⅲ期为19.01(3.07~211.39)cm3及126.49(9.62~1588.45)g,Ⅳ期分别为18.24(3.65~115.46)cm3及122.52(11.69~1316.20)g],见表 3。
18F-FDG PET/CT为临床常用的功能影像学检查方法,反映了组织器官的葡萄糖代谢情况,广泛应用于恶性肿瘤的诊疗中。18F-FDG PET/CT常用半定量参数主要有SUVmax与SUVmean等。由于SUV值反映的是肿瘤组织某一部分的代谢活跃程度,故对于不均质病灶判断准确性较差[5]。近年来,代表肿瘤负荷的MTV及TLG成为研究热点。MTV反映了异常代谢的肿瘤细胞数量,TLG则既能反映肿瘤代谢活性又能反映肿瘤代谢体积[6]。在部分实体瘤中,原发灶葡萄糖代谢参数能反映肿瘤的临床病理特征[7-8]。然而,CRC原发灶代谢参数是否与肿瘤临床病理特征相关,尚存在一定争议。Uchiyama等[9]研究表明CRC原发灶的SUVmax仅与肿瘤大小有关,而与原发灶的组织学分级、有无癌栓、淋巴结转移、肝转移等均无关。王晓燕等[10]回顾性分析发现,CRC原发灶SUVmax与肿瘤大小、部位、分化程度及TNM分期相关。因此,本研究探索了原发灶的代谢参数与肿瘤位置、临床病理特征及TNM分期的关系。
从胚胎学上说,结肠起源于中肠与后肠,而直肠起源于泄殖腔,二者血供及生物学行为均不同。因此,结肠及直肠表现出不同的临床病理特征及预后,使二者治疗手段和预后转归不同。本研究结果发现结肠癌、乙状结肠癌及直肠癌存在以下生物学特性:(1)结肠癌原发灶MTV及TLG值高于直肠癌及乙状结肠癌,这可能由于结肠管腔较大,肠壁薄易扩张,而盆腔内空间有限所造成[11];(2)直肠中低/低分化腺癌原发灶SUVmax值高于中/高分化腺癌(P < 0.05),而结肠癌原发灶代谢参数与分化程度比较差异无统计学意义(P > 0.05);(3)乙状结肠癌及直肠癌原发灶代谢负荷常数与T分期相关,乙状结肠癌原发灶SUV值与M分期相关;(4)少见类型黏液腺癌在直肠发病率相对最高(67%)、结肠次之(22%)、乙状结肠黏液腺癌发生率最低(11%)。上述结果显示了不同部位CRC具有不同临床病理特征,即异质性,因此在临床中应该有针对性地对CRC患者进行个体化治疗。
CRC患者治疗前分期是影响治疗决策和预后的关键因素,因此治疗前精确分期至关重要。本研究旨在通过原发灶代谢参数,预测肿瘤TNM分期及临床分期。结果显示,CRC原发灶代谢负荷常数能预测T分期,T4期CRC原发灶MTV及TLG值高于T2及T3期原发灶(P < 0.05),与既往的研究结果[10, 12]类似;CRC原发灶代谢参数与N分期无关,在M分期中,发生转移的乙状结肠癌原发灶SUV值较无远处转移者低,故乙状结肠癌原发灶SUV值高并不意味着易发生远处转移。该结果与Lee等研究结果相近,即原发灶SUVmax越高时,患者的预后反而越好[13]。
Ki-67是一种与核糖体RNA转录有关的核蛋白,可作为细胞增殖的标志物用以提示细胞的增殖活跃程度。尽管在许多实体瘤中,SUVmax与Ki-67指数存在相关性,但CRC原发灶代谢常数能否预测Ki-67指数尚不明确[14]。Güreşci等研究显示31例CRC患者原发灶的SUVmax值与其Ki-67指数呈正相关[15]。但本研究结果显示原发灶代谢参数不能预测Ki-67表达状态,各组间差异均无统计学意义。
本研究亦探索了黏液腺癌相关病理特性。结直肠黏液腺癌是较为少见的病理类型,约占结直肠癌的5%~15%,黏液腺癌恶性程度高、预后较差[16-17],黏液腺癌占所有CRC的5%,与文献报道相似[10, 12]。研究发现,黏液腺癌原发灶MTV值较普通腺癌大,可能由于黏液腺癌大量黏液存在于上皮组织癌细胞内,导致肿瘤体积较大。原发灶SUVmax值与普通腺癌差异无统计学意义,可能是由于样本量过小或肿瘤异质性造成。另有研究[18]显示SUVmax值高低不是影响化疗效果的独立因素。
综上所述,CRC原发灶代谢参数与原发位置、病理特征及TNM分期具有部分相关性,18F-FDG PET/CT可在一定程度上反映肿瘤的生物学特征及异质性,进而为个体化治疗提供信息。本研究结果相对客观,但为单中心回顾性研究,还需要多中心的前瞻性研究加以验证。
作者贡献
宋金龄:数据收集、统计及文章撰写
李忠武:病理及免疫组织化学诊断
卫毛毛:数据收集
周妮娜:数据统计
杨志:PET/CT扫描质控及数据校对
王雪鹃:数据校对及文章修改
| [1] |
Schinagl DA, Vogel WV, Hoffmann AL, et al. Comparison of five segmentation tools for 18F-fluoro-deoxy-glucose-positron emission tomography-based target volume definition in head and neck cancer[J]. Int J Radiat Oncol Biol Phys, 2007, 69(4): 1282-1289. DOI:10.1016/j.ijrobp.2007.07.2333 |
| [2] |
Haraldsdottir S, Einarsdottir HM, Smaradottir A, et al. Colorectal cancer-review[J]. Laeknabladid, 2014, 100(2): 75-82. |
| [3] |
田蓉蓉, 薄云峰, 张毅勋, 等. 18F-FDG PET/CT显像与结直肠癌治疗前分期的相关性研究[J]. 国际放射医学核医学杂志, 2018, 42(1): 9-14. [Tian RR, Bo YF, Zhang YX, et al. Correlation between 18F-FDG PET/CT and pretreatment staging of colorectal cancer[J]. Guo Ji Fang She Yi Xue He Yi Xue Za Zhi, 2018, 42(1): 9-14. DOI:10.3760/cma.j.issn.1673-4114.2018.01.002] |
| [4] |
Boellaard R, Delgado-Bolton R, Oyen WJ, et al. FDG PET/CT: EANM procedure guidelines for tumour imaging: version 2.0[J]. Eur J Nucl Med Mol Imaging, 2015, 42(2): 328-354. DOI:10.1007/s00259-014-2961-x |
| [5] |
Lucignani G. SUV and segmentation: pressing challenges in tumour assessment and treatment[J]. Eur J Nucl Med Mol Imaging, 2009, 36(4): 715-720. DOI:10.1007/s00259-009-1085-1 |
| [6] |
Hatt M, Visvikis D, Albarghach NM, et al. Prognostic value of 18F-FDG PET image-based parameters in oesophageal cancer and impact of tumour delineation methodology[J]. Eur J Nucl Med Mol Imaging, 2011, 38(7): 1191-1202. DOI:10.1007/s00259-011-1755-7 |
| [7] |
李艳, 马红霞, 王瑞峰, 等. 18F-FDG PET/CT的SUV值与肺癌患者的临床特征、病理类型及肿瘤标记物的关系研究[J]. 中华临床医师杂志(电子版), 2012, 6(21): 6881-6884. [Li Y, Ma HX, Wang RF, et al. Relationship between SUV value of 18F-FDG PET/CT and clinical characteristics, pathological types and tumor markers of lung cancer patients[J]. Zhonghua Lin Chuang Yi Shi Za Zhi (Dian Zi Ban), 2012, 6(21): 6881-6884. DOI:10.3877/cma.j.issn.1674-0785.2012.21.058] |
| [8] |
Chang Y, Fu X, Sun Z, et al. Utility of baseline, interim and end-of-treatment (18)F-FDG PET/CT in extranodal natural killer/T-cell lymphoma patients treated with L-asparaginase/pegaspargase[J]. Sci Rep, 2017, 7: 41057. DOI:10.1038/srep41057 |
| [9] |
Uchiyama S, Haruyama Y, Asada T, et al. Role of the standardized uptake value of 18-fluorodeoxyglucose positron emission tomography-computed tomography in detecting the primary tumor and lymph node metastasis in colorectal cancers[J]. Surg Today, 2012, 42(10): 956-961. DOI:10.1007/s00595-012-0225-6 |
| [10] |
王晓燕, 彭贵娟, 张祥松, 等. 基于18氟-脱氧葡萄糖正电子发射计算机断层成像术的最大标准化摄取值和放射线基线比值与结直肠癌术后预后的关系[J]. 中华胃肠外科杂志, 2015, 18(3): 232-237. [Wang XY, Peng GJ, Zhang XS, et al. Correlation of 18F-FDG PET-CT maximum standard uptake value and T/N ratio with the prognosis of postoperative colorectal cancer[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2015, 18(3): 232-237. DOI:10.3760/cma.j.issn.1671-0274.2015.03.008] |
| [11] |
李院江, 罗林海. 左、右半结肠癌患者临床病理特点及预后差异分析[J]. 中外医疗, 2018, 37(24): 20-22. [Li YJ, Luo LH. Clinical and Pathological Features and Prognosis of Patients with Left and Right Colon Cancer[J]. Zhong Wai Yi Liao, 2018, 37(24): 20-22.] |
| [12] |
Chen SW, Chen WT, Wu YC, et al. Which FDG/PET parameters of the primary tumors in colon or sigmoid cancer provide the best correlation with the pathological findings?[J]. Eur J Radiol, 2013, 82(9): e405-e410. DOI:10.1016/j.ejrad.2013.04.022 |
| [13] |
Lee HS, Kim HO, Hong YS, et al. Prognostic value of metabolic parameters in patients with synchronous colorectal cancer liver metastasis following curative-intent colorectal and hepatic surgery[J]. J Nucl Med, 2014, 55(4): 582-589. DOI:10.2967/jnumed.113.128629 |
| [14] |
Wang L, Liu Z, Fisher KW, et al. Prognostic value of programmed death ligand 1, p53, and Ki-67 in patients with advanced-stage colorectal cancer[J]. Hum Pathol, 2018, 71: 20-29. DOI:10.1016/j.humpath.2017.07.014 |
| [15] |
Güreşci S, Özmen Ö, Uzman M, et al. Correlation of Ki-67 proliferation index and 18-fluorodeoxyglucose uptake in colorectal incidental lesions detected by positron emission tomography-computed tomography[J]. Turk J Med Sci, 2016, 46(4): 1182-1187. |
| [16] |
Sugarbaker PH. Mucinous colorectal carcinoma[J]. J Surg Oncol, 2001, 77(4): 282-283. DOI:10.1002/jso.1111 |
| [17] |
Gonzalez RS, Cates JMM, Washington K. Associations among histological characteristics and patient outcomes in colorectal carcinoma with a mucinous component[J]. Histopathology, 2019, 74(3): 406-414. DOI:10.1111/his.13748 |
| [18] |
杨明, 冯彦林, 冼伟均, 等. 应用18F-FDG PET/CT评估不同CD5表达的弥漫大B细胞淋巴瘤化疗疗效及价值[J]. 肿瘤防治研究, 2019, 46(10): 926-931. [Yang M, Feng YL, Xian WJ, et al. Value of 18F-FDG PET/CT in evaluating chemotherapeutic effect of diffuse large B cell lymphoma patients with different CD5 expression[J]. Zhong Liu Fang Zhi Yan Jiu, 2019, 46(10): 926-931. DOI:10.3971/j.issn.1000-8578.2019.19.0444] |
 2019, Vol. 46
2019, Vol. 46