文章信息
- 早期骨转移分子机制的研究进展
- Advances in Molecular Mechanisms of Early Bone Metastasis
- 肿瘤防治研究, 2019, 46(9): 856-860
- Cancer Research on Prevention and Treatment, 2019, 46(9): 856-860
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0634
- 收稿日期: 2019-05-14
- 修回日期: 2019-07-05
2. 100029 北京,北京中医药大学研究生院
2. Graduate School, Beijing University of Chinese Medicine, Beijing 100029, China
骨转移是恶性肿瘤的常见并发症,65%~75%的前列腺癌和乳腺癌患者以及30%~40%的肺癌患者均会发生骨转移[1]。骨转移常常伴有疼痛、高钙血症、病理性骨折、脊髓压迫等骨相关事件,严重影响患者生活质量。目前抗骨转移治疗仅能延缓骨转移进展,尚缺乏根治性措施,研究骨转移骨微环境的变化及分子机制倍受重视。在溶骨性骨转移早期阶段,骨微环境(“土壤”)和转移性肿瘤细胞(“种子”)的相互作用是发生骨转移的重要原因,肿瘤细胞、成骨细胞和破骨细胞之间的相互调控促进肿瘤细胞的定植、存活和增殖,加速骨转移进程[2-3]。本文对近年早期骨转移分子机制的研究进展作一综述。
1 肿瘤细胞在骨微环境中的定植和存活在骨转移早期阶段,肿瘤细胞作为“种子”离开原发病灶后只有极少部分能够定植并存活于骨骼。肿瘤细胞转移至骨骼主要依赖于自身内在的生物学特性和与骨微环境的相互作用。肿瘤细胞在肿瘤类型、细胞骨拟态和细胞因子表达等方面的生物特性使部分肿瘤具有骨转移倾向,而骨微环境的免疫抑制、缺氧等特点诱导肿瘤细胞定植、存活于骨骼。
1.1 骨转移倾向肿瘤细胞的生物学特性不同类型肿瘤骨转移倾向不同,同种肿瘤不同亚型亦表现出不同程度的骨转移倾向,对295 213例新诊断浸润性乳腺癌患者进行分析,结果发现乳腺癌患者在诊断时出现骨、肺、肝和脑转移的概率分别为3.28%、1.52%、1.20%和0.35%,转移部位和乳腺癌不同亚型具有显著关系。激素受体阳性(HR+)患者出现骨转移风险明显升高,而三阴性乳腺癌患者脑、肺和肝转移风险较高,骨转移率显著低于HR+乳腺癌患者,说明骨转移的分子机制在同种恶性肿瘤中亦存在较大差异[4]。乳腺癌细胞、肺癌细胞等高表达钙敏感受体(Calcium-sensing receptor, CaSR)和趋化因子受体4(C-X-C chemokine receptor type 4, CXCR-4),与骨分泌的Ca2+、趋化因子CXC基序配体12(C-X-C motif chemokine 12, CXCL12)等因子相结合,促进癌细胞趋化、定植于骨组织。CaSR属于G蛋白偶联受体第三超家族,高表达于肾癌、前列腺癌和乳腺癌,通过识别细胞外的Ca2+,促进肿瘤细胞迁移至Ca2+浓度高的骨组织局部,在肾癌切除术后5年内发生骨转移患者的癌组织中CaSR的表达水平是无骨转移患者的7.9倍; 此外,体外研究表明细胞外Ca2+与肿瘤细胞表达的CaSR结合后,激活AKT和MAPK信号转导通路,从而促进肿瘤细胞迁移和增殖; 运用CaSR拮抗剂干预肾癌小鼠后,骨转移的发生率明显降低[5]。CXCR4在乳腺癌、卵巢癌、前列腺癌等20余种肿瘤中高表达,通过与骨微环境分泌的CXCL12结合激活细胞内多条信号通路促进肿瘤细胞活化、侵袭和迁移,如PI3K、MAPK和ERK1/2[6]。此外,研究发现肿瘤细胞迁移至骨微环境后多具有骨拟态的特性,骨微环境中的肿瘤细胞如乳腺癌细胞、前列腺癌细胞均高表达Runt相关转录因子2(Runt-related transcription factor 2, Runx2),高表达的Runx2可诱导骨唾液蛋白、骨桥蛋白、骨保护素等的分泌,使肿瘤细胞获得成骨细胞样表型,并利于其存活[7]。Tan等[8]通过实验探究骨转移中乳腺癌细胞转化为成骨细胞样细胞的方式,首先用含有肿瘤相关成纤维细胞的培养基对乳腺癌细胞实现上皮-间充质的转换,随后用骨形态发生蛋白2(bone morphogenetic protein, BMP2)诱导乳腺癌细胞获得成骨细胞样表型; 与未经处理的乳腺癌细胞相比,经处理的乳腺癌细胞高表达Runx2、骨粘连蛋白等,说明乳腺癌细胞上皮-间充质转换后通过BMP2/Runx2信号通路获得骨拟态特征,其中Runx2是骨拟态的主要介质。
1.2 骨微环境的特异性 1.2.1 骨微环境的免疫特性骨骼对人体免疫系统具有重要调节作用,骨微环境中存在多种免疫相关性细胞(T细胞、树突状细胞、中性粒细胞等),但乳腺癌、肺癌等恶性肿瘤骨微环境中的免疫相关性细胞具有免疫抑制作用,促进肿瘤细胞骨转移[9]。研究发现通过CXCR4/CXCL12信号通路诱导调节性T细胞(Regulatory cells, Tregs)富集到骨微环境中,而Treg细胞具有明显的免疫抑制作用[10]。辅助性T细胞17(T helper cell 17, Th17)是重要的T细胞亚群成员之一,肿瘤特异性Th17可产生核因子κB受体活化因子配体(receptor activator of NF-κB ligand, RANK-L)促进破骨细胞的活化并加速溶骨性骨转移的发生,在动物实验中用Th17细胞表达的RANKL干预乳腺癌小鼠模型,发现RANKL能够促进肿瘤细胞定植于骨骼[11]。树突状细胞具有抗原呈递能力,在细胞毒性T细胞免疫激活的调节中起关键作用,Sawant等[12]发现乳腺癌小鼠模型骨髓中浆细胞样树突状细胞(Plasmacytoid dendritic cells, pDC)数量的增加可促进Th2、IL-4的分泌,运用pDC拮抗剂干预小鼠后可显著减少肺和骨转移的发生率; 此外,pDC能募集Tregs、髓源性抑制细胞(Myeloid derived suppressor cells, MDSCs)等免疫抑制性细胞。在动物模型中骨微环境MDSCs的富集导致乳腺癌骨转移的发生,并促进破骨细胞分化和骨质溶解,有趣的是只有从骨转移骨微环境中分离出的MDSC才能促进功能性破骨细胞的成熟[13]。中性粒细胞是先天免疫系统的重要组成部分,其中N2型中性粒细胞具有促肿瘤作用,N2型中性粒细胞能够释放CXCR4、血管内皮生长因子(Vascular endothelial growth factor, VEGF)和基质金属蛋白酶9促进肿瘤进展[14]。
1.2.2 间充质基质细胞促进骨转移骨髓作为恶性肿瘤转移的靶器官,骨髓中的间充质基质细胞在骨转移生态位形成中起重要作用。间充质基质细胞包括脂肪细胞、成纤维细胞等,可以与播散的肿瘤细胞相互作用,诱导肿瘤细胞进入骨髓空间,促进肿瘤细胞跨骨髓内皮的迁移[15]。骨髓脂肪细胞在骨髓腔中最为丰富,约占成人骨髓体积的70%,最近研究发现骨髓脂肪细胞分泌的游离脂肪酸能为肿瘤细胞提供能量,从而促进肿瘤细胞在骨微环境的存活; 此外,骨髓脂肪细胞通过分泌瘦蛋白、脂联素以及IL-6等因子促进肿瘤细胞的增殖和骨转移的进展[16]。甲状旁腺激素可用于抑制骨髓脂肪细胞的形成,Swami等[17]研究表明间歇性给予甲状旁腺激素可显著降低乳腺癌小鼠模型后肢自发性骨转移发生率并增加骨量。当肿瘤细胞定植于骨微环境后,亦能够诱导肿瘤细胞周围的成纤维细胞转化为肿瘤相关性成纤维细胞,肿瘤相关性成纤维细胞增加细胞外基质的产生,分泌促进肿瘤生长的细胞因子(CXCL12、TGF-β),并能够促进乳酸和酮体等代谢产物的产生从而重塑骨微环境[18]。
1.2.3 骨微环境缺氧和酸中毒促进骨转移骨骼微环境非常缺氧,研究人员检测小鼠颅骨氧分压(Pressure of oxygen, pO2)发现,骨髓中的绝对pO2 < 32 mmHg,明显低于其他组织或器官; 此外,pO2随着从骨内膜到骨髓距离的增加而减小,在较深的骨窦周区域pO2最低(9.9 mmHg),骨髓缺氧能够诱导低氧诱导因子1(Hypoxia inducible factor-1, HIF-1)的高表达[19]。将高表达HIF-1α的MDA-MB-231乳腺癌细胞接种于小鼠左心室内,结果发现高表达的HIF-1α能够促进肿瘤细胞迁移至骨组织,并且优先在高度缺氧和高表达HIF-1α的区域定植和生长; 缺氧能够活化破骨细胞并促进破骨细胞产生RANK、VEGF等,抑制成骨细胞的分化和骨形成[20]。最近研究表明位于骨髓缺氧的壁龛中的成骨细胞亦能表达HIF-1α,HIF-1α可以促进骨转移,并能远程调控乳腺癌细胞在其他组织中生长和扩散,作用机制可能是HIF-1α能够促进CXCL12的分泌[21]。pH值对骨骼生物学非常重要,骨骼中含有大量碱性矿物质(羟基磷灰石)或缓冲系统维持正常的pH值。在骨转移早期阶段,骨微环境便处于酸中毒状态,其机制是缺氧以及肿瘤细胞高度糖酵解诱导细胞膜内外Na+、H+等离子的调节使骨微环境pH值呈酸性状态,其中液泡型H+-ATP酶(V-ATP酶)是骨微环境酸中毒的关键,在肿瘤细胞和破骨细胞中均表达[22]。酸中毒显著增强破骨细胞的活性从而导致骨质流失,如活化破骨细胞中活化T-细胞核因子1[23]; 酸中毒亦能抑制成骨细胞的生物功能,导致骨小梁形成受损,并促进亲破骨细胞RANKL的表达[24]; 另外,酸中毒环境激活间充质基质细胞NF-κB信号转导通路促进炎症因子、趋化因子和生长因子的分泌,如IL-1、IL-6、CXCL2,导致肿瘤诱导的伤害感受和痛觉过敏、增强肿瘤侵袭性和有利于肿瘤细胞免疫逃逸[25]。
2 肿瘤细胞对骨细胞的调节作用在溶骨性骨转移早期阶段,肿瘤细胞对成骨细胞、破骨细胞均有反向调节作用,其中延缓骨质的形成可能是打破骨平衡的主要原因[26]。对于成骨细胞,研究发现具有溶骨性骨转移特征的乳腺癌细胞和肺癌细胞均高表达Dickkopf1(Dkk1); Dkk1作为Wnt/β-连环蛋白拮抗剂,通过阻断Wnt/β-连环蛋白信号通路延缓骨转移病灶中成骨细胞的分化、降低碱性磷酸酶的活性和减少骨保护素(Osteoprotegerin, OPG)的表达,当敲除Dkk1后能够加速成骨细胞的成熟[27]。一项研究纳入470例非小细胞肺癌患者(骨转移患者140例,其他部位转移患者178例,无转移患者152例),检测患者血清Dkk1蛋白的含量,结果表明骨转移患者Dkk1水平显著高于其他患者(P < 0.01),在生存分析中发现Dkk1水平与骨转移患者的存活率呈负相关(P=0.029),提示Dkk1可用于早期评估非小细胞肺癌患者的骨转移状态[28]。此外,Kimura等[29]构建乳腺癌细胞和成骨细胞的共培养模型,揭示肿瘤细胞通过改变细胞间的黏附关系从而打乱骨微环境中成骨细胞空间排列顺序,达到破坏骨结构稳定性的目的。
骨微环境中肿瘤细胞调节破骨细胞,高度糖酵解的MDA-MB-231细胞在单羧酸转运蛋白4的介导下在骨骼内释放出大量乳酸,外源性乳酸为成熟破骨细胞的氧化代谢提供动力,增强Ⅰ型胶原的吸收从而加速骨溶解[30]。一方面,肿瘤细胞产生的分子直接刺激破骨细胞活性,如白细胞介素(IL-8, IL-11)、M-CSF和TNF-α、McCoy等[31]。研究表明IL-11诱导破骨细胞祖细胞分化和存活,促进破骨细胞的生成; 另一方面,通过成骨细胞激活RANKL/核因子κB受体活化因子(Receptor activator of NF-κB, RANK)/OPG信号转导通路,促进破骨细胞的分化和成熟,进而导致骨基质被破坏、加速骨溶解与骨吸收,使骨微环境进入“骨恶性循环”状态。
3 成骨细胞在溶骨性骨转移早期发展中的作用2017年发表于SCIENCE上的一篇文章指出,即使在未出现骨转移病灶的早期阶段,成骨细胞接受肺癌细胞的远程调控,表现为小鼠胸骨、肋骨等全身多处骨骼密度普遍升高,在小鼠新生的骨组织内成骨细胞数目增多、活跃度上升,且骨钙素表达阳性,而破骨细胞并无这样的变化,这一发现同样在经确诊且未见骨转移的70名非小细胞肺癌患者中被证实,深入研究发现增多的成骨细胞均表达骨钙素,骨钙素阳性的成骨细胞亦可远程促进原发部位肿瘤的生长,在骨钙素阳性的成骨细胞较多的小鼠体内存在高表达唾液酸免疫结合球蛋白样凝集体(sialic acid binding immunoglobulin-like lectin F, SiglecFHigh)的中性粒细胞,SiglecFHigh的中性粒细胞依赖于成骨细胞数量,在小鼠模型中显著促进肿瘤生长,而且SiglecFHigh的中性粒细胞与患者生存率具有相关性。研究人员清除骨钙素阳性的成骨细胞后,中性粒细胞在肿瘤组织中的浸润受到抑制,而且肿瘤的进展受到阻滞,其作用机制可能是骨钙素阳性的成骨细胞通过上调晚期糖基化终产物受体的表达水平,活化肿瘤细胞和促进成骨细胞依赖性中性粒细胞的成熟[32]。
在肿瘤细胞“定植”阶段,最近研究表明成骨细胞作为肿瘤细胞的“钙库”,通过间隙连接使Ca2+定向流入肿瘤细胞内促进肿瘤细胞定植于骨骼,而间隙连接蛋白主要由间隙连接蛋白43(Connexin 43, CX43)组成,研究者发现肿瘤细胞和成骨细胞接触区域有较强的CX43表达,CX43不仅与活化T细胞核因子、肌细胞增强因子2的表达具有相关性,还和骨转移患者的生存期相关,进一步研究发现三氧化二砷能够减少成骨细胞和肿瘤细胞共培养引起的钙离子浓度的升高、降低CX43表达水平和阻断钙离子的传输,从而抑制恶性肿瘤的骨转移[33]。Lawson等[34]发现骨微环境中成骨细胞能够促进癌细胞脱离“休眠”状态,进入再活化及增殖阶段,将由成骨细胞产生的RANK-L注射到带瘤生存的小鼠体内,发现RANK-L导致破骨细胞生成增多并伴随骨吸收增加,同时观察到骨中休眠的癌细胞数量减少,这些结果提示癌细胞的再活化是由成骨细胞衍生因子介导的破骨细胞活性增加引发。Bodenstine等[35]证实在早期乳腺癌骨转移过程中调节成骨细胞的数量可能促进肿瘤细胞增殖,实验组在小鼠胫骨内注射入成骨细胞和乳腺癌细胞,而对照组在小鼠胫骨内单独注射乳腺癌细胞。5周后发现实验组小鼠胫骨部位出现较大的瘤块、延伸到骨外空间并可见骨溶解,而对照组小鼠体内形成的肿瘤体积约为实验组的1/2并未突破骨膜。成骨细胞促进癌细胞生长的机制可能与钙黏蛋白、IL-6、单核细胞趋化蛋白-1(monocyte chemotactic protein 1, MCP-1)等相关。Wang等[36]给小鼠体内单独注射乳腺癌细胞时,在早期阶段癌细胞定植缓慢; 而把乳腺癌细胞和成骨细胞按1:1的方式注射到小鼠体内或给予碱性磷酸酶、Ⅰ型胶原蛋白时,乳腺癌细胞增殖显著增加,进一步研究发现成骨细胞表达的N-钙黏蛋白(N-cadherin)和癌细胞表达的E-钙黏蛋白(E-cadherin)通过异型连接的方式结合上调AKT-mTOR途径中AKT、S6蛋白的表达水平,达到促进肿瘤细胞生长的目的; 另外,在肿瘤细胞的刺激下成骨细胞产生大量的炎症因子如IL-6、MCP-1等活化破骨细胞,亦可以反向促进肿瘤细胞的生长[37],见图 1。
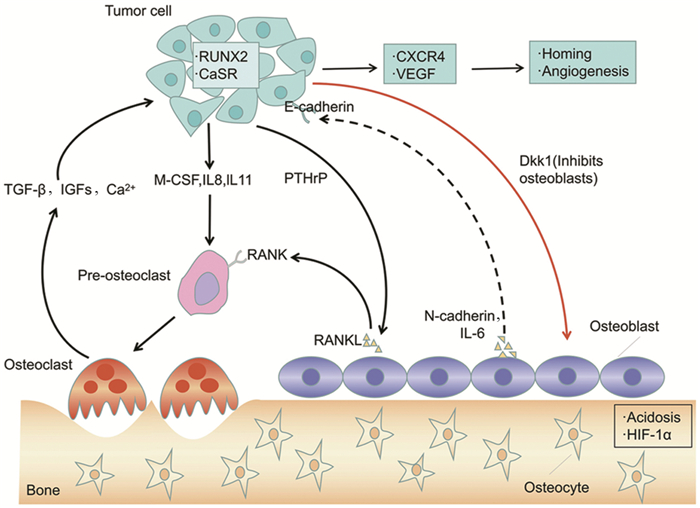
|
| 图 1 恶性肿瘤骨转移机制图 Figure 1 Mechanism of malignant tumor bone metastasis |
乳腺癌、肺癌等易发生溶骨性骨转移,引发疼痛、高钙血症和病理性骨折等症状,其转移的机制尚未完全明确。骨转移的发生和肿瘤细胞生物学行为以及骨微环境相关; 在骨转移早期阶段,肿瘤细胞与成骨细胞相互远程调控,骨微环境在细胞和因子层面发生的显著变化,但破骨细胞、成骨细胞和肿瘤细胞之间的关系以及细胞因子的作用需要进一步研究。相信随着分子与基因技术水平的提高, 将逐步明确骨转移的作用机制,为寻找新的抗骨转移药物提供理论依据。
作者贡献
毛昀:论文设计、撰写及修改
薛鹏:论文撰写、文献查阅
李林潞、徐芃芃:文献查阅
朱世杰:论文设计、审阅
| [1] | Bonetto R, Tallet A, Mélot A, et al. The management of bone metastasis[J]. Bull Cancer, 2017, 104(6): 585–592. DOI:10.1016/j.bulcan.2017.02.004 |
| [2] | Karlsson T, Sundar R, Widmark A, et al. Osteoblast-derived factors promote metastatic potential in human prostate cancer cells, in part via non-canonical transforming growth factor beta (tgfbeta) signaling[J]. Prostate, 2018, 78(6): 446–456. DOI:10.1002/pros.v78.6 |
| [3] | Maurizi A, Rucci N. The osteoclast in bone metastasis: Player and target[J]. Cancers (Basel), 2018, 10(7). pii: E218. |
| [4] | Xiao W, Zheng S, Yang A, et al. Breast cancer subtypes and the risk of distant metastasis at initial diagnosis: A population-based study[J]. Cancer Manag Res, 2018, 10: 5329–5338. DOI:10.2147/CMAR |
| [5] | Joeckel E, Haber T, Prawitt D, et al. High calcium concentration in bones promotes bone metastasis in renal cell carcinomas expressing calcium-sensing receptor[J]. Mol Cancer, 2014, 13: 42. DOI:10.1186/1476-4598-13-42 |
| [6] | Wang Y, Xie Y, Oupicky D. Potential of CXCR4/CXCL12 chemokine axis in cancer drug delivery[J]. Curr Pharmacol Rep, 2016, 2(1): 1–10. DOI:10.1007/s40495-015-0044-8 |
| [7] | Komori T. Runx2, an inducer of osteoblast and chondrocyte differentiation[J]. Histochem Cell Biol, 2018, 149(4): 313–323. DOI:10.1007/s00418-018-1640-6 |
| [8] | Tan CC, Li GX, Tan LD, et al. Breast cancer cells obtain an osteomimetic feature via epithelial-mesenchymal transition that have undergone BMP2/Runx2 signaling pathway induction[J]. Oncotarget, 2016, 7(48): 79688–79705. |
| [9] | Xiang L, Gilkes DM. The contribution of the immune system in bone metastasis pathogenesis[J]. Int J Mol Sci, 2019, 20(4): pii: E999. |
| [10] | Zhao E, Wang L, Dai J, et al. Regulatory T cells in the bone marrow microenvironment in patients with prostate cancer[J]. Oncoimmunology, 2012, 1(2): 152–161. |
| [11] | Monteiro AC, Leal AC, Goncalves-Silva T, et al. T cells induce pre-metastatic osteolytic disease and help bone metastases establishment in a mouse model of metastatic breast cancer[J]. PLoS One, 2013, 8(7): e68171. DOI:10.1371/journal.pone.0068171 |
| [12] | Sawant A, Hensel JA, Chanda D, et al. Depletion of plasmacytoid dendritic cells inhibits tumor growth and prevents bone metastasis of breast cancer cells[J]. J Immunol, 2012, 189(9): 4258–4265. DOI:10.4049/jimmunol.1101855 |
| [13] | Sawant A, Deshane J, Jules J, et al. Myeloid-derived suppressor cells function as novel osteoclast progenitors enhancing bone loss in breast cancer[J]. Cancer Res, 2013, 73(2): 672–682. DOI:10.1158/0008-5472.CAN-12-2202 |
| [14] | Schernberg A, Blanchard P, Chargari C, et al. Neutrophils, a candidate biomarker and target for radiation therapy?[J]. Acta Oncol, 2017, 56(11): 1522–1530. DOI:10.1080/0284186X.2017.1348623 |
| [15] | Graham N, Qian BZ. Mesenchymal stromal cells: Emerging roles in bone metastasis[J]. Int J Mol Sci, 2018, 19(4). pii: E1121. |
| [16] | Luo G, He Y, Yu X. Bone marrow adipocyte: An intimate partner with tumor cells in bone metastasis[J]. Front Endocrinol(Lausanne), 2018, 9: 339. DOI:10.3389/fendo.2018.00339 |
| [17] | Swami S, Johnson J, Bettinson LA, et al. Prevention of breast cancer skeletal metastases with parathyroid hormone[J]. JCI Insight, 2017, 2(17). pii: 90874. |
| [18] | LeBleu VS, Kalluri R. A peek into cancer-associated fibroblasts: Origins, functions and translational impact[J]. Dis Model Mech, 2018, 11(4). pii: dmm029447. |
| [19] | Spencer JA, Ferraro F, Roussakis E, et al. Direct measurement of local oxygen concentration in the bone marrow of live animals[J]. Nature, 2014, 508(7495): 269–273. DOI:10.1038/nature13034 |
| [20] | Hiraga T. Hypoxic microenvironment and metastatic bone disease[J]. Int J Mol Sci, 2018, 19(11). pii: E3523. |
| [21] | Devignes CS, Aslan Y, Brenot A, et al. Hif signaling in osteoblast-lineage cells promotes systemic breast cancer growth and metastasis in mice[J]. Proc Natl Acad Sci USA, 2018, 115(5): E992–E1001. DOI:10.1073/pnas.1718009115 |
| [22] | Avnet S, Di Pompo G, Lemma S, et al. Cause and effect of microenvironmental acidosis on bone metastases[J]. Cancer Metastasis Rev, 2019, 38(1-2): 133–147. DOI:10.1007/s10555-019-09790-9 |
| [23] | Yuan FL, Xu MH, Li X, et al. The roles of acidosis in osteoclast biology[J]. Front Physiol, 2016, 7: 222. |
| [24] | Arnett TR. Acidosis, hypoxia and bone[J]. Arch Biochem Biophys, 2010, 503(1): 103–9. DOI:10.1016/j.abb.2010.07.021 |
| [25] | Avnet S, Di Pompo G, Chano T, et al. Cancer-associated mesenchymal stroma fosters the stemness of osteosarcoma cells in response to intratumoral acidosis via nf-kappab activation[J]. Int J Cancer, 2017, 140(6): 1331–1345. DOI:10.1002/ijc.30540 |
| [26] | Shupp AB, Kolb AD, Mukhopadhyay D, et al. Cancer metastases to bone: Concepts, mechanisms, and interactions with bone osteoblasts[J]. Cancers(Basel), 2018, 10(6). pii: E182. |
| [27] | Chu T, Teng J, Jiang L, et al. Lung cancer-derived dickkopf1 is associated with bone metastasis and the mechanism involves the inhibition of osteoblast differentiation[J]. Biochem Biophys Res Commun, 2014, 443(3): 962–968. DOI:10.1016/j.bbrc.2013.12.076 |
| [28] | Qiao R, Zhong R, Chang Q, et al. Serum dickkopf-1 as a clinical and prognostic factor in non-small cell lung cancer patients with bone metastases[J]. Oncotarget, 2017, 8(45): 79469–79479. |
| [29] | Kimura Y, Matsugaki A, Sekita A, et al. Alteration of osteoblast arrangement via direct attack by cancer cells: New insights into bone metastasis[J]. Sci Rep, 2017, 7: 44824. DOI:10.1038/srep44824 |
| [30] | Lemma S, Di PG, Porporato PE, et al. Mda-mb-231 breast cancer cells fuel osteoclast metabolism and activity: A new rationale for the pathogenesis of osteolytic bone metastases[J]. Biochim Biophys Acta Mol Basis Dis, 2017, 1863(12): 3254–3264. DOI:10.1016/j.bbadis.2017.08.030 |
| [31] | McCoy EM, Hong H, Pruitt HC, et al. Il-11 produced by breast cancer cells augments osteoclastogenesis by sustaining the pool of osteoclast progenitor cells[J]. BMC Cancer, 2013, 13: 16. DOI:10.1186/1471-2407-13-16 |
| [32] | Engblom C, Pfirschke C, Zilionis R, et al. Osteoblasts remotely supply lung tumors with cancer-promoting SiglecFhigh neutrophils[J]. Science, 2017, 358(6367). pii: eaa15081. |
| [33] | Wang H, Tian L, Liu J, et al. The osteogenic niche is a calcium reservoir of bone micrometastases and confers unexpected therapeutic vulnerability[J]. Cancer Cell, 2018, 34(5): 823–839. DOI:10.1016/j.ccell.2018.10.002 |
| [34] | Lawson MA, McDonald MM, Kovacic N, et al. Osteoclasts control reactivation of dormant myeloma cells by remodelling the endosteal niche[J]. Nat Commun, 2015, 6: 8983. DOI:10.1038/ncomms9983 |
| [35] | Bodenstine TM, Beck BH, Cook LM, et al. Pre-osteoblastic MC3T3-E1 cells promote breast cancer growth in bone in a murine xenograft model[J]. Chin J Cancer, 2011, 30(3): 189–196. DOI:10.5732/cjc.010.10582 |
| [36] | Wang H, Yu C, Gao X, et al. The osteogenic niche promotes early-stage bone colonization of disseminated breast cancer cells[J]. Cancer Cell, 2015, 27(2): 193–210. DOI:10.1016/j.ccell.2014.11.017 |
| [37] | Bussard KM, Venzon DJ, Mastro AM. Osteoblasts are a major source of inflammatory cytokines in the tumor microenvironment of bone metastatic breast cancer[J]. J Cell Biochem, 2010, 111(5): 1138–1148. DOI:10.1002/jcb.22799 |
 2019, Vol. 46
2019, Vol. 46


