文章信息
- 多西他赛再挑战治疗转移性去势抵抗性前列腺癌的疗效及预后因素
- Efficacy and Prognostic Factors of Docetaxel Rechallenge on Metastatic Castration-resistant Prostate Cancer Patients
- 肿瘤防治研究, 2019, 46(9): 819-824
- Cancer Research on Prevention and Treatment, 2019, 46(9): 819-824
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0626
- 收稿日期: 2019-05-13
- 修回日期: 2019-06-30
2. 430079 武汉,湖北省肿瘤医院泌尿外科
2. Department of Urology, Hubei Cancer Hospital, Wuhan 430079, China
2004年,TAX327研究[1]第一次将多西他赛化疗用于转移性去势抵抗性前列腺癌(metastatic castration-resistant prostate cancer, mCRPC)的治疗,自此以后,多西他赛化疗被越来越多的应用于临床,显示出一定的生存获益。随着越来越多的新型内分泌药物(如阿比特龙、恩杂鲁胺)、二线细胞毒药物(卡巴他赛)、免疫治疗(Sipuleucel-T)、放射性核素(镭-223)的相继出现,多西他赛在mCRPC患者治疗中的地位有所下降,但因上述大部分药物在国内未上市以及价格昂贵使得目前在临床上的使用受限,因此多西他赛仍有其重要的使用价值。
即使在上述药物反复治疗后的患者,有报道多西他赛仍显示出超过70%的血清前列腺特异性抗原(prostate-specific antigen, PSA)水平下降[2]。
多西他赛再挑战,即多西他赛在重新应用于之前一线多西他赛化疗有效的mCRPC患者时再次显示出较好的抗肿瘤效应,血清PSA反应率约30%[3]。探索多西他赛再挑战的疗效和安全性的文献目前并不多,国外文献数据显示,对一线多西他赛部分反应(血清PSA下降超过50%)和第一、第二序列多西他赛的治疗间歇期大于3~6月的mCRPC患者预后较好[4-5]。
因此我们的研究选取一线多西他赛治疗有效并且在进展后行多西他赛再挑战的mCRPC患者,进行多西他赛再挑战的疗效及预后因素分析,观察多西他赛是否可作为一线多西他赛治疗有效的mCRPC患者后期进展后治疗的一种选择。
1 资料与方法 1.1 一般资料收集2008年1月—2018年12月湖北省肿瘤医院放疗中心收治的一线使用多西他赛有效且进展后行多西他赛再挑战的120例mCRPC患者的临床资料,包括:年龄、mCRPC就诊时的基础血清PSA水平、有无骨痛症状、血红蛋白水平、东部肿瘤协作组体能状态评分(Eastern Cooperative Oncology Group Performance Status, ECOG PS)、确诊mCRPC前雄激素剥夺治疗(androgen deprivation therapy, ADT)有效时间、第一序列多西他赛化疗与多西他赛再挑战之间的治疗间歇期、对第一序列多西他赛及多西他赛再挑战的反应性、ADT治疗7月时PSA最低值是否低于0.2 ng/dl、是否伴随内脏转移性疾病、随访时间以及结局。入选标准:(1)所有患者均经病理学检查确诊为前列腺腺泡腺癌。(2)具备病灶转移的证据,按照实体瘤疗效评价标准RECIST(Response Evaluation Criteria In Solid Tumors)1.1,骨扫描或CT/MRI检查证实存在转移病灶。(3)ECOG PS评分≤2分。(4)所有患者确诊后立即行ADT治疗(促黄体激素释放激素(luteinizing hormone-releasing hormone, LHRH)激动剂/拮抗剂,每28天1次或睾丸切除术±第一代抗雄激素药物口服。入选本研究时已进入mCRPC阶段、完成第一序列多西他赛化疗且均达到PSA完全或部分反应标准,且进展后再次使用了多西他赛治疗的患者。进展标准:(1)PSA进展:治疗后血清PSA较治疗前下降≥50%后在最低值基础上升高≥25%,并且PSA绝对值升高 > 2 ng/dl;(2)影像学进展:影像学出现新的转移病灶或者原有转移病灶较前体积增大。无论PSA进展还是影像学进展均符合PCWG3(Prostate Cancer Clinical Trials Working Group three)标准[6]。PSA反应标准:(1)完全反应:血清PSA较治疗前下降≥50%,且 < 4 ng/dl;(2)部分反应:血清PSA较治疗前下降≥50%,且≥4 ng/dl; (3)获得部分反应:完全反应+部分反应;(4)未获得部分反应:血清PSA较治疗前无下降或下降 < 50%。
1.2 治疗方法确诊mCRPC后已行第一序列多西他赛75 mg/m2、3周方案化疗+泼尼松5 mg每天2次口服治疗4~12周期,PSA获得部分反应的120例mCRPC患者,随后进入治疗间歇期,当出现进展时,均再次挑战多西他赛75 mg/m2、3周方案化疗+泼尼松5 mg每天2次口服治疗1~6周期,PSA获得部分反应的患者进入治疗间歇期,再次进展后挑战第3序列多西他赛化疗,PSA未获得部分反应的患者采用包括艾去适、阿比特龙、恩杂鲁胺、铂类等为基础的化疗其他治疗。停止多西他赛化疗标准为:患者不能耐受、不愿意继续化疗、达到了预定的周期数和医生判定继续化疗无生存获益。
1.3 观察指标化疗期间患者每21天于化疗开始前一天复查血常规、肝肾功能、电解质、血清PSA等,化疗结束后每28天复查上述指标,每3月复查CT、MRI、骨扫描,出现血清PSA变化或者临床症状变化时随时复查影像学。观察患者化疗时记录的不良反应、出现发热性中性粒细胞减少及处理的情况。通过主动复诊及电话回访方式对患者进行跟踪随访。第一序列多西他赛化疗血清PSA无疾病进展生存期(progression-free survival, PFS)(定义为PSA PFS)、多西他赛再挑战血清PSA PFS(定义为Rechallenge PSA PFS)及患者确诊为mCRPC后的总生存期(overall survival, OS)作为主要随访终点并记录该随访终点。
1.4 统计学方法采用SPSS25.0统计软件进行处理,定量资料以中位数(四分位间距)表示。PSA PFS、Rechallenge PSA PFS和OS采用Kaplan-Meier曲线分析。采用单因素和多因素Cox回归分析与患者PSA PFS、Rechallenge PSA PFS和OS相关的预后因素。记录危险比(hazard ratios, HR)和95%可信区间(confidence Intervals, CI),P < 0.05为差异有统计学意义。(特别注明:单因素分析中为避免遗漏可能影响预后的因素,将所有P < 0.2的因素均纳入多因素分析。)
2 结果 2.1 患者的临床特征入选患者的基本情况,见表 1。

|
中位随访时间32.73(13.27~98.56)月,30例(25%)mCRPC患者仍存活。中位PSA PFS 13.89(7.67~39.00)月,中位rechallenge PSA PFS 5.29(1.25~20.00)月,中位OS 27.13(12.40~60.50)月。第一序列多西他赛治疗的120例mCRPC患者中,PSA完全反应和部分反应分别为61例(50.8%)、59例(49.2%),多西他赛再挑战治疗的120例mCRPC患者中,PSA获得部分反应和PSA未获得部分反应患者分别为63例(52.5%)、57例(47.5%)。再挑战PSA获得部分反应的患者中,33例(52.5%)进行了第三序列的多西他赛化疗。第一序列多西他赛化疗与多西他赛再挑战之间的治疗间歇期(> 6月vs.≤6月)组中位PSA PFS分别为18.00(14.72~21.27)、11.00(9.86~12.13)月,差异有统计学意义(P < 0.05),二者生存情况的Kaplan-Meier曲线,见图 1A。多西他赛再挑战PSA获得部分反应与PSA未获得部分反应患者组中位Rechallenge PSA PFS分别为10.00(95%CI: 8.33~11.66)、3.00(95%CI: 2.35~3.64)月,差异有统计学意义(P < 0.05),二者生存情况的Kaplan-Meier曲线,见图 1B。多西他赛再挑战PSA获得部分反应与PSA未获得部分反应患者组中位OS分别为45.00(95%CI: 39.45~50.54)、18.00(95%CI: 16.88~19.12)月,差异有统计学意义(P < 0.05),二者生存情况的Kaplan-Meier曲线,见图 1C。
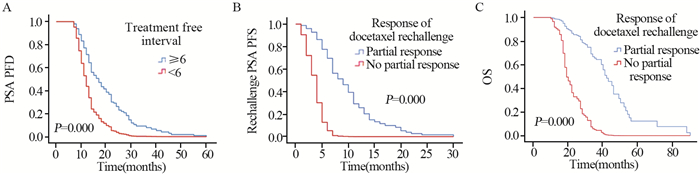
|
| A: Comparison of PSA PFS for treatment-free interval between first and second sequence docetaxel chemotherapy (> 6 months vs. ≤6 months); B: Comparison of Rechallenge PSA PFS of patients between partial and no partial PSA response at docetaxel rechallenge; C: Comparison of patients' OS between partial and no partial PSA response at docetaxel rechallenge 图 1 多西他赛治疗mCRPC患者生存情况的Kaplan-Meier曲线图 Figure 1 Kaplan-Meier survival curves of mCRPC patients treated with docetaxel |
Logistic单因素回归分析显示:血红蛋白水平、ECOG PS、确诊mCRPC前ADT治疗有效时间、第一序列多西他赛化疗与多西他赛再挑战之间的治疗间歇期、对第一序列多西他赛及多西他赛再挑战的反应性,治疗7月时PSA最低值是否低于0.2 ng/dl、是否伴随内脏转移性疾病与患者的PSA PFS(P < 0.2)、Rechallenge PSA PFS(P < 0.2)、OS(P < 0.2)相关,另外mCRPC患者就诊时的基础血清PSA水平,有无骨痛症状也与患者的OS相关(P < 0.2)。多因素回归分析显示:第一序列多西他赛化疗与多西他赛再挑战之间的治疗间歇期(> 6月vs.≤6月)与患者的PSA PFS显著相关(P < 0.05),对多西他赛再挑战治疗反应性(获得部分反应vs.未获得部分反应)与Rechallenge PSA PFS显著相关(P < 0.05),mCRPC患者就诊时基础血清PSA值及对多西他赛再挑战治疗反应性(获得部分反应vs.未获得部分反应)与OS显著相关(P < 0.05)。多西他赛再挑战治疗mCRPC患者的单因素及多因素回归分析结果见表 2~3。
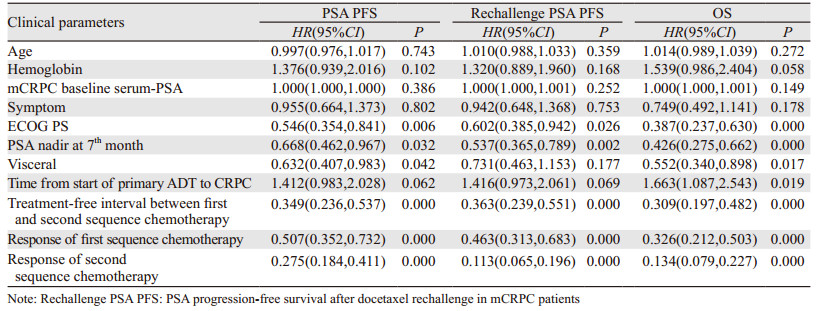
|
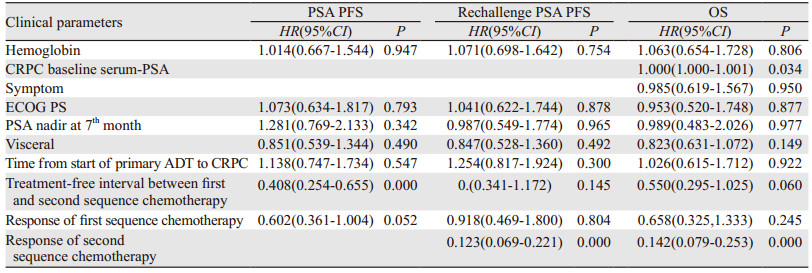
|
作为mCRPC患者的二线治疗,有不同的选择:卡巴他赛,阿比特龙,和恩杂鲁胺等。一系列研究[7-9]显示mCRPC患者对一线多西他赛化疗反应良好的患者(包括完全反应及部分反应),停止化疗后,疾病未进展,此时对多西他赛仍敏感,患者仍然可以从一次或多次再挑战中获得延长对疾病的控制。并有文献报道[10]存在足够的无疾病进展化疗间歇期(3~6)月、较好的ECOG PS和一线多西他赛化疗安全的患者,可考虑行多西他赛再挑战化疗。这一现象在转移性激素敏感性前列腺癌(metastatic hormone-sensitive prostate cancer, mHSPC)多西他赛化疗后进展的患者中得到进一步的证实[11]。因此多西他赛再挑战也成为临床一线多西他赛治疗有效的mCRPC患者的二线治疗的一种选择。因此我们收集一线使用多西他赛完全反应及部分反应的mCRPC患者进行多西他赛再挑战治疗的研究。
多西他赛再挑战,也有学者称之为间歇性多西他赛化疗[12],分为两种实施方式:第一种为实施一定周期的第一序列多西他赛化疗,多为6~12周期,达到血清PSA、影像学或者临床症状完全或部分缓解后,进入治疗间歇期,等待病情进展(血清PSA、影像学或者临床症状任一)则重新启动多西他赛化疗,此种方式称之为再挑战比较合理;第二种为预先设定第一序列化疗周期数(比如3~4周期)及治疗间歇期(比如12周),即无论是否达到完全或部分缓解,到时即停止化疗,过间歇期即再化疗,此种方式称为间歇性化疗较合理[13-14]。后者更多是基于平衡多西他赛化疗疗效和安全的角度而实施的一种策略。然而,刚刚发表的PRINCE研究[4]对比多西他赛以上两种实施方式,得出的结论是二者在生化PFS和OS方面没有区别,而且,Caffo等[13]的研究显示间歇性多西他赛化疗作为mCRPC的一线治疗并未更加提高患者的生活质量。因此,我们认为多西他赛再挑战方案能够保证疗效和安全,我们的临床实践也采用该方案。
对于mCRPC患者,临床试验中评估的预后因素常包括症状性疾病、内脏转移、化疗前较短的ADT治疗有效时间(16~20月)、血清基础睾酮水平,预测因素常包括化疗期间或者化疗后 < 3月内疾病进展、Gleason评分、PSA倍增时间等[10]。另外关于mHSPC多西他赛化疗的CHAATEDE研究[15]则显示ADT治疗7月时PSA≤0.2 ng/dl的患者有着更好的生存预后,故在mCRPC的研究中,该因素也应纳入[16]。Oudard等[5]纳入了92例mCRPC化疗患者,其中46例进行了多西他赛再挑战,总生化反应率(PSA下降 > 50%)66%,总OS达32月;第一、二序列间歇期 > 6月可以达到更好的血清PSA反应率、更优的症状减轻以及更长的OS,因此第一、二序列间歇期 > 6月是血清PSA反应率、症状减轻、OS的独立预后因素。Thomas等[17]报道了94例多西他赛化疗的mCRPC患者,PSA获得部分反应在第一序列多西他赛化疗(n=62)、再挑战(n=32)、第三序列化疗(n=22)分别为48.4%、31.6%、34.8%;多因素分析显示:CRPC前ADT治疗有效时间 > 47月是OS唯一独立的治疗前预测因素(HR=0.58, P=0.015),对多西他赛再挑战PSA获得部分反应(HR=0.31, P=0.008)和第一二序列化疗间歇期 > 3月(HR=3.49, P=0.014)是OS独立的预后因素。Bracarda等[18]纳入了128例mCRPC患者,98例患者在第一序列多西他赛化疗后获得了疾病的控制,中间经过8.3月的治疗“假期”,该98例患者进入了再挑战,56例患者获得了再次疾病的控制,经过5.7月“假期”,32例患者进入了第三序列化疗,16例获得部分反应,4.2月“假期”后,8例患者进入第四序列化疗,2例部分反应。整个人群中位PFS为16.4月。本研究结果显示中位PSA PFS 13.89月,中位Rechallenge PSA PFS 5.29月,中位OS 27.13月,与文献报道类似。我们的研究显示mCRPC患者就诊时基础血清PSA值及对多西他赛再挑战治疗PSA反应性(获得部分反应vs.未获得部分反应)与OS显著相关(HR=0.142, P=0.000),是OS的独立预后因素,与上述Thomos等[17]的研究一致;但进入mCRPC前ADT治疗有效时间我们是以48月作为分界点,并且化疗间歇期是以6月作为分界点,而不是3月,结合我国mCRPC患者多西他赛治疗失败后仅有的米托蒽醌、艾去适治疗效果有限,而阿比特龙、恩杂鲁胺、卡巴他赛、镭-223、Sipuleucel-T因价格昂贵及未在大陆上市等原因使得获取性相对国外低,以上两项指标在本试验中并未观察到与OS显著相关性。同样,在第一序列多西他赛化疗中,我们尝试将完全反应与部分反应作比较研究,得出完全反应患者具有更好的OS,但结果未能显示这种差别。本研究的不足之处在于:基于回顾性非随机对照研究,内在固有的偏倚,包括较小的样本量,样本来自单中心,较短的中位随访时间,以及mHSPC化疗后、新型内分泌药物治疗后、卡巴他赛化疗后多西他赛再挑战等病例均未纳入本研究,使得研究结论的代表性、普遍性相对局限。
随着阿比特龙的普及,恩杂鲁胺即将在国内上市,以及更多新药的临床试验的开展[19],基于基因检测的证据的普及[8],mCRPC患者将获得更多的治疗选择,有望获得更好的治疗,但因新型内分泌药物价格昂贵及获取性相对国外低使得在中国临床上使用相对受限,因此多西他赛再挑战仍然是一种重要的选择,仍有其临床使用价值[20]。
作者贡献
段丽群:论文撰写及数据分析
张曲:病例资料收集整理
刘三河:统计学分析
邓康俐:病例资料收集整理
魏少忠:论文指导及修改
| [1] | Tannock IF, de Wit R, Berry WR, et al. Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer[J]. N Engl J Med, 2004, 351(15): 1502–1512. DOI:10.1056/NEJMoa040720 |
| [2] | Di Lorenzo G, Pagliuca M, Perillo T, et al. Docetaxel rechallenge in a heavily pretreated patient with castration-resistant prostate cancer: a case report and review of literature[J]. Medicine (Baltimore), 2016, 95(14): e2754. DOI:10.1097/MD.0000000000002754 |
| [3] | Petrioli R, Roviello G, Fiaschi AI, et al. Rechallenge of docetaxel combined with epirubicin given on a weekly schedule in advanced castration-resistant prostate cancer patients previously exposed to docetaxel and abiraterone acetate: a single-institution experience[J]. Med Oncol, 2015, 32(3): 52. DOI:10.1007/s12032-015-0485-2 |
| [4] | Cash H, Steiner U, Heidenreich A, et al. Intermittent vs continuous docetaxel therapy in patients with metastatic castration-resistant prostate cancer-a phase Ⅲ study (PRINCE)[J]. BJU Int, 2018, 122(5): 774–782. DOI:10.1111/bju.14239 |
| [5] | Oudard S, Kramer G, Caffo O, et al. Docetaxel rechallenge after an initial good response in patients with metastatic castration-resistant prostate cancer[J]. BJU Int, 2015, 115(5): 744–752. DOI:10.1111/bju.12845 |
| [6] | Cassinello J, Arranz Já, Piulats JM, et al. SEOM clinical guidelines for the treatment of metastatic prostate cancer (2017)[J]. Clin Transl Oncol, 2018, 20(1): 57–68. DOI:10.1007/s12094-017-1783-2 |
| [7] | Narita S, Koie T, Yamada S, et al. A prospective multicenter study of intermittent chemotherapy with docetaxel and prednisolone for castration-resistant prostate cancer[J]. Jpn J Clin Oncol, 2016, 46(6): 547–553. DOI:10.1093/jjco/hyw021 |
| [8] | Tucci M, Caffo O, Buttigliero C, et al. Therapeutic options for first-line metastatic castration-resistant prostate cancer: Suggestions for clinical practise in the CHAARTED and LATITUDE era[J]. Cancer Treat Rev, 2019, 74: 35–42. DOI:10.1016/j.ctrv.2019.01.002 |
| [9] | Aggarwal RR, Beer TM, Weinberg VK, et al. Intermittent chemotherapy as a platform for testing novel agents in patients with metastatic castration-resistant prostate cancer: a department of defense prostate cancer clinical trials consortium randomized phase Ⅱ trial of intermittent docetaxel with prednisone with or without maintenance GM-CSF[J]. Clin Genitourin Cancer, 2015, 13(3): e191–e198. DOI:10.1016/j.clgc.2014.12.004 |
| [10] | Irelli A, Bruera G, Cannita K, et al. Bioclinical parameters driving decision-making of subsequent lines of treatment in metastatic castration-resistant prostate cancer[J]. Biomed Res Int, 2014, 2014: 909623. |
| [11] | Francini E, Yip S, Ahmed S, et al. Clinical outcomes of first-line abiraterone acetate or enzalutamide for metastatic castration-resistant prostate cancer after androgen deprivation therapy + docetaxel or ADT alone for metastatic hormone-sensitive prostate cancer[J]. Clin Genitourin Cancer, 2018, 16(2): 130–134. DOI:10.1016/j.clgc.2017.12.012 |
| [12] | Kume H, Kawai T, Nagata M, et al. Intermittent docetaxel chemotherapy is feasible for castration-resistant prostate cancer[J]. Mol Clin Oncol, 2015, 3(2): 303–307. DOI:10.3892/mco.2014.469 |
| [13] | Caffo O, Lo Re G, Sava T, et al. Intermittent docetaxel chemotherapy as first-line treatment for metastatic castration-resistant prostate cancer patients[J]. Future Oncol, 2015, 11(6): 965–973. DOI:10.2217/fon.14.284 |
| [14] | Gyawali B, Koomulli-Parambil S, Iddawela M. Continuous versus intermittent docetaxel for metastatic castration resistant prostate cancer[J]. Crit Rev Oncol Hematol, 2016, 102: 118–124. DOI:10.1016/j.critrevonc.2016.04.014 |
| [15] | Sweeney CJ, Chen YH, Carducci M, et al. Chemohormonal Therapy in Metastatic Hormone-Sensitive Prostate Cancer[J]. N Engl J Med, 2015, 373(8): 737–746. DOI:10.1056/NEJMoa1503747 |
| [16] | Yamashita S, Kohjimoto Y, Iguchi T, et al. Prognostic factors and risk stratification in patients with castration-resistant prostate cancer receiving docetaxel-based chemotherapy[J]. BMC Urol, 2016, 16: 13. DOI:10.1186/s12894-016-0133-y |
| [17] | Thomas C, Brandt MP, Baldauf S, et al. Docetaxel-rechallenge in castration-resistant prostate cancer: defining clinical factors for successful treatment response and improvement in overall survival[J]. Int Urol Nephrol, 2018, 50(10): 1821–1827. DOI:10.1007/s11255-018-1963-1 |
| [18] | Bracarda S, Caserta C, Galli L, et al. Docetaxel rechallenge in metastatic castration-resistant prostate cancer: any place in the modern treatment scenario? An intention to treat evaluation[J]. Future Oncol, 2015, 11(22): 3083–3090. DOI:10.2217/fon.15.217 |
| [19] | Boulos S, Mazhar D. The evolving role of chemotherapy in prostate cancer[J]. Future Oncol, 2017, 13(12): 1091–1095. DOI:10.2217/fon-2016-0464 |
| [20] | Handy CE, Antonarakis ES. Sequencing treatment for castration-resistant prostate cancer[J]. Curr Treat Options Oncol, 2016, 17(12): 64. DOI:10.1007/s11864-016-0438-9 |
 2019, Vol. 46
2019, Vol. 46


