文章信息
- miRNA-451通过MRP靶向调控胃癌细胞对5-Fu耐药性的机制研究
- Mechanism of miRNA-451 Regulating Resistance of Gastric Cancer Cells to 5-Fu Through MRP
- 肿瘤防治研究, 2019, 46(12): 1073-1077
- Cancer Research on Prevention and Treatment, 2019, 46(12): 1073-1077
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0618
- 收稿日期: 2019-05-13
- 修回日期: 2019-10-08
2. 710077 西安,西安医学院第一附属医院急诊科
2. Department of Emergency, First Affiliated Hospital of Xi'an Medical College, Xi'an 710077, China
胃癌是世界上癌症相关死亡的三大常见原因之一。目前根治性手术以及放化疗等辅助治疗方案的联合应用,胃癌患者的生存期已显著延长[1]。但是大多数患者最终会对化疗药物产生耐药现象,胃癌患者并不能通过传统的治疗方法受益,因此寻找新的治疗策略是当务之急[2]。有研究发现miR-451可促进消化道肿瘤的发生发展,然而,miR-451是否参与胃癌对5-Fu耐药的调节仍未可知[3]。MRP通过细胞外和细胞内膜运输各种分子,涉及多重耐药性[4]。该蛋白质作为多特异性有机阴离子转运蛋白起作用,是广泛表达于人体各组织中的耐药基因,在调节肿瘤对药物的反应性过程中发挥重要作用。在非小细胞肺癌中,MRP可作为耐药基因影响患者对铂类药物的敏感度[5]。本研究拟通过RT-PCR检测miR-451在胃癌中的表达水平,在细胞水平上分析其对胃癌细胞增殖、迁移能力的影响,并揭示其可能参与的分子调控路径。
1 资料与方法 1.1 资料293T细胞、胃癌亲本细胞株(BGC-823、SGC-790、MKN-4、MKN-45、MKN-28)及BGC-823耐药细胞株、MKN-4耐药细胞株、MKN-28耐药细胞株均购自ATCC(美国);DMEM细胞培养基购自SIGMA-ALDRICH公司(德国);胎牛血清购自Gibco公司(美国);CCK8试剂盒购自MCE公司(中国);psPAX2、pMD2G、pLenti-miR-451 or pLenti-control均购自优宝生物(中国);miRNA-451引物、U6引物、GAPDH引物、MRP引物、NC inhibitor以及miR-451 inhibitor购自广州锐博生物科技有限公司(中国);RNA提取试剂盒购自TaKaRa公司(日本);RNA反转录试剂盒(Revert Aid First Strand cDNA Synthesis Kit)以及miRNA Universal SYBR® qPCR Master Mix试剂盒购自南京诺唯赞生物科技有限公司(中国);一抗GAPDH及辣根过氧化物酶标记的羊抗兔/鼠二抗均购于三鹰生物科技有限公司(中国);Western blot试剂盒及BCA蛋白浓度测量试剂盒购自碧云天生物技术公司(中国)。
1.2 组织来源收集西安医学院第一附属医院胃癌患者20例,取癌组织和癌旁组织样本后立即置于-80℃液氮中冷冻待用。
1.3 细胞培养293T细胞、胃癌细胞系(BGC-823、SGC-790、MKN-4、MKN-45和MKN-28)培养于含10%FBS的DMEM中,BGC-823耐药细胞株、MKN-4耐药细胞株、MKN-28耐药细胞株培养于含1 mg/L的10%FBS的DMEM中,且均在含饱和湿度、5%CO2、37℃的细胞培养箱中培养。
1.4 病毒包装胰酶消化收集对数期生长的293T细胞,待细胞生长至60%时,按照病毒包装以及转染试剂要求,pLenti-control/pLenti-miR-451:psPAX2: pMD2G=4:3:1混合后,转染入293T细胞,6 h后更换新鲜DMEM培养基,48 h收集细胞上清液用于转染胃癌细胞(MKN-4/MKN-28/BGC-823耐药细胞株)。
1.5 构建稳定过表达细胞系胰酶消化生长于对数期的胃癌细胞系(MKN-4/MKN-28/BGC-823耐药细胞株),待细胞生长至50%时,按要求转染胃癌细胞,24 h后更换新鲜培养基,持续使用嘌呤霉素(1 mg/L)筛选,2周后,荧光定量PCR检测过表达效率。
1.6 细胞转染取对数生长期的细胞,以105个/孔密度接种于6孔板中,待细胞融合度达到80%时,采用LipofectamineTM 3000将miR-451 inhibitor转染入胃癌细胞系(MKN-4、MKN-28耐药细胞株),继续培养4 h后,更换含FBS的DMEM培养基继续培养以供后续实验。
1.7 RNA提取及荧光定量从不同胃癌组织及胃癌细胞系(BGC-823、SGC-790、MKN-4、MKN-45、MKN-28)中提取RNA用于测定胞内miR-451的相对表达量。按照RNA提取试剂盒要求提取RNA,按照反转录试剂盒要求将其反转录为CDNA,合成的CDNA按照miRNA Universal SYBR®qPCR Master Mix试剂盒要求进行PCR扩增,以U6为内参检测miR-451的表达,以GAPDH为内参检测MRP的表达。U6正向引物序列:5’-GCTTGCTTCAGCAGCACATA-3’,反向引物:5’-AAAAACATGGAACTCTTCACG-3’;miR-45正向引物:5’-CCGAAACCGTTACCATTAC-3’,反向引物:5’-GTGCAGGGTCCGAGGT-3’;GADPH正向引物:5’-GGCATGGACTGTGGTCATGAG-3’,反向引物:5’-TGCACCACCAACTGTTAGC-3’;MRP正向引物:5’-CCCGCTCTGGGACTGGAA-3’,反向引物:5’-ACTTGTTCCGACGTGTCCTC-3’。以上实验均重复三次。
1.8 Western blot检测MRP的表达取处理好的细胞,加入RIPA裂解液后冰浴30 min使细胞充分裂解,120 000 r/min 4℃,离心10 min,取上清液,蛋白定量,SDS-PAGE电泳2 h,NC膜转膜2.5 h,室温用含5%脱脂奶粉的TBST封闭1 h,一抗MRP以1:2 000配制,β-actin以1:5 000配制,室温孵育4 h,TBST溶液洗3次,每次10 min,二抗以1:5 000稀释配制,室温孵育1 h,TBST溶液洗3次,每次10 min,曝光显影。
1.9 荧光素酶实验将稳定过表达miR-451的BGC-823、MKN-4耐药细胞株以及对照细胞株接种于24孔板(1.0×105个/孔)。24 h后,将pGL3-MRP-3’野生型以及突变型质粒转染稳定过表达的上述细胞,海参荧光素酶作为内参,24 h后检测荧光素酶活性差异。
1.10 CCK8检测细胞活力取稳定过表达miR-451的BGC-823、MKN-4耐药细胞株,接种于96孔板(2×103个/孔)中,每组设4个平行复孔。分别加入0、2、4、6、8、10 g/ml 5-Fu,48 h后避光加入20 μl CCK-8溶液,常规孵育2.5 h后,多功能酶标仪检测450 nm波长处的吸光度(A)值,计算细胞增殖能力。
1.11 统计学方法应用SPSS16.0软件进行统计分析,相关性分析符合Pearson相关性分析方法,计量数据用均数±标准差(x±s)表示,组间比较采用t检验,每组实验至少重复3次,P < 0.05为差异有统计学意义。
2 结果 2.1 miR-451在不同胃癌组织及胃癌细胞系中的表达RT-PCR检测结果显示耐药胃癌组织中miR-451表达量明显低于非耐药胃癌组织(P=0.00043)。胃癌细胞株MKN-4 miR-451相对表达量为9.26±1.02,MKN-28细胞系中miR-451相对表达量为63.42±6.84,见图 1。
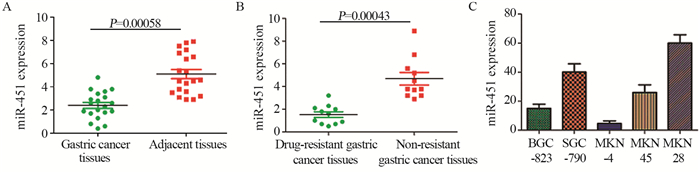
|
| 图 1 RT-PCR检测不同胃癌组织及细胞系中miR-451相对表达量 Figure 1 Relative expressions of miR-451 in different gastric cancer tissues and cell lines detected by RT-PCR |
构建miR-451稳定过表达MKN-4耐药细胞株,结果显示miR-451显著过表达。miR-451 inhibitor转染MKN-28耐药细胞株,结果显示miR-451表达明显受到抑制,见图 2A。在不同5-Fu浓度刺激下,过表达miR-451可明显降低耐药细胞的增殖能力,抑制miR-451表达可促进耐药细胞系的增殖能力,见图 2B。

|
| 图 2 RT-PCR检测miR-451的表达(A)及CCK8检测不同5-Fu浓度下胃癌细胞的增殖能力(B) Figure 2 miR-451 expression and proliferation ability of gastric cancer cells treated with different concentrations of 5-Fu detected by RT-PCR(A) and CCK8(B) |
miRBase、TargetScan、miRanda、miRDB生物数据库分析结果显示MRP为miR-451的靶基因,见图 3A。随之,构建MRP野生型以及突变型荧光报告质粒,见图 3B。荧光素酶报告实验证明,在转染野生型的双荧光报告质粒后,miR-451过表达使荧光素酶相对活性明显降低(P < 0.01),而突变型则无限制变化,见图 3C~D。以上结果证明miR-451靶向MRP的3’UTR。
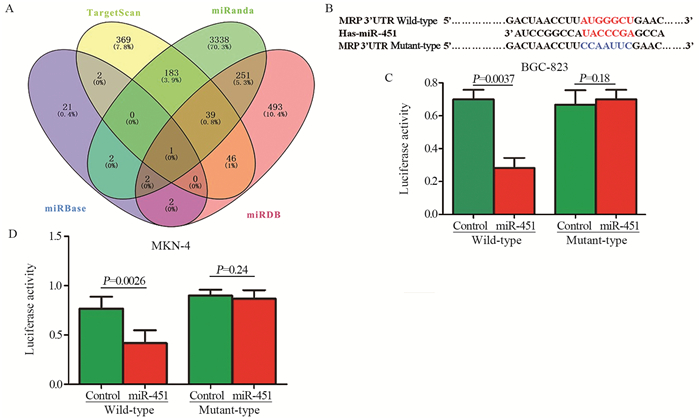
|
| A: Bioinformatics analysis results showed that MRP was the target gene of miR-451; B: We constructed 3'UTR wild-and mutant-type dual fluorescein reporter plasmids of MRP; C, D: miR-451 regulated the fluorescence activity of wild-type and mutant MRP reporter plasmids in BGC-823 and MKN-4 cells 图 3 miR-451的靶基因分析 Figure 3 Analysis of miR-451 target gene |
miR-451过表达可明显抑制MRP转录(P=0.00075),见图 4A。20例胃癌组织中miR-451以及MRP mRNA水平显著负相关,见图 4B。Western blot检测结果显示过表达miR-451可显著降低MRP蛋白水平(P=0.000045),而miR-451 inhibitor抑制miR-451表达后,其蛋白水平出现明显上调(P=0.00029),见图 4C。
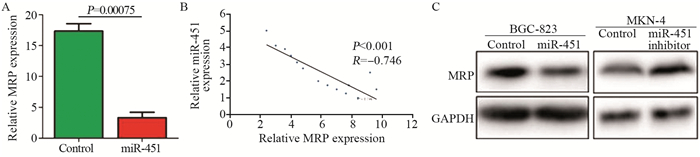
|
| 图 4 miR-451调控MRP的表达 Figure 4 miR-451 regulated MRP expression |
在稳定过表达miR-451的耐药细胞系BGC-283以及MKN-4中过表达MRP,Western blot实验证明了MRP的过表达效率(P=0.000062)。相对单一过表达miR-451的胃癌细胞系,miR-451可明显增加胃癌耐药细胞系BGC-283以及MKN-4对5-Fu的敏感度,其细胞增殖能力明显低于对照组;而CCK8检测结果显示,相对于单一过表达miR-451,过表达miR-451和MRP可明显增加细胞的增殖能力(P=0.00032),见图 5。说明MRP可增加胃癌细胞对5-Fu的耐受能力。
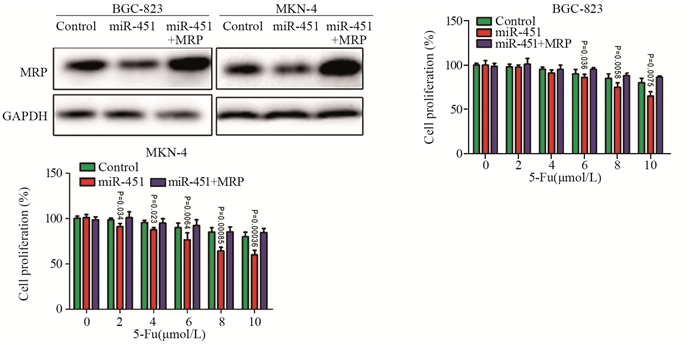
|
| 图 5 CCK8检测MRP对胃癌细胞增殖能力的影响 Figure 5 Effect of MRP on proliferation of gastric cancer cells detected by CCK8 assay |
药物抵抗是目前胃肠道肿瘤治疗的一大难题,现有的胃肠道肿瘤治疗方案难以进一步提高患者的生存期,开发新的药物靶点是肿瘤治疗的当务之急[6]。MicroRNA作为非编码RNA参与肿瘤细胞的增殖、分化以及凋亡,有文献证明了microRNA作为治疗靶点用于肿瘤等疾病的可行性[7]。Tsuchiya等[8]发现miR-451有助于上皮细胞基底外侧极性的形成。Ribeiro-dos-Santos等[9]通过高通量测序建立了人胃组织miRNA表达谱,结果发现miR-31、miR-9b、miR-148a以及miR-451在胃癌组织中高度表达,说明miR-451可作为药物治疗的靶点用于胃癌的辅助治疗。在非小细胞肺癌中,miR-451可通过抑制AKT信号通路的激活增加肺癌对顺铂的敏感度[10]。Liu等[11]发现过表达miR-451能够降低肺癌细胞对伊马替尼的耐药作用,提高TKI的疗效。此外,在乳腺癌中,他莫昔芬也可诱导miR-451的上调,降低肿瘤细胞的抵抗效果[12]。本研究发现,miR-451参与胃癌细胞对5-Fu的耐药作用。RT-PCR检测结果显示miR-451在非耐药胃癌中表达量高于耐药胃癌组织,CCK8实验显示miR-451参与调节胃癌细胞对5-Fu的耐药作用,证明miR-451可明显降低细胞对5-Fu的耐药性,并通过生物信息学分析的方法证明了耐药基因MRP为miR-451的靶基因,荧光素酶报告实验显示上调miR-451可明显抑制野生型MRP的荧光强度,RT-PCR以及Western blot实验验证了上调miR-451可抑制MRP的表达,而抑制miR-451可促进MRP的表达,表明miR-451通过与MRP的3'UTR结合直接调节其表达。MRP作为调节肿瘤细胞对各种药物的耐药作用已被证实,O'Meara等[13]发现MRP可能参与HIV耐药,MRP可通过影响抗HIV药物转运至转染的细胞中抑制药物对HIV的杀伤。Boumendjel等[14]发现MRP也可影响抗结核杆菌药物的转运,增加结核杆菌的耐药现象。以上说明MRP在耐药方面发挥广泛的作用。
本研究阐述了miR-451异常表达介导了胃癌细胞系对5-Fu的耐药作用,并通过生物信息学相关分析,证明了miR-451通过靶基因MRP影响胃癌细胞对5-Fu的耐药作用,为目前寻找胃癌耐药方面的治疗提供了新的思路以及依据。
作者贡献
高红艳:实验的可行性分析与实施,撰写和修改文章
郭洁,吴方雄:实验结果分析
刘锋瑞,王丽:实验质量控制及审校
| [1] |
Zhu ZM, Li ZR, Huang Y, et al. DJ-1 is involved in the peritoneal metastasis of gastric cancer through activation of the Akt signaling pathway[J]. Oncol Rep, 2014, 31(3): 1489-1497. DOI:10.3892/or.2013.2961 |
| [2] |
Fang Q, Chen XY, Zhi XT. Long Non-Coding RNA (LncRNA) Urothelial Carcinoma Associated 1 (UCA1) Increases Multi-Drug Resistance of Gastric Cancer via Downregulating miR-27b[J]. Med Sci Monit, 2016, 22: 3506-3513. DOI:10.12659/MSM.900688 |
| [3] |
Wong KM, Qiu X, Cheng D, et al. Two BRM promoter insertion polymorphisms increase the risk of early-stage upper aerodigestive tract cancers[J]. Cancer Med, 2014, 3(2): 426-433. DOI:10.1002/cam4.201 |
| [4] |
Xu X, Zhang Y, Li W, et al. Wogonin reverses multi-drug resistance of human myelogenous leukemia K562/A02 cells via downregulation of MRP1 expression by inhibiting Nrf2/ARE signaling pathway[J]. Biochem Pharmacol, 2014, 92(2): 220-234. DOI:10.1016/j.bcp.2014.09.008 |
| [5] |
Chen YL, Yang TY, Chen KC, et al. Hypoxia can impair doxorubicin resistance of non-small cell lung cancer cells by inhibiting MRP1 and P-gp expression and boosting the chemosensitizing effects of MRP1 and P-gp blockers[J]. Cell Oncol(Dordr), 2016, 39(5): 411-433. DOI:10.1007/s13402-016-0285-5 |
| [6] |
Syngal S, Brand RE, Church JM, et al. ACG Clinical Guideline: Genetic Testing and Management of Hereditary Gastrointestinal Cancer Syndromes[J]. Am J Gastroenterol, 2015, 110(2): 223-262. DOI:10.1038/ajg.2014.435 |
| [7] |
Ebrahimi S, Hashemy SI. MicroRNA-mediated redox regulation modulates therapy resistance in cancer cells: clinical perspectives[J]. Cell Oncol(Dordr), 2019, 42(2): 131-141. DOI:10.1007/s13402-018-00421-z |
| [8] |
Tsuchiya S, Oku M, Imanaka Y, et al. MicroRNA-338-3p and microRNA-451 contribute to the formation of basolateral polarity in epithelial cells[J]. Nucleic Acids Res, 2009, 37(11): 3821-3827. DOI:10.1093/nar/gkp255 |
| [9] |
Ribeiro-dos-Santos Â, Khayat AS, Silva A, et al. Ultra-Deep Sequencing Reveals the microRNA Expression Pattern of the Human Stomach[J]. PloS One, 2010, 5(10): e13205. DOI:10.1371/journal.pone.0013205 |
| [10] |
Goto A, Tanaka M, Yoshida M, et al. The low expression of miR-451 predicts a worse prognosis in non-small cell lung cancer cases[J]. PloS One, 2017, 12(7): e0181270. DOI:10.1371/journal.pone.0181270 |
| [11] |
Liu K, Tian H, Zhang Y, et al. miR-451 selectively increases sensitivity to cisplatin in ERCC1-high non-small cell lung cancer cells[J]. J Cell Biochem, 2018. |
| [12] |
Keshavarzi Z, Janghorban R, Alipour S, et al. The effect of vitamin D and E vaginal suppositories on tamoxifen-induced vaginal atrophy in women with breast cancer[J]. Support Care Cancer, 2019, 27(4): 1325-1334. DOI:10.1007/s00520-019-04684-6 |
| [13] |
O'Meara JA, Jakalian A, LaPlante S, et al. Scaffold hopping in the rational design of novel HIV-1 non-nucleoside reverse transcriptase inhibitors[J]. Bioorg Med Chem Lett, 2007, 17(12): 3362-3366. DOI:10.1016/j.bmcl.2007.03.097 |
| [14] |
Boumendjel A, Baubichon-Cortay H, Trompier D, et al. Anticancer multidrug resistance mediated by MRP1: Recent advances in the discovery of reversal agents[J]. Med Res Rev, 2005, 25(4): 453-472. DOI:10.1002/med.20032 |
 2019, Vol. 46
2019, Vol. 46


