文章信息
- 肺癌患者围手术期高凝状态的实验室指标特征及对深静脉血栓形成的诊断价值
- Characteristics of Laboratory Biomarkers Associated with Hypercoagulability in Lung Cancer Patients During Perioperative Period and Its Diagnostic Value for Deep Venous Thrombosis
- 肿瘤防治研究, 2019, 46(12): 1107-1112
- Cancer Research on Prevention and Treatment, 2019, 46(12): 1107-1112
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0591
- 收稿日期: 2019-05-07
- 修回日期: 2019-10-17
2. 610041 成都,四川省肿瘤研究所
2. Sichuan Cancer Institute, Chengdu 610041, China
肺癌患者术后发生肺栓塞(pulmonary embolism, PE)是静脉血栓栓塞症(venous thromboembolism, VTE)的最严重并发症,是肺癌外科术后猝死的第二位原因[1-2]。PE栓子主要源自下肢静脉系统的深静脉血栓形成(deep venous thrombosis, DVT)[2],因此准确预测DVT并采取积极预防措施就能有效防止发生PE。寻找可靠的实验室生物标志物来提高DVT的诊断效率一直是研究的热点。胸外科围手术期肺癌患者为VTE高危人群,但对DVT具有诊断价值的相关实验室指标研究仍较少,且多为回顾性资料,亦缺乏对其诊断价值的定量研究[3-4]。本研究通过前瞻性收集和分析胸外科肺癌患者围手术期高凝状态的实验室指标特征,以寻找与术后发生DVT相关的生物标志物并探讨其诊断价值,为临床防治VTE提供依据。
1 资料与方法 1.1 研究设计采用前瞻性队列研究,连续纳入2015年3月—2018年3月在四川省肿瘤医院胸外科同一治疗组接受手术治疗的肺癌患者,术后未预防性抗凝处理。所有患者围手术期行双下肢血管加压超声(compressed ultrasonic, CUS)筛查DVT,怀疑肺血管栓塞者行胸部CT。本研究通过了本院伦理委员会审批,患者及家属术前均签署知情同意书。
1.2 纳入与排除标准 1.2.1 纳入标准(1)病理证实为肺癌;(2)接受手术治疗;(3)既往无栓塞或抗凝病史;(4)围手术期无严重并发症;(5)术后均未预防性抗凝治疗。
1.2.2 排除标准(1)术后病理证实肺良性肿瘤者;(2)术前CUS证实DVT阳性者;(3)术后需再次手术者;(4)拒绝参加该临床试验者。
纳入者如果术前出现凝血相关指标值升高但凝血时间正常,则术前无需进行预防性抗凝处理。
1.3 VTE的诊断标准 1.3.1 PE诊断标准胸部增强CT扫描发现肺动脉及其分支内发现血凝块或动脉充盈缺损征象。
1.3.2 DVT诊断标准线阵式超声探头,探头频率在3.5~5.0 MHz之间,血管与声束取60°夹角,取样容积置于血管中央,在下肢静脉血管内发现新近出现血栓的直接征象,CDFI证实无血流信号。
1.4 实验室生物标志物的测定 1.4.1 生物标志物凝血指标:D-二聚体(D-Dimer)、纤维蛋白原(FIB)、纤维蛋白原降解产物(FDP)、凝血酶原时间(PT)、国际标准化比值(INR)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT);血计数:白细胞(WBC)、中性粒细胞数(Neu)、中性粒细胞百分比(N%)、红细胞(RBC)、血红蛋白(HGB)、红细胞比容(HCT)、平均红细胞体积(MCV)、平均红细胞血红蛋白(MCH)、血小板(PLT)、平均血小板体积(MPV)、血小板分布宽度(PDW)、血小板压积(PCT)、超敏C反应蛋白(CRP);生化指标:总蛋白(TP)、白蛋白(ALB)、血糖(Glu)、脑钠肽(BNP)、肌钙蛋白I(CTnI)。测定时点:术前(术前72 h内,Pre-op)、术后第1天(POD1),术后第3天(POD3),术后第7天(POD7)。血标本:晨起空腹静脉血,D-Dimer检测方法采用免疫比浊法。
1.4.2 仪器设备全自动血细胞分析仪(XT-1800i,日本希森美康医用电子有限公司生产)、全自动生化分析仪(CS-600A,长春迪瑞医疗科技股份有限公司)、全自动血凝仪分析仪(SF-8100,北京赛科西德公司)、全自动酶标仪(RT-6100,深圳雷杜公司)。
1.5 统计学方法采用SPSS22.0统计软件分析均数,均数比较和围手术期指标术前与术后各时点比较采用重复测量数据方差分析。Sigmaplot13.0统计软件分析ROC曲线。0.5 < AUC≤0.7表示诊断价值较低,0.7 < AUC≤0.9诊断价值中等,AUC > 0.9表示诊断价值高。根据约登指数确定截断值(Cut off)。诊断一致性评价采用Kappa值(κ):κ=(PA-Pe)/(1-Pe),PA为彩超金标准与截断值诊断的观察一致性,Pe为彩超金标准与截断值诊断的机遇一致性。κ≤0.4时表明一致性较差。串联试验联合诊断的敏感度(Sen)=SenA×SenB×SenC,特异度(Spe)= SpeA+(1-SpeA)×SpeB。P < 0.05为差异有统计学意义。
2 结果术前共招募181名拟诊肺癌患者,术后不符合纳入标准者38例予排除,最终143例肺癌患者入选本研究。其中男91例、女52例,年龄26~79岁,平均年龄(58.7±9.7)岁。术后DVT发生率23.1%(33/143),无PE发生。
2.1 肺癌患者围手术期凝血指标、BNP、CTnI及CRP变化特征与术前水平相比,全组患者术后第1~7日PT延长,TT缩短(P < 0.05);APTT在术后第1~3日延长(P < 0.05),术后第7日恢复至术前水平;FIB术后第3~7天明显升高(P < 0.05);FDP、D-Dimmer、CRP和BNP在术后第1~7天均明显升高(P < 0.05);PLT和PCT水平在术后第1~3日下降,第7日PLT明显增高,PCT恢复正常,见表 1。
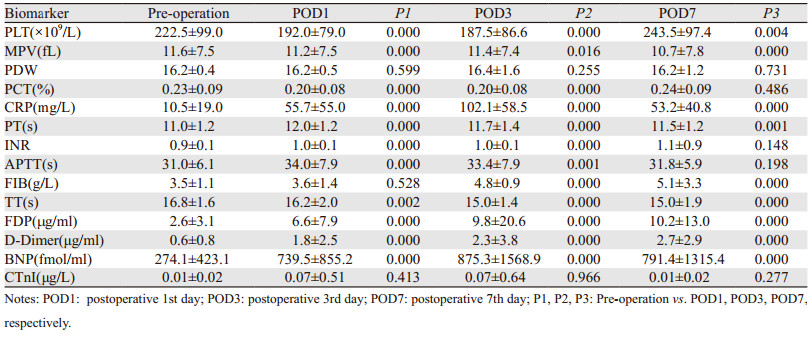
|
DVT(+)与DVT(-)组内除MCH、PDW、INR和CTnI外,其余各指标在围手术期不同时点之间的水平差异均有统计学意义(P < 0.05),其中FDP和D-Dimer在DVT(+)与DVT(-)组间围手术期变化水平的差异有统计学意义(P < 0.05),见表 2。
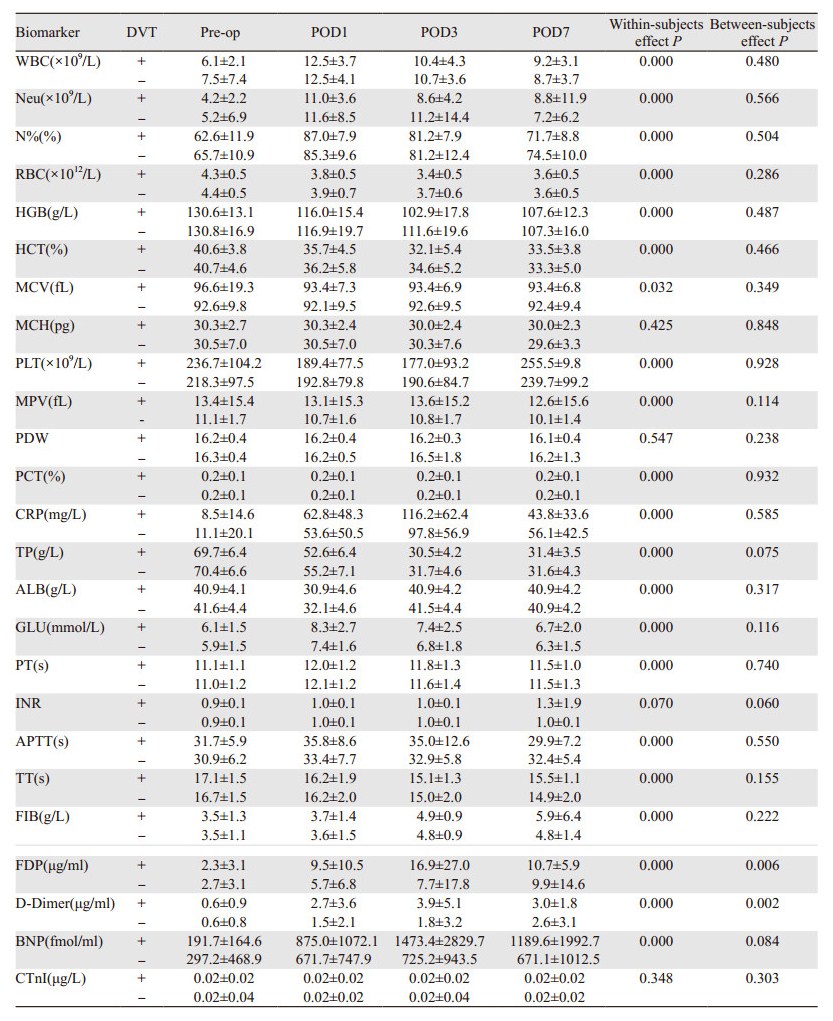
|
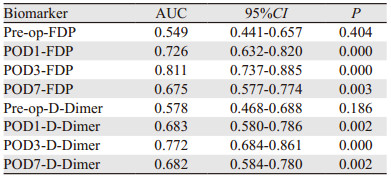
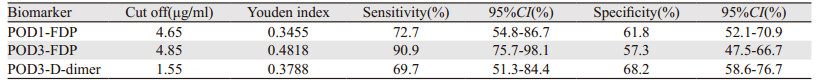
表 2分析结果可见围手术期FDP和D-Dimer各时点的水平与术后合并DVT相关,其AUC分析见表 3。从表中可见,Pre-op-FDP、POD7-FDP、Pre-op-D-Dimer、POD1-D-Dimer和POD7-D-Dimer的诊断价值较低,POD1-FDP、POD3-FDP和POD3-D-Dimer的诊断价值中等,其ROC曲线下面积见图 1,诊断界值见表 4。根据此诊断界值,POD1-FDP、POD3-FDP和POD3-D-Dimer的阳性预测值及阴性预测值分别为36.61%、88.44%,40.0%、95.6%和40.02%、88.37%。
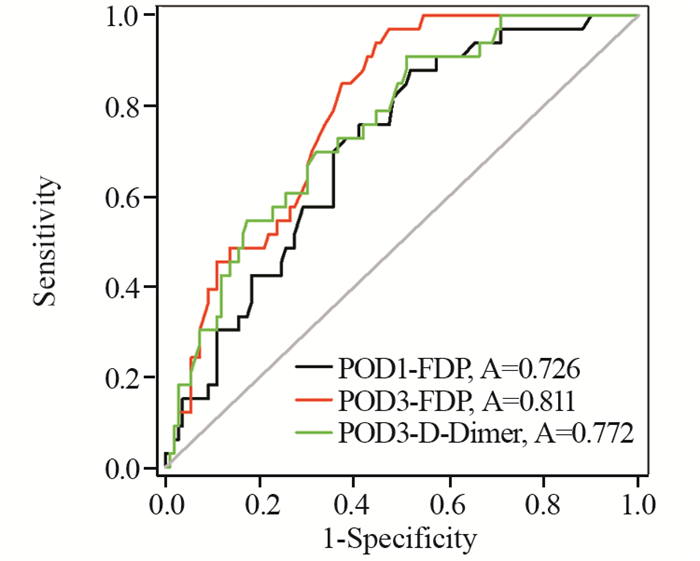
|
| 图 1 POD1-FDP、POD3-FDP和POD3-D-Dimer ROC曲线 Figure 1 ROC curves of POD1-FDP, POD3-FDP and POD3-D-Dimer |
(1)POD1-FDP(截断值为4.65 μg/ml)的诊断一致性评价:PA=(24+68)/143=0.6434,Pe=(33×66+110×77)/1432=0.5207,к=0.26≤0.4,表明诊断一致性较差;(2)POD3-FDP(截断值为4.85 μg/ml)的诊断一致性评价:PA=(30+65)/143=0.6643,Pe=(33×75+110×68)/1432=0.4868,к=0.35≤0.4,表明诊断一致性较差;(3)POD3-D-Dimer(截断值为1.55 μg/ml)的诊断一致性评价:PA=(23+75)/143=0.6853,Pe=(33×58+110×85)/1432=0.5508,к=0.30≤0.4,其诊断一致性仍不理想;(4)串联试验:鉴于本研究中大多数DVT为小栓子(肌间静脉血栓),而这类远端DVT的危险性并不大;同时这三个有意义的实验室指标为术后不同时点,临床意义以提高诊断试验特异度为目的,即提高阳性预测值,减少患者不必要的彩超检查,故采用串联试验更有实际临床价值。本串联试验的敏感度为46.5%,特异度为94.9%,故此三项指标串联试验显著提高了DVT诊断的特异度。
3 讨论一直以来肿瘤学者不断开展能预测癌症患者VTE发生的生物标志物研究[5-6]。这主要是因为大约50%DVT患者无任何症状,仅靠症状进行诊断非常困难。通过检测某项生物标志物超过截断值来筛选患者并进行影像学检查则可提高诊断效率。目前有关肺癌预测VTE的生物标志物研究并不少,但胸外科肺癌围手术期背景下此类研究仍较少。肺癌手术可引起肢体低灌注、组织损伤等因素激活凝血系统;另一方面术后长时间卧床导致血液缓慢淤滞,中心静脉管道等因素激发凝血倾向,最终引起血液中生物标志物的水平如何变化以及与VTE发生风险的关系,需要进一步评价。事实上肺癌围手术期发生无症状性DVT,本身并不适用非外科临床条件下相关生物标志物的诊断界值,这些特殊性均需要对此进一步研究。
几项有关预测肺癌VTE发生的生物标志物系统评价研究表明,D-Dimer、EGFR、血小板计数、血红蛋白、白细胞计数、CRP是最常见的研究指标[7-8],其他指标还有P-选择素、微粒体等[9],其中D-Dimer是研究最热的生物标志物。本研究结果显示,胸外科肺癌手术后大多数凝血指标都有显著变化,表现为TT术后1~7天明显缩短,尤其FDP、D-Dimer术后持续升高,同时BNP和CRP术后也持续升高,说明肺癌术后不但一直存在血液高凝状态的基础,也存在心血管系统和炎性反应的病理生理条件,均增加术后VTE高危风险因素。Kadlec等[10]观察到肺癌患者PLT明显升高与VTE事件相关,但本研究提示PLT不是肺癌术后DVT相关生物标志物。研究显示FDP和D-Dimer围手术期变化水平在两组的差异有统计学意义,提示可能与DVT发生相关。ROC曲线下面积分析显示,只有术后第1天FDP和术后第3天FDP及D-Dimer的监测水平具有中等诊断价值,这符合肺癌患者术后高凝状态的特征,与国内的一项研究结论相似[11]。为提高诊断效率,近年来有研究尝试采用与VTE临床评估量表联合进行判断[12-13]。例如,当VTE的临床评估为低、中风险时,截断值为阴性(< 0.5 mg/L FEU),即可排除DVT和PE,无需进一步做影像学检查。Pabinger等[14]将Khorana评分表中最重要项目恶性实体肿瘤部位与D-Dimer浓度结合来预测,结果显示当D-Dimer浓度升高两倍时这种整合模型可以明显提高预测效率。赵灿等[15]的研究显示,按年龄校正的血浆D-Dimer临界值(年龄×10 μg/ml)联合二分类Wells量表可提高50岁以上肺栓塞患者诊断的特异度,且未明显降低敏感度。
D-Dimer是反映机体高凝状态的敏感指标,相同疾病下不同的临床血栓形成条件或不同的测定方法,检测水平也会发生变化,因此采取统一的诊断界值是不合适的。欧美和我国人群存在体质差异,国外得出的诊断界值不一定适合我国的情况。一项来自欧洲维也纳癌症和血栓研究项目的报道显示,诊断75%检测人群患VTE的D-Dimer界值为1.8 μg/ml(95%CI: 1.0~3.0 μg/ml),但这项研究中仅有14%患者为肺癌[16]。国内学者对血浆D-Dimer诊断肺癌合并肺栓塞的研究显示,年龄校正后最佳临界值为2 835 μg/L,对应的灵敏度和特异度分别为62.9%和92.3%,阳性预测值为81.5%,阴性预测值为82.3%,准确率为82.0%[17]。目前尚未见肺癌患者术后VTE相关指标诊断界值的研究报道。本研究结果显示,肺癌外科围手术期与预测DVT明显相关的生物标志物是术后第1天及第3天的FDP和术后第3天的D-Dimer增高水平,其诊断界值分别为4.65 μg/ml、4.85 μg/ml和1.55 μg/ml,与以上研究报道的界值水平有明显差别。同时本研究这三项指标的ROC曲线下面积的结果均未超过0.9,表明其诊断价值中等,一致性评价结果也显示这三个指标诊断一致性较差,判定单独其中一项指标并不是预测DVT的理想生物标志物。如果将这三项指标进行联合串联诊断,则可以将诊断特异度提高到94.9%。Jara-Palomares等[18]尝试将D-Dimer(> 600 ng/ml)联合超敏CRP水平(4.5 mg/L)预测癌相关性VTE发生,结果显示较单一D-Dimer指标未提高特异度,而我们并未发现CRP水平增高与DVT相关。
总之,本研究表明肺癌患者术后即持续存在血液高凝状态,术后应常规采取抗凝预防措施。术后第1天及第3天FDP和术后第3天D-Dimmer水平增高对于DVT的诊断价值中等,串联试验可明显提高诊断特异度,对提高VTE防治效率具有参考价值。本研究样本量不大,且本组无PE患者,可能影响对整体VTE诊断价值的判断,故仍需扩大样本量及增加多中心研究以进一步验证。
作者贡献
方 强:选题、实验设计、数据资料收集、数据统计分析及论文撰写
黄建鸣:实验实施、数据统计分析
王康宁:实验实施、文献检索及分析、数据录入
周 红:实验实施
韩泳涛:选题、实验设计、实验管理、审校
| [1] |
Wang Z, Pei C, Ma L, et al. Acute pulmonary embolism after pneumonectomy[J]. J Thoracic Dis, 2012, 4(1): 76-82. |
| [2] |
Hwang HG, Schulman S. Respiratory review of 2013: pulmonary thromboembolism[J]. Tuberc Respir Dis(Seoul), 2013, 75(3): 89-94. DOI:10.4046/trd.2013.75.3.89 |
| [3] |
崔松平, 李辉, 田博, 等. 肺癌术后静脉血栓栓塞症相关危险因素分析:单中心研究[J]. 中国肺癌杂志, 2018, 21(10): 753-760. [Cui SP, Li H, Tian B, et al. Risk Factors Associated with Venous Thromboembolism after Lung Cancer Surgery:A Single-center Study[J]. Zhongguo Fei Ai Za Zhi, 2018, 21(10): 753-760. DOI:10.3779/j.issn.1009-3419.2018.10.04] |
| [4] |
Yang Y, Zhou Z, Niu XM, et al. Clinical analysis of postoperative venous thromboembolism risk factors in lung cancer patients[J]. J Surg Oncol, 2012, 106(6): 736-741. DOI:10.1002/jso.23190 |
| [5] |
Pabinger I, Thaler J, Ay C. Biomarkers for prediction of venous thromboembolism in cancer[J]. Blood, 2013, 122(12): 2011-2018. DOI:10.1182/blood-2013-04-460147 |
| [6] |
刘振华, 崔同建, 陈峥, 等. 恶性肿瘤并发深静脉血栓形成33例诊治分析[J]. 肿瘤防治研究, 2012, 39(5): 570-572. [Liu ZH, Cui TJ, Chen Z, et al. Clinical study on 33 cases of malignant tumor complicated with venous thrombotic embolism[J]. Zhong Liu Fang Zhi Yan Jiu, 2012, 39(5): 570-572. DOI:10.3971/j.issn.1000-8578.2012.05.019] |
| [7] |
Alexander M, Burbury K. A systematic review of biomarkers for the prediction of thromboembolism in lung cancer-Results, practical issues and proposed strategies for future risk prediction models[J]. Thromb Res, 2016, 148: 63-69. DOI:10.1016/j.thromres.2016.10.020 |
| [8] |
Vitale C, D'Amato M, Calabrò P, et al. Venous thromboembolism and lung cancer: a review[J]. Multidiscip Respir Med, 2015, 10(1): 28. DOI:10.1186/s40248-015-0021-4 |
| [9] |
Ghozlan MF, Osman AA, Mahmoud HM, et al. Comprehensive study on laboratory biomarkers for prediction and diagnosis of deep venous thrombosis[J]. Blood Coagulation Fibrinolysis, 2015, 26(3): 255-260. DOI:10.1097/MBC.0000000000000164 |
| [10] |
Kadlec B, Skrickova J, Merta Z, et al. The incidence and predictors of thromboembolic events in patients with lung cancer[J]. Scientific World J, 2014, 2014: 125706. |
| [11] |
Tian B, Song C, Li H, et al. The significance of perioperative coagulation and fibrinolysis related parameters after lung surgery for predicting venous thromboembolism: a prospective, single center study[J]. J Thorac Dis, 2018, 10(4): 2223-2230. DOI:10.21037/jtd.2018.03.174 |
| [12] |
van Es N, Kraaijpoel N, Klok FA, et al. The original and simplifiedWellsrules and age-adjustedD-dimertesting to rule out pulmonary embolism: an individual patient data meta-analysis[J]. J Thromb Haemost, 2017, 15(4): 678-684. DOI:10.1111/jth.13630 |
| [13] |
Mousa AY, Broce M, De Wit D, et al. Appropriate Use ofVenousImaging and Analysis of theD-Dimer/Clinical Probability Testing Paradigm in the Diagnosis and Location ofDeep Venous Thrombosis[J]. Ann Vasc Surg, 2018, 50: 21-29. DOI:10.1016/j.avsg.2017.12.006 |
| [14] |
Pabinger I, van Es N, Heinze G, et al. A clinical prediction model for cancer-associated venous thromboembolism: a development and validation study in two independent prospective cohorts[J]. Lancet Haematol, 2018, 5(7): e289-e298. DOI:10.1016/S2352-3026(18)30063-2 |
| [15] |
赵灿, 胡京敏, 赵丹杰. 血浆D-二聚体临界值联合Wells量表对可疑肺栓塞的除外价值[J]. 北京大学学报(医学版), 2018, 50(5): 828-832. [Zhao C, Hu JM, Guo DJ. Diagnostic value of D-dimer combined with Wells score for suspected pulmonary embolism[J]. Beijing Da Xue Xue Bao(Yi Xue Ban), 2018, 50(5): 828-832.] |
| [16] |
Ay C, Vormittag R, Dunkler D, et al. D-Dimer and Prothrombin Fragment 1+2 Predict Venous Thromboembolism in Patients With Cancer: Results From the Vienna Cancer and Thrombosis Study[J]. J Clin Oncol, 2009, 27(25): 4124-4129. DOI:10.1200/JCO.2008.21.7752 |
| [17] |
万静萱, 李红红, 杨叶梦, 等. 血浆D-二聚体诊断肺癌合并肺栓塞的最佳临界值研究[J]. 中国全科医学, 2018, 21(10): 1212-1215. [Wan JX, Li HH, Yang YM, et al. Optimal Cut-off Value of Plasma D-dimer in the Diagnosis of Pulmonary Embolism in Lung Cancer Patients[J]. Zhongguo Quan Ke Yi Xue, 2018, 21(10): 1212-1216. DOI:10.3969/j.issn.1007-9572.2018.10.014] |
| [18] |
Jara-Palomares L, Solier-Lopez A, Elias-Hernandez T, et al. D-dimer and high-sensitivity C-reactive protein levels to predict venous thromboembolism recurrence after discontinuation of anticoagulation for cancer-associated thrombosis[J]. Br J Cancer, 2018, 119(8): 915-921. DOI:10.1038/s41416-018-0269-5 |
 2019, Vol. 46
2019, Vol. 46