文章信息
- 初诊Ⅳ期乳腺癌的临床病理特征及预后分析
- Clinicopathologic Characteristics and Prognosis of De Novo Metastatic Breast Cancer Patients
- 肿瘤防治研究, 2019, 46(11): 998-1005
- Cancer Research on Prevention and Treatment, 2019, 46(11): 998-1005
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0543
- 收稿日期: 2019-04-28
- 修回日期: 2019-08-12
在中国乳腺癌发病率居女性常见的恶性肿瘤首位,死亡率居第二,仅次于肺癌[1]。临床研究表明,20%~30%早期乳腺癌会出现复发转移而进展为晚期乳腺癌,即复发转移性乳腺癌(recurrent metastatic breast cancer, rMBC),而3%~10%乳腺癌患者在初次诊断时即有远处转移,即初诊Ⅳ期乳腺癌(de novo metastatic breast cancer, DnMBC)[2-3];不同于早期乳腺癌,转移性乳腺癌的治疗旨在延长患者生存时间、提高生存质量,而初诊Ⅳ期乳腺癌患者往往初诊时已失去手术根治机会,其精神、心理和生活质量均受到严重影响,同时,由于其具有特殊的临床病理学特征,且在晚期乳腺癌中的比率呈逐年上升的趋势[4],越来越受到临床医生的关注。本回顾性研究旨在了解初诊Ⅳ期乳腺癌患者的临床病理学特征,并探讨其预后影响因素,以期为临床诊疗提供一定的指导意见。
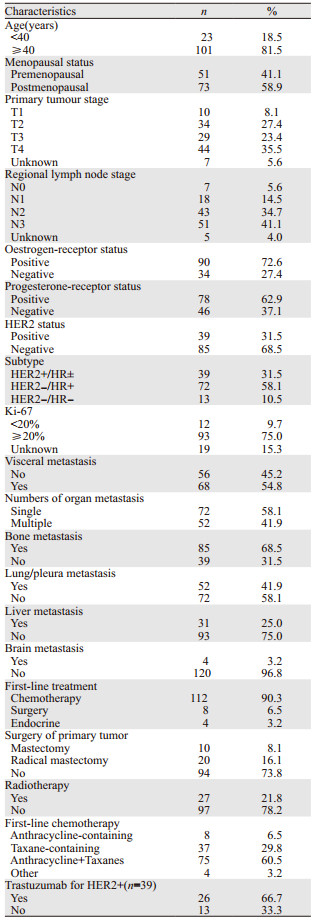
1 资料与方法 1.1 资料收集2011年1月—2016年12月天津医科大学肿瘤医院收治的124例初诊Ⅳ期乳腺癌患者,占同期收治的1 060例晚期乳腺癌患者的11.7%。研究者入选标准:(1)女性;(2)经病理学或影像学诊断的单侧乳腺癌并且初次诊断时即有远处转移;(3)有相对完整的临床病理学资料,包括发病年龄、原发肿瘤大小、腋窝淋巴结分期、Ki-67表达水平、激素受体状态、HER2表达情况、转移及治疗情况等;(4)随访资料完整。病例排除标准:男性乳腺癌、早期或局部晚期乳腺癌、原发性双乳癌、合并其他恶性肿瘤、临床病理资料不完整、失访等。经查CA153、CA125、CEA及TPSA等指标,尚未发现初治Ⅳ期患者与其他乳腺癌患者有差异,可能有待进一步积累病例统计。本研究通过本院医学伦理委员会批准,且所有患者已签署知情同意书。
1.2 定义根据AJCC第七版TNM分期指南标准,对初次诊断为乳腺癌的患者进行分期,Ⅳ期者即定义为初诊Ⅳ期乳腺癌[5]。采用免疫组织化学法对雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR)进行检测,核染色阳性率≥1%定义为阳性,ER和(或)PR阳性定义为激素受体(hormone receptor, HR)阳性乳腺癌。根据美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)和美国病理学家协会(College of American Pathologists, CAP)指南推荐的评分系统进行人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)评价,免疫组织化学染色结果为0或1+为阴性,3+为阳性,2+则进行荧光原位杂交(fluorescence in situ hybridization, FISH)检测,FISH阳性即判定为HER2阳性,若因故未作FISH,则归为阴性组。
1.3 随访采用门诊复查、住院检查或电话询问等方式对患者进行随访。随访截止时间为2018年11月30日或患者死亡时间。无进展生存期(progression-free survival, PFS)指从初诊至肿瘤进展或死亡时间,总生存期(overall survival, OS)是指从初诊至死亡或随访截止时间。计算1、3年PFS和3、5年OS。
1.4 统计学方法采用SPSS25.0统计软件进行分析,GraphPad Prism7软件进行绘图,用卡方检验进行频数资料组间比较,用Kaplan-Meier法进行生存估计,Log-rank统计进行单因素分析,Cox回归方法进行多因素分析,P值均为双侧值,P < 0.05为差异有统计学意义。
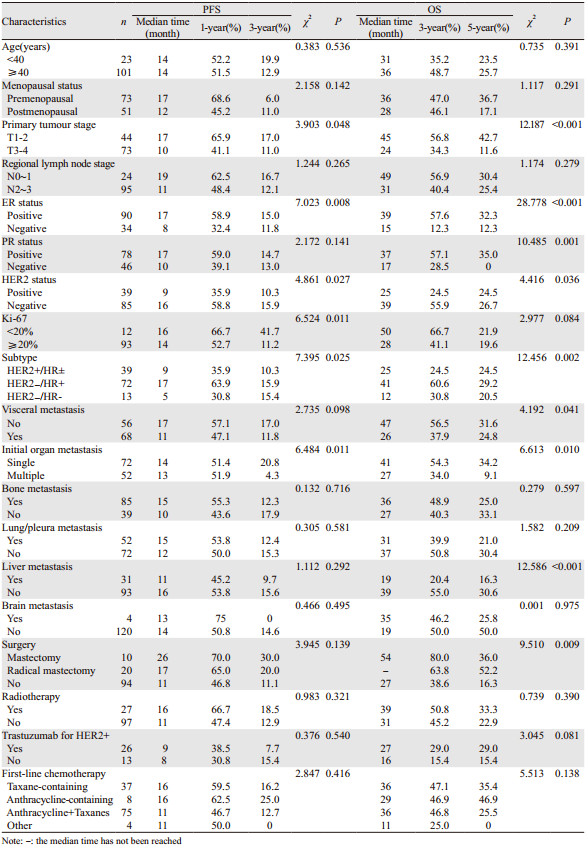
2 结果 2.1 临床病理特征及治疗方式124例初诊Ⅳ期乳腺癌患者中位年龄为53(26~77)岁。接受手术治疗的患者30例,其中8例在解救化疗前接受手术治疗,其余22例患者在接受不同周期数解救化疗后再接受手术治疗,接受手术的平均时间点为确诊乳腺癌后8.5(0~22)月,见表 1。
|
124例患者中位随访时间29(2~88)月,中位PFS为14(10.6~17.4)月,1年和3年PFS分别为51.6%和14.1%,中位OS为35(29.1~40.9)月,3年和5年OS分别为46.1%和25.8%,见图 1。

|
| 图 1 初诊Ⅳ期乳腺癌患者PFS和OS曲线 Figure 1 Kaplan-Meier curves of PFS and OS of de novo DnMBC patients |
单因素分析结果显示,原发肿瘤T分期、ER状态、HER2表达情况、Ki-67指数、分子分型以及首发转移器官数目与患者PFS相关(P < 0.05),原发肿瘤T分期、ER状态、PR状态、HER2表达情况、分子分型、首发转移器官数目、是否内脏转移、是否肝转移以及是否进行乳腺原发肿瘤手术与患者OS相关(P < 0.05),见表 2。
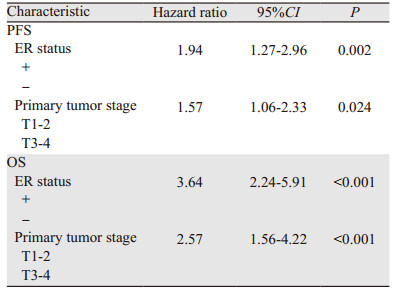
Cox多因素分析结果显示,HR(hazard ratio) > 1表示复发死亡风险增加,其中,ER状态及原发肿瘤T分期为初诊Ⅳ期乳腺癌患者PFS及OS的独立影响因素(P < 0.05),见表 3。
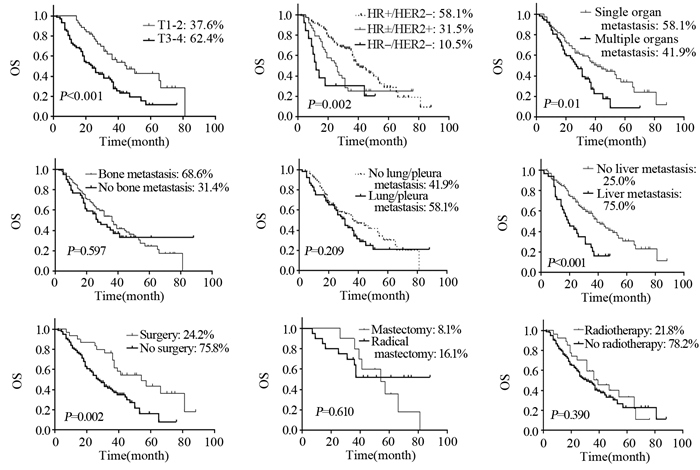
根据患者的原发肿瘤T分期、不同分子分型、首发转移器官数目、是否骨转移、是否肺/胸膜转移、是否肝转移、手术治疗情况及放疗情况等因素对OS的影响进行亚组分析,各亚组间生存曲线见图 2。
|
| 图 2 初诊Ⅳ期乳腺癌各亚组OS分析 Figure 2 Kaplan-Meier OS curves of each subgroup of de novo DnMBC patients |
相比于其他两组,HR±/HER2+组更易发生肝转移,差异有统计学意义(P=0.003);HR+/HER2-组患者更易发生骨、肺/胸膜转移,HR±/HER2+组患者更易发生多发器官转移,但差异无统计学意义,见表 4。
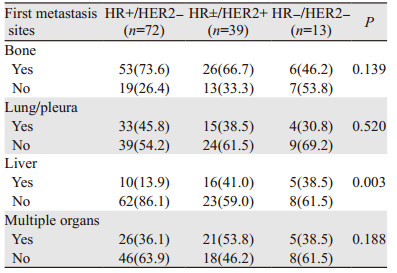
|
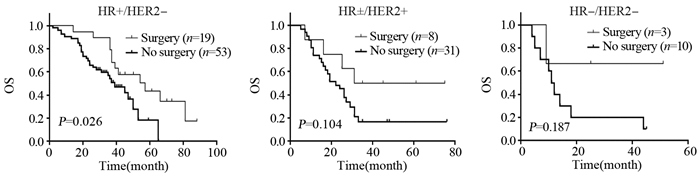
接受手术治疗的多为HR+/HER2-组患者,但与HR±/HER2+及HR-/HER2-相比,OS差异无统计学意义(P=0.784)。HR+/HER2-组中,接受手术治疗的患者OS优于未行手术治疗者,且差异有统计学意义(P=0.026),HR±/HER2+、HR-/HER2-组中,是否接受手术治疗对OS无明显影响,见图 3。
|
| 图 3 初诊Ⅳ期乳腺癌不同分子分型手术治疗情况的OS曲线 Figure 3 OS curves of de novo DnMBC patients with different molecular subtypes and surgical treatment |
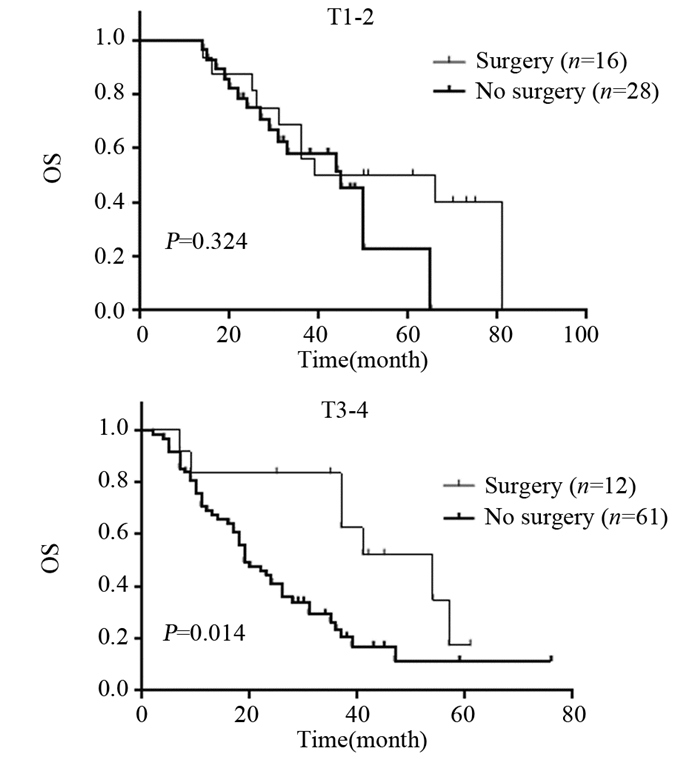
T1-2期患者接受手术治疗的比例高于T3-4期患者,差异有统计学意义(P=0.014)。T1-2期组中,是否接受手术治疗对OS无明显影响(P=0.324);T3-4期组中,接受手术治疗的患者OS优于未行手术治疗者,且差异有统计学意义(P=0.014),见图 4。
|
| 图 4 初诊Ⅳ期乳腺癌不同原发肿瘤T分期患者手术治疗情况的OS分析 Figure 4 OS curves of de novo DnMBC patients with different T staging and surgical treatment |
近年来,中国乳腺癌发病率呈逐年上升趋势。据估计,3%~10%的晚期乳腺癌患者为初诊Ⅳ期乳腺癌[2-3],相比于早期乳腺癌发生复发转移者,此类患者有其独特的特征[4]。
一项2006—2010年关于亚洲初诊Ⅳ期乳腺癌患者的研究报道发现其临床病理特征更具侵袭性,即肿瘤体积偏大、多发器官及内脏转移比例偏高[6];Andre等[7]也得出了类似的结论。本研究通过对2011—2016年共124例初诊Ⅳ期患者的临床病理特征及治疗方式进行分析归纳,发现HER2+比例高达31.5%,绝经后患者及肿瘤T4期患者占比更高,75%的患者Ki-67≥20%,41.9%的患者发生多器官转移,54.8%的患者发生内脏转移,验证了初诊Ⅳ期乳腺癌具有更高的侵袭性的特点;同时,本研究也发现,同Bhoo-Pathy[6]、Leone等[8]报道相似,初诊Ⅳ期乳腺癌患者激素受体阳性占比亦高,其中ER+者72.6%,PR+者62.9%,此特点使激素治疗成为可能,为更多的患者增加了治疗方法,或许与其较好的预后相关。本研究中90%以上的患者初始即接受解救化疗,化疗所占比例显著高于Cortesi等[9]相关报道;考虑到各地区人群的传统观念不同,中国人更追求积极全面的治疗,从而能够长期存活,而西方人群因更追求高质量的生活而顾及到化疗不良反应,故可能导致上述治疗差异的产生,同时,本研究时间更近,其治疗方法更能体现当下尽早积极治疗的原则。因此,基于以上研究结果,我们认为对于肿瘤较大、Ki-67高表达、绝经后的乳腺癌初诊患者应加强内脏器官的排查,避免遗漏,尽可能做到早诊断、早干预,从而延长远期生存。
研究报道,转移性乳腺癌患者的中位生存时间为2~3年[10-13];Andre等[7]报道了1987—1993年初诊Ⅳ期乳腺癌患者的中位生存时间为23月,1994—2000年为29月,其中,近50%的患者为多发器官转移,50%以上的患者发生内脏转移;Bhoo-Pathy等[6]报道了2001—2005及2006—2010年初诊Ⅳ期乳腺癌患者的中位生存时间分别为18、21月,其中大部分患者肿瘤直径 > 5 cm,多发器官转移及内脏转移比例偏高;本研究中,2011—2016年初诊Ⅳ期乳腺癌患者的中位生存时间为35月,5年OS为25.8%,较以往研究更长。本研究预后相对较好,考虑以下几点原因:(1)本研究中患者肿瘤负荷相对较低;(2)近年来新药的不断问世及治疗原则的规范化、个体化,本研究约90%以上的患者进行了紫杉或蒽环类的解救化疗。相关研究存在的预后差异可能与研究对象的地域、种族及治疗手段等因素的不同有关。
本研究多因素分析显示:ER阴性、原发肿瘤分期为T3-4期为初诊Ⅳ期乳腺癌预后不良的独立影响因素;Andre等[7]指出,激素受体阴性、多发部位转移、累及内脏等是初诊Ⅳ期乳腺癌患者预后不良的危险因素,Cortesi等[9]指出HR阴性、未接受化疗等为预后不良的影响因素。由于本研究中约90%以上的患者均接受一线解救化疗,因此是否化疗对预后的影响在本研究中尚未体现;同时,虽然内脏器官、多发器官转移患者的预后逊于非内脏器官、单发转移的患者,但并非独立预后影响因素。
原发肿瘤手术治疗是否能使初诊Ⅳ期患者获益,各研究不尽相同。一些研究认为,手术切除原发肿瘤可以改善转移性乳腺癌患者的预后[14-17];MF07-01随机试验显示,中位随访40月时,局部治疗联合化疗与单纯化疗相比,总生存期更长,而这种获益尤其体现在HR+、HER2-、单纯骨转移、年龄 < 55岁等患者中[14];也有研究指出原发肿瘤手术治疗未能给发生远处转移的乳腺癌患者带来生存获益[18-19];前瞻性试验TBCRC 013指出,对于一线化疗有反应者,是否进行原发肿瘤手术治疗对预后无影响[19];本研究中,局部手术治疗明显延长了患者总生存,中位OS较未手术者提高了27月,差异有统计学意义;考虑到接受手术治疗的患者一般情况较好、大部分为HR+/HER2-、肿瘤偏小(T1-2期),故良好的预后也不排除此方面的影响;同时,在不同分子分型组中,HR+/HER2-组患者手术治疗对预后改善明显,接受手术治疗的患者OS更长;在不同肿瘤大小中,T3-4期组患者手术治疗效果更好。故我们认为对于HR+/HER2-、肿瘤较大(T3-4期)的初诊Ⅳ期乳腺癌患者,若一般情况允许,可以考虑进行原发肿瘤的姑息性手术切除治疗。目前为止,尚未有指南明确建议初诊Ⅳ期乳腺癌患者进行姑息性减瘤术,还有待大样本、前瞻性的研究进一步指导治疗。
化疗及抗HER2靶向治疗在转移性乳腺癌患者的治疗中至关重要,并且影响预后。近年来,紫杉类药物使用率的提高、蒽环类及紫杉类药物联用的增加明显改善了患者的预后[9];研究指出,HER2阳性转移性乳腺癌患者接受曲妥珠单抗治疗较未接受曲妥珠单抗者显著延长了PFS及OS[9, 20-21],也有研究报道[16, 22-23]与之相反。本研究显示,约66.7%的HER2阳性乳腺癌患者应用了曲妥珠单抗靶向治疗,与未接受靶向治疗者相比,中位OS延长了11月,3年及5年OS均提高了13.6%;同时,接受原发部位或转移部位放疗的患者较未行放疗者相比,预后相对较好,但差异无统计学意义,可能与接受放疗人数相对较少有关,从而不能很好地体现出差异。
各分子亚型中,对于转移性乳腺癌转移后总生存的报道结果各不相同,有文献指出三阴型乳腺癌患者预后最差[7, 10, 13, 24-26]。本研究中,对于初诊Ⅳ期乳腺癌患者,HR+/HER2-亚型预后最佳,HR±/HER2+次之,HR-/HER2-预后最差。三阴型患者较差的预后可能与缺乏相应的激素治疗及靶向治疗位点有关。在不同转移器官数目组中,多发器官转移者的预后明显差于单发器官转移者,中位OS降低了14月,5年OS率降低了25.1%;是否发生骨、肺/胸膜转移对预后影响无明显差异,而发生肝转移的患者预后显著差于未累及肝脏者,中位OS降低了20月,5年OS率降低了14.3%。与Saraf等[27]报道类似,本研究发现HR±/HER2+患者更易发生多器官转移及肝转移,与其较差的预后或许也存在一定关系,故我们认为对于HER2+初诊Ⅳ期患者更应该加强内脏器官复查,避免遗漏内脏转移尤其是肝转移。
综上所述,初诊Ⅳ期乳腺癌患者肿瘤负荷较大,并有较高的再进展风险,姑息性手术治疗有可能改善HR+/HER2-、肿瘤较大患者的预后,因此,根据需要进行积极的个体化治疗尤为重要。同时,本研究也存在一定局限性,部分亚组样本量较少,无法进行统计学分析,有待进一步收集更大样本量资料。
作者贡献
李芷君:选题与设计,数据收集、整理分析及文章撰写
张杰:数据收集、整理分析
张丽:修改文章
佟仲生:选题及设计,修改并审核文章
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. |
| [2] |
Badwe R, Hawaldar R, Nair N, et al. Locoregional treatment versus no treatment of the primary tumour in metastatic breast cancer: an open-label randomised controlled trial[J]. Lancet Oncol, 2015, 16(13): 1380-1388. |
| [3] |
Cardoso F, Spence D, Mertz S, et al. Global analysis of advanced/metastatic breast cancer: Decade report (2005-2015)[J]. Breast, 2018, 39: 131-138. |
| [4] |
Malmgren JA, Mayer M, Atwood MK, et al. Differential presentation and survival of de novo and recurrent metastatic breast cancer over time: 1990-2010[J]. Breast Cancer Res Treat, 2018, 167(2): 579-590. |
| [5] |
Yamamura J, Kamigaki S, Fujita J, et al. The Difference in Prognostic Outcomes Between De Novo Stage Ⅳ and Recurrent Metastatic Patients with Hormone Receptor-positive, HER2-negative Breast Cancer[J]. In Vivo, 2018, 32(2): 353-358. |
| [6] |
Bhoo-Pathy N, Verkooijen HM, Tan EY, et al. Trends in presentation, management and survival of patients with de novo metastatic breast cancer in a Southeast Asian setting[J]. Sci Rep, 2015, 5: 16252. |
| [7] |
Andre F, Slimane K, Bachelot T, et al. Breast cancer with synchronous metastases: trends in survival during a 14-year period[J]. J Clin Oncol, 2004, 22(16): 3302-3308. |
| [8] |
Leone BA, Vallejo CT, Romero AO, et al. Prognostic impact of metastatic pattern in stage Ⅳ breast cancer at initial diagnosis[J]. Breast Cancer Res Treat, 2017, 161(3): 537-548. |
| [9] |
Cortesi L, Toss A, Cirilli C, et al. Twenty-years experience with de novo metastatic breast cancer[J]. Int J Cancer, 2015, 137(6): 1417-1426. |
| [10] |
Lobbezoo DJ, van Kampen RJ, Voogd AC, et al. Prognosis of metastatic breast cancer: are there differences between patients with de novo and recurrent metastatic breast cancer?[J]. Br J Cancer, 2015, 112(9): 1445-1451. |
| [11] |
Lee ES, Jung SY, Kim JY, et al. Identifying the potential long-term survivors among breast cancer patients with distant metastasis[J]. Ann Oncol, 2016, 27(5): 828-833. |
| [12] |
den Brok WD, Speers CH, Gondara L, et al. Survival with metastatic breast cancer based on initial presentation, de novo versus relapsed[J]. Breast Cancer Res Treat, 2017, 161(3): 549-556. |
| [13] |
Vaz-Luis I, Lin NU, Keating NL, et al. Racial differences in outcomes for patients with metastatic breast cancer by disease subtype[J]. Breast Cancer Res Treat, 2015, 151(3): 697-707. |
| [14] |
Soran A, Ozmen V, Ozbas S, et al. A randomized controlled trial evaluating resection of the primary breast tumor in women presenting with de novo stage Ⅳ breast cancer: Turkish Study (Protocol MF07-01)[C]. J Clin Oncol, 2016, 34.
|
| [15] |
Thomas A, Khan SA, Chrischilles EA, et al. Initial Surgery and Survival in Stage Ⅳ Breast Cancer in the United States, 1988-2011[J]. JAMA Surg, 2016, 151(5): 424-431. |
| [16] |
Lambertini M, Ferreira AR, Di Meglio A, et al. Patterns of Care and Clinical Outcomes of HER2-positive Metastatic Breast Cancer Patients With Newly Diagnosed Stage Ⅳ or Recurrent Disease Undergoing First-line Trastuzumab-based Therapy: A Multicenter Retrospective Cohort Study[J]. Clin Breast Cancer, 2017, 17(8): 601-610. |
| [17] |
Xiao W, Zou Y, Zheng S, et al. Primary tumor resection in stage IV breast cancer: A systematic review and meta-analysis[J]. Eur J Surg Oncol, 2018, 44(10): 1504-1512. |
| [18] |
Badwe R, Parmar V, Hawaldar R, et al. Surgical removal of primary tumor and axillary lymph nodes in women with metastatic breast cancer at first presentation: A randomized controlled trial[C]. Cancer Res, 2013, 73(24).
|
| [19] |
King TA, Lyman J, Gonen M, et al. A prospective analysis of surgery and survival in stage Ⅳ breast cancer (TBCRC 013)[C]. J Clin Oncol, 2016, 34.
|
| [20] |
Tripathy D, Kaufman PA, Brufsky AM, et al. First-line treatment patterns and clinical outcomes in patients with HER2-positive and hormone receptor-positive metastatic breast cancer from registHER[J]. Oncologist, 2013, 18(5): 501-510. |
| [21] |
Slamon DJ, Leyland-Jones B, Shak S, et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2[J]. N Engl J Med, 2001, 344(11): 783-792. |
| [22] |
Molnár IA, Molnár Bá, Vízkeleti L, et al. Breast carcinoma subtypes show different patterns of metastatic behavior[J]. Virchows Arch, 2017, 470(3): 275-283. |
| [23] |
Rossi V, Nolè F, Redana S, et al. Clinical outcome in women with HER2-positive de novo or recurring stage Ⅳ breast cancer receiving trastuzumab-based therapy[J]. Breast, 2014, 23(1): 44-49. |
| [24] |
Wang H, Zhang C, Zhang J, et al. The prognosis analysis of different metastasis pattern in patients with different breast cancer subtypes: a SEER based study[J]. Oncotarget, 2017, 8(16): 26368-26379. |
| [25] |
Tao L, Chu L, Wang LI, et al. Occurrence and outcome of de novo metastatic breast cancer by subtype in a large, diverse population[J]. Cancer Causes Control, 2016, 27(9): 1127-1138. |
| [26] |
Savci-Heijink CD, Halfwerk H, Hooijer GK, et al. Retrospective analysis of metastatic behaviour of breast cancer subtypes[J]. Breast Cancer Res Treat, 2015, 150(3): 547-557. |
| [27] |
Saraf A, Grubb CS, Hwang ME, et al. Breast cancer subtype and stage are prognostic of time from breast cancer diagnosis to brain metastasis development[J]. J Neurooncol, 2017, 134(2): 453-463. |
 2019, Vol. 46
2019, Vol. 46