文章信息
- 胃肠道恶性肿瘤患者的人体成分分析
- Body Composition of Patients with Malignant Gastrointestinal Tumor
- 肿瘤防治研究, 2019, 46(10): 911-915
- Cancer Research on Prevention and Treatment, 2019, 46(10): 911-915
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0480
- 收稿日期: 2019-04-15
- 修回日期: 2019-05-09
2. 430032 武汉,华中科技大学 同济医学院附属同济医院胃肠外科
2. Department of Gastrointestinal Surgery, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430032, China
近年来研究表明,并非体重指数(body mass index, BMI)而是去脂指数(fat free mass index, FFMI)和骨骼肌指数(skeletal muscle index, SMI)与营养状况和结局密切相关[1]。人体的骨骼肌和重要脏器都是由肌肉构成,低FFMI和低SMI会导致肌力下降、虚弱无力和脏器功能障碍。肌肉组织也是体内最大的蛋白质储备库,60%的蛋白质组织储存于肌肉组织,是应激和饥饿状态下的重要氨基酸来源,手术应激时,肌肉组织分解氨基酸为急性期蛋白的合成提供原料,维持免疫细胞功能和伤口修复,肌肉组织不足会加重术后机体的蛋白质缺乏,导致术后活动减少、跌倒、骨折、需要照料和死亡的风险增加,增加术后并发症和住院时间[2]。
相位角(phase angle, PA)是电抗和电阻的几何比值。电抗与细胞数量和质量有关,细胞数量多、质量越好则电抗越高,PA越高; 电阻与水含量有关,水含量越多则电阻越低,脂肪组织含水量少而肌肉组织含水量多,机体肌肉组织的比例越高,电阻越低,PA越高[3]。PA不仅包含了机体肌肉比例的评估,还包含细胞质量和数量评估,被认为是比FFMI和SMI更全面的营养评估指标。PA与营养状况及预后的相关性已在不少疾病人群中得到证实[4]。胃肠道肿瘤患者为营养不良的高危人群,目前关于生物电阻抗评估该疾病人群营养状况价值的研究较少,因此本研究以主观综合营养评估(subjective global assessment, SGA)作为诊断营养不良标准,探讨生物电阻抗的体成分指标在评估胃肠道肿瘤患者营养状况评估中的价值。
1 资料和方法 1.1 研究对象纳入2016年8月—2018年7月间武汉同济医院胃肠外科入院拟行手术治疗的胃肠道恶性肿瘤患者共162例,其中胃癌93例,结直肠癌69例。平均年龄(56.2±10.5)岁,其中男性93例,平均BMI(22.1±3.1)kg/m2。病理TNM分期(依据国际抗癌联盟UICC制定的第7版分期):Ⅰ期42例、Ⅱ期34例、Ⅲ期56例和Ⅳ期30例。纳入标准:年龄18岁以上胃癌或结直肠癌患者,入院后行手术治疗,术后病检提示原发性胃或结直肠癌; 入院72 h进行SGA评估、生物电阻抗体成分测量、血清白蛋白(Alb)和全血血红蛋白(HB)检测。排除了因为截肢、心脏起搏器和心脏电除颤器等原因不能行人体成分分析的患者。
1.2 SGA评估、生物电阻抗体成分测量和营养相关指标的定义SGA评级标准:A级为既往无显著体重丢失,体检无肌肉组织消耗即为营养良好; B或C级为既往6月至少5%体重丢失,且近期体重未能稳定,体检有肌肉消耗即为营养不良,其中近期体重丢失 > 10%,伴有严重的消化道症状、进食减少,体检有重度肌肉消耗即为C级即重度营养不良[5]。多频生物电阻抗分析仪InBody 770进行体成分测量:受检者在进食2 h后,排空大、小便,赤脚,着单衣,测量身高(精确到l cm)后通过手及脚上的8个触碰式电极进行测量。相关指标定义:低BMI为 < 18.5 kg/m2; 低脂肪指数(fat mass index, FMI)为 < 1.8 kg/m2(男),< 3.9 kg/m2(女); 低FFMI为 < 16.7 kg/m2(男),< 14.6 kg/m2(女)[6];低SMI为 < 7.0 kg/m2(男),< 5.7 kg/m2(女)[7];细胞外水肿定义为细胞外水与总水的比值(extracellular water: total body water ratio, ECW: TBW ratio) > 0.39。低蛋白血症为血清Alb < 35 g/L; 贫血为Hb < 120 g/L(男),< 115 g/L(女)。
1.3 统计学方法采用SPSS17.0软件进行统计分析。连续变量用均数±标准差(x±s)描述,采用方差分析; 分类变量构成比表示,采用χ2检验计算; 连续变量的相关性采用Pearson相关分析。诊断一致性分析用Kappa检验:κ≥0.75,一致性好; 0.75 > κ≥0.4,一致性一般; κ < 0.4,一致性差。依据公式计算敏感度和特异性:敏感度=真阳性人数/(真阳性人数+假阴性人数)×100%;特异性=真阴性人数/(真阴性人数+假阳性人数)×100%。P < 0.05为差异有统计学意义。
2 结果 2.1 体成分分析及其与营养状况的关系生物电阻抗分析结果显示:体重中约20%为脂肪组织(fat mass, FM),约80%为去脂组织(fat free mass, FFM)。矿物质和瘦体组织分别占体重的5%和75%,两者构成FFM。骨骼肌组织(skeletal muscle mass, SMM)是瘦体组织的一部分,占体重的40%。蛋白质、细胞内水和细胞外水依次约占体重的15%、35%和20%,共同构成瘦体组织,其中蛋白质和细胞内水构成体细胞占体重50%左右。和营养良好的患者相比,营养不良患者除了ECW与TBW的比值显著增加外,其余的体成分指标均显著减少,见表 1。13.0%的患者BMI < 18.5 kg/m2,48.1%的患者SGA评为营养不良。低FFMI、低SMI和细胞外水肿的发生率依次为24.7%、25.3%、22.2%,其中50%和22.5%的低FFMI患者为BMI正常和SGA-A; 65.8%和26.8%的低SMI患者为BMI正常和SGA-A; 69.4%和27.7%的细胞外水肿的患者为BMI正常和SGA-A; 33.3%的BMI < 18.5 kg/m2患者SMI为正常,60%的SGA营养不良的患者SMI为正常。SGA与低FFMI、低SMI、细胞外水肿和FMI的诊断一致性差,κ值依次为0.295、0.258、0.218和0.124,均P < 0.05。
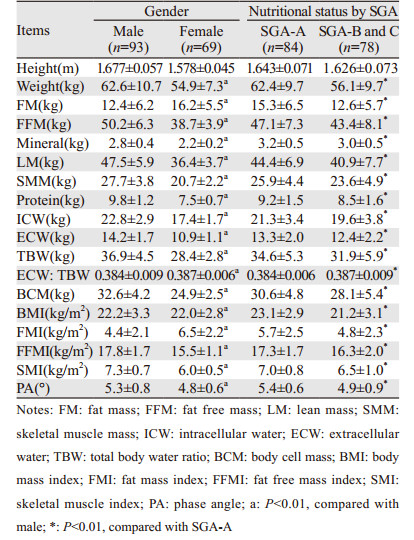
|
年龄、肿瘤部位、肿瘤分期、营养不良的发生率及其程度在男女间均无显著差异。BMI无显著差异时:女性的体重比男性少(7.77±1.50)kg,其中FFM少(11.58±0.86)kg、SMM少(7.00±0.52)kg而FM多(3.84±0.95)kg,均P < 0.01;女性的FFMI比男性少(2.32±0.24)kg/m2、SMI少(1.34±0.11)kg/m2而FMI多(2.15±0.35)kg/m2,均P < 0.01。和相应性别的营养良好患者相比,营养不良患者的体重、FM、FFM和SMM的减少质量在男女性别间无差异,分别为(5.84±2.17)kg vs.(5.48±1.67)kg、(3.30±1.27)kg vs.(2.92±1.29)kg、(2.54±1.29)kg vs.(2.56±0.89)kg和(1.66±0.79)kg vs. (1.58±0.52)kg,均P > 0.05。和相应性别的营养良好患者相比,营养不良男性患者的FM和FMI减少百分比高于女性患者,分别为23.7% vs. 16.2%和22.4% vs. 15%;和相应性别的营养良好患者相比,营养不良男性患者的FFM、FFMI、SMM和SMI减少百分比低于女性患者,分别为5.0% vs. 6.2%、4.4% vs. 5.0%、5.8% vs. 7.4%和5.9% vs. 6.4%。FFMI、SMI与SGA诊断一致性在女性患者中分别为0.332和0.276,高于男性的0.272和0.251;FMI与SGA诊断一致性只存在男性患者中(κ=0.175, P=0.021)而在女性患者中不存在(κ=0.065, P=0.408)。
2.3 PA的相关因素及PA < 4°判定营养不良的价值Pearson相关分析显示:PA与ECW和TBW的比值及年龄呈负相关,与其他的体成分指标呈正相关,与FM和FMI无相关。PA主要取决于ECW与TBW的比值(r=-0.906),其次依次为FFMI(r=0.633)、SMI(r=0.604)、细胞内水(r=0.596)、蛋白质(r=0.594)、矿物质含量(r=0.447)、细胞外水(r=0.445)、BMI(r=0.433)和年龄(r=-0.235),均P < 0.01。营养良好患者PA值范围为4.0°~7.1°。和男性相比,女性PA平均小0.5°,和营养良好患者相比,营养不良患者PA平均小0.5°。以营养良好患者PA最小值为截点,PA < 4°的患者100%为SGA评定营养不良和细胞外水肿,80%为重度营养不良,50%以上为低BMI、低FFMI、低SMI。当PA < 4°时,评定为低BMI、低FFMI、低SMI、细胞外水肿、营养不良、重度营养不良和低蛋白血症的敏感度低,但是特异性高达98%以上,和PA≥4°患者相比,PA < 4°时发生上述营养指标低的风险显著增加,见表 2。
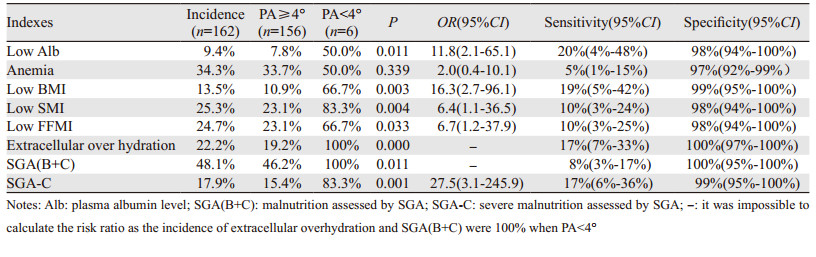
|
不少研究采用CT扫描腰椎水平的肌肉组织面积作评估肌肉量,已经证实肌肉减少患者的肌力减少、体能下降、生活质量下降、心肺功能受损、代谢紊乱、化疗不良反应增加、术后短期并发症和远期死亡风险增加。2015年一项Meta分析显示:CT评估消化道肿瘤患者肌肉减少症的发生率为17.0%~54.1%,肌肉减少症术后感染风险增加4.6倍,对于结肠癌患者术后并发症风险增加3.12倍,住院时间延长2~7天; 肌肉减少症远期死亡风险:在肝癌增加3.19倍,胰腺癌增加1.63倍,结肠癌增加1.85倍,结肠癌肝转移患者增加2.69倍,食管癌增加31%[8]。Van等采用生物电阻抗评估325例心脏手术患者术前低FFMI发生率为8.3%,并证实在矫正了低BMI(<21 kg/m2)和近期体重丢失(近6月体重丢失≥10%)等因素后,术前低FFMI患者术后感染风险和再入院的风险分别增加7.5倍和5.0倍,提倡术前评估FFMI作为诊断营养不良和营养支持的依据,从而促进术后康复[9]。本研究采用电阻抗法评估肌肉组织,生物电阻抗是一种简单、经济、非侵入性的检测人体成分的方法,和金标准双伦X线评估脂肪组织和去脂肪组织的结果有着很好的一致性,其结果可信[10]。本研究中胃肠道癌患者的低FFMI和低SMI的发生率均为25%左右,其中50%和22.5%的低FFMI患者为BMI正常和营养良好; 65.8%和26.8%的低SMI患者为BMI正常和营养良好,这意味着依据BMI和SGA评估会有25%的肌肉不足的患者未能得到重视和干预,同样有2/3的SGA营养不良患者的FFMI和SMI为正常,提示低FFMI和低SMI作为营养不良诊断的不足之处,应该结合SGA以更好的评估营养状况。对于低FFMI和低SMI的患者应该积极补充必需氨基酸,提高优质高蛋白供给,结合运动,增加肌肉含量,从而减少术后并发症和远期死亡风险。
本研究结果显示虽然BMI相同时男性的体重和肌肉组织储备量高于女性,而脂肪组织储备量低于女性,但和营养良好患者相比,营养不良患者的脂肪和肌肉组织丢失质量无性别差异,而减少比例存在性别差异,男性的FM和FMI减少比例更明显,而女性的FFM、FFMI、SMM和SMI减少比例更明显,这和健康人群衰老过程中的肌肉丢失存在不同,从20岁至70岁,男性肌肉丢失量为4 kg大于女性的2 kg,男性骨骼肌减少速度为0.14 kg每年大于女性的0.08 kg每年[11],提示肿瘤的肌肉丢失机制不同于衰老。636例胃癌根治术的患者采用CT扫描评估肌肉和脂肪含量,证实伴有肌肉减少症的肥胖患者的术后并发症风险是肌肉减少症的非肥胖患者的2.571倍,提示脂肪对代谢不利[12]。本研究中FFMI、SMI和细胞外水肿与SGA相关,而FMI相关性最小,进一步证实了脂肪组织相对于其他的体成分指标对代谢益处小,进行性别亚组分析显示:FMI只在男性中与SGA相关,FFM、FFMI、SMM和SMI与SGA相关性在女性中更显著,提示对于营养不良的癌症患者,肌肉组织和脂肪组织的维持对代谢益处可能存在性别差异,进行营养干预时是否应该考虑性别差异而配制不同的营养底物也许更合理些。
本研究中PA主要与细胞外水比例相关,细胞外水比例增加意味着细胞膜通透性增加,提示PA主要反应细胞膜功能,低PA意味着细胞死亡或者细胞膜不完整,低PA已经证实在多种人群包括HIV感染、肝硬化、透析、肿瘤、心衰、ICU以及老年中与不良预后密切相关[4]。然而目前没有亚洲人群的PA正常参考范围,无法定义低PA,欧美国家已有的PA正常参考范围相对中国人过高,而且不同性别、年龄、BMI水平以及疾病种类的PA范围均不同[13],国外一些研究将PA < 4°作为某些疾病人群低PA截点,对于ICU的患者,PA < 4°是诊断营养不良的最佳截点[14],对于姑息治疗的癌症患者PA < 4°是预测生存期的截点[15],本研究进一步证实对于胃肠道癌症患者,PA < 4°是反应综合营养不良的高特异性指标,PA < 4°患者其他营养指标不足的风险急剧增加,值得临床医护人员的重视。
总之,本研究证实了对于胃肠道癌症患者有必要结合人体成分分析来评估营养状况,首次提出体成分指标在评估营养状况时存在的性别差异,对于胃肠道癌症患者PA主要取决于细胞外水比例,以及PA < 4°是在反应综合营养不良上具有高度特异性。今后需要建立中国人群的PA正常参考范围以定义低PA,从而有助于临床研究和营养支持工作的开展。
作者贡献
陈镇燕:设计研究方案、收集数据和撰写、修改论文
朱丽:提供病例资料,协助SGA评估和体成分测量
| [1] | Prado CM, Purcell SA, Alish C, et al. Implications of low muscle mass across the continuum of care: a narrative review[J]. Ann Med, 2018, 50(8): 675–693. DOI:10.1080/07853890.2018.1511918 |
| [2] | Pichard C, Kyle UG, Morabia A, et al. Nutritional assessment: lean body mass depletion at hospital admission is associated with an increased length of stay[J]. Am J Clin Nutr, 2004, 79(4): 613–618. DOI:10.1093/ajcn/79.4.613 |
| [3] | Thibault R, Pichard C. The evaluation of body composition: a useful tool for clinical practice[J]. Ann Nutr Metab, 2012, 60(1): 6–16. DOI:10.1159/000334879 |
| [4] | Garlini LM, Alves FD, Ceretta LB, et al. Phase angle and mortality: a systematic review[J]. Eur J Clin Nutr, 2019, 73(4): 495–508. DOI:10.1038/s41430-018-0159-1 |
| [5] | Detsky AS, McLaughlin JR, Baker JP, et al. What is subjective global assessment of nutritional status?[J]. JPEN J Parenter Enteral Nutr, 1987, 11(1): 8–13. DOI:10.1177/014860718701100108 |
| [6] | Kyle UG, Schutz Y, Dupertuis YM, et al. Body composition interpretation. Contributions of the fat-free mass index and the body fat mass inde[J]. Nutrition, 2003, 19(7-8): 597–604. DOI:10.1016/S0899-9007(03)00061-3 |
| [7] | Chen LK, Liu LK, Woo J, et al. Sarcopenia in Asia: consensus report of the Asian Working Group for Sarcopenia[J]. J Am Med Dir Assoc, 2014, 15(2): 95–101. DOI:10.1016/j.jamda.2013.11.025 |
| [8] | Levolger S, van Vugt JL, de Bruin RW, et al. Systematic review of sarcopenia in patients operated on for gastrointestinal and hepatopancreatobiliary malignancies[J]. Br J Surg, 2015, 102(12): 1448–1458. DOI:10.1002/bjs.9893 |
| [9] | van Venrooij LM, de Vos R, Zijlstra E, et al. The impact of low preoperative fat-free body mass on infections and length of stay after cardiac surgery: a prospective cohort study[J]. J Thorac Cardiovasc Surg, 2011, 142(5): 1263–1269. DOI:10.1016/j.jtcvs.2011.07.033 |
| [10] | Tewari N, Awad S, Macdonald IA, et al. A comparison of three methods to assess body composition[J]. Nutrition, 2018, 47: 1–5. DOI:10.1016/j.nut.2017.09.005 |
| [11] | Anderson LJ, Liu H, Garcia JM, et al. Sex differences in muscle wasting[J]. Adv Exp Med Biol, 2017, 1043: 153–197. |
| [12] | Zhang WT, Lin J, Chen WS, et al. Sarcopenic obesity is associated with severe postoperative complications in gastric cancer patients undergoing gastrectomy: a prospective study[J]. J Gastrointest Surg, 2018, 22(11): 1861–1869. DOI:10.1007/s11605-018-3835-5 |
| [13] | Kuchnia AJ, Teigen LM, Cole AJ, et al. Phase angle and impedance ratio: reference cut-points from the united states national health and nutrition examination survey 1999-2004 from bioimpedance spectroscopy data[J]. JPEN J Parenter Enteral Nutr, 2017, 41(8): 1310–1315. DOI:10.1177/0148607116670378 |
| [14] | Dadet S, Mulliez A, Ducher G, et al. A new marker for nutritional assessment in acute care geriatric units: The phase angle measured by bioelectrical impedance analysis[J]. Exp Gerontol, 2018, 111: 162–169. DOI:10.1016/j.exger.2018.07.003 |
| [15] | Pérez Camargo DA, Allende Pérez SR, Rivera Franco MM, et al. Phase angle of bioelectrical impedance analysis as prognostic factor in palliative care patients at the national cancer institute in mexico[J]. Nutr Cancer, 2017, 69(4): 601–606. DOI:10.1080/01635581.2017.1299880 |
 2019, Vol. 46
2019, Vol. 46


