文章信息
- 儿童后肾腺肉瘤骨转移1例报道并文献复习
- Bone Metastasis in Children with Metanephric Adenosarcoma: A Case Report and Literature Review
- 肿瘤防治研究, 2019, 46(11): 1047-1050
- Cancer Research on Prevention and Treatment, 2019, 46(11): 1047-1050
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0470
- 收稿日期: 2019-04-11
- 修回日期: 2019-08-08
2. 050011 石家庄,河北医科大学第四医院病理科
2. Department of Pathology, The Fourth Affiliated Hospital of Hebei Medical University, Shijiazhuang 050011, China
后肾腺肉瘤(metanephric adenosarcoma)是临床上极为罕见的肾脏恶性肿瘤,回顾既往文献仅有少数个案报道[1-2],而后肾腺肉瘤骨转移则未见报道。根据WHO关于肾脏肿瘤的分类,新加入了“后肾肿瘤(metanephric neoplasms)”这一子类,其中包含后肾腺瘤(metanephric adenoma, MA)、后肾间质肿瘤(metanephric stromal tumor, MST)和后肾腺纤维瘤(metanephric adenofibroma, MAF)三类[3]。而后肾腺肉瘤则是后肾腺瘤中出现肉瘤成分,更为罕见。河北医科大学第四医院于2016年8月收治并行手术治疗的后肾腺肉瘤儿童1例,患儿于术后1年发现骨转移,系统治疗并随访至今,现报告如下。
1 病例报告患者,男,5岁,右肾后肾腺肉瘤术后1年,因左小腿近段疼痛1月,于2017年8月17日收入我院骨科。入院前1月患儿出现左侧小腿近段疼痛,1周前加重并出现跛行,行患肢X线检查,发现胫骨近端占位,遂入院治疗。既往患者因“右肾占位”于2016年8月16日于我院泌尿外科行右肾根治性切除术,见图 1。病理:瘤细胞形态一致,呈管状、腺泡状排列。间质呈无细胞的水肿样、黏液样或者玻璃样变的状态,免疫组织化学结果:CK(-)、Vim(+)、CD34(-)、CD99(+)、WT1(-)、Ki-67(阳性细胞数40%)、S100(-)、Des(-)、EMA(-)、Act(-)、Myo(-),后肾腺肉瘤,见图 2。术后患者未行后续治疗。入院查体:左小腿近端压痛,明显肿胀,胫骨结节水平周径较对侧增粗2 cm,膝关节屈伸活动正常。全身骨扫描示:右股骨上段可见异常核素浓聚,相应部位髓腔内见片状低密度及高密度影,左胫骨上段可见异常核素浓聚,相应部位骨皮质破坏伴周围软组织包块形成,见图 3A。膝关节及胫腓骨CT示左侧胫骨近中段骨质破坏。MRI示:胫腓骨近中段见不规则T1稍高信号,T2高信号影,胫骨近段骨皮质不连续,周围软组织内可见不规则T1稍高信号,T2高信号影,见图 3B、F。胸腹部CT未见局部复发及肺、肝等内脏转移征象。患者入院后为明确病变性质及来源,于2017年8月23日行左胫骨病变切取活检术,术中刮取髓腔病变呈“鱼肉样”肿瘤组织送检。病理示:破碎灰白质韧组织一堆,直径1 cm。区域瘤细胞小圆形,在幼稚的黏液间质中弥漫性分布,部分呈梭形;无病理性核分裂相;无坏死。免疫组织化学检测示:CK(-),WT1(-),Vim(+),Ki-67(阳性细胞数50%),Desmin(-),SMA(+/-),CD34(血管+),S100(-)。少许间叶源性恶性肿瘤,对比既往右肾肿瘤病理,符合后肾腺肉瘤骨转移,见图 2。于2017年9月起给予AI方案(ADM 60 mg/m2+IFO 8 g/m2,21天为一疗程)化疗3周期,其中第2周期化疗结束出现Ⅳ度粒细胞缺乏伴粒细胞缺乏性发热,经G-CSF、预防应用抗生素后体温及白细胞数量逐渐恢复正常,第3周期化疗给予减量25%后仍再次出现Ⅳ度骨髓抑制、粒细胞缺乏。化疗结束后查体显示左小腿肿胀较化疗前明显减轻,胫骨结节水平周径较对侧增粗0.5 cm。复查胫腓骨X线示病变较前好转,MRI提示软组织包块明显缩小,髓腔内病灶未见明显变化,见图 3C、G。对侧股骨近端转移灶未见明显变化。因患者家属拒绝继续化疗,2018年1月起改用甲磺酸阿帕替尼每日250 mg维持,并继续每3月随访,病情持续控制稳定。至2018年9月患儿突发右侧大腿近端肿胀、疼痛,复查发现右股骨近端髓腔内异常信号,伴股骨干周围异常信号,左侧胫骨近端病变较前无明显变化,见图 3D、H,骨扫描提示右股骨核素浓聚范围较前增大,左胫骨近端核素浓聚较前无明显变化。考虑病情较前进展,病情评估PD,患儿家属拒绝进一步化疗,遂于2018年9月后每4周加用一次唑来膦酸1 mg静滴,患儿耐受性良好,无发热等不良反应,肝肾功能无异常,至2018年12月末次复查MRI见左侧胫骨近端病变无明显变化、右侧股骨近端髓腔内病变无变化、股骨干周围异常信号消失。查体右侧大腿近端肿胀较前明显消退,周径与对侧大腿同水平相等。病情评估PR,患者未出现异常反应,末次随访MRI显示左侧胫骨近端转移灶及对侧股骨近端转移灶未见明显变化,见图 3E、I、R,目前患者病情变化仍在进一步随访中。
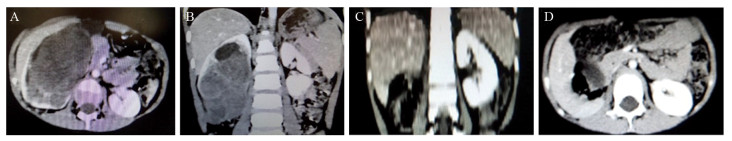
|
| 图 1 右肾后肾腺肉瘤肾切除术前(A, B)及术后(C, D)CT Figure 1 Abdominal CT of the patient with metanephric adenosarcoma in right kidney before(A, B) and after(C, D) nephrectomy in September 2016 |

|
| Right renal tumor: HE staining (A), CD99 positive(B), Ki-67 (40% positive cells)(C), Vim positive(D); Left proximal tibia metastases: HE staining(E), Ki-67 (50% positive cells)(F), Vim positive(G) 图 2 患者肾切除术后病理图片 Figure 2 Pathological picture of the patient after nephrectomy |
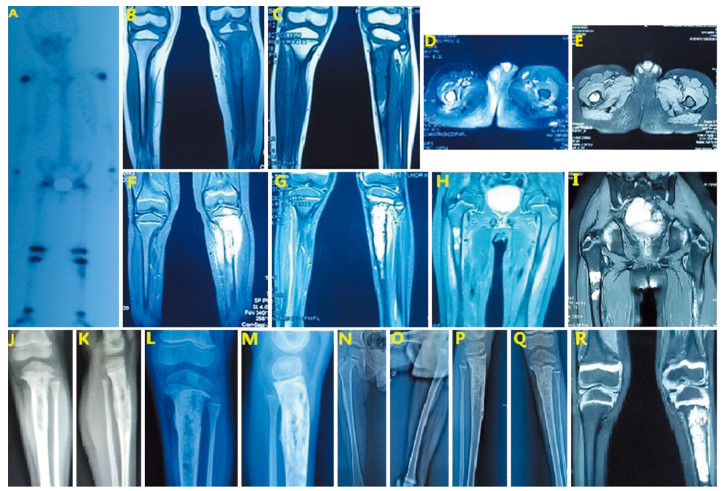
|
| A: whole body bone scan, 2017-9; B, F: tibiofibula MRI, 2017-9; J, K: left tibiofibula X-ray, 2017-9; C, G: tibiofibula MRI after chemotherapy, 2018-1; L, M: left tibiofibula X-ray, 2018-1; D, H: later femoral MRI after 8 months of apatinib treatment, 2018-9; E, I, R: MRI after 4 months of apatinib+zoledronic acid, 2018-12; N, O, P, Q: X-ray after 4 months of apatinib + zoledronic acid, 2018-12 图 3 患者术后骨转移灶影像学图片 Figure 3 Imaging of bone metastases in the patient after nephrectomy |
后肾肿瘤是罕见的肾脏原发肿瘤,其中以MA相对常见,该肿瘤最早由Brisigotti[4]于1992年命名。目前尚未见大宗病例分析。MA可发生于任何年龄,多见于成人,女性多见,男女比例约为1:2[3]。MA起源于肾皮质小管,多数学者认为其是一种具有良性生物学行为的罕见肿瘤,但随着报道数量的不断增多,在一些病例中MA表现出了侵袭性和转移性[4-5],因此其生物学特性尚有待探讨。Li等[6]通过对18例病理学诊断为MA的患者进行回顾性分析,发现MA具有三种组织学亚型,分别为典型后肾腺瘤、恶性后肾腺瘤和不同恶性成分共存的后肾腺瘤,认为MA是一种具有不同生物学特性的异质性肿瘤。MA患者在就诊时多无明显临床症状,多为体检时发现,有些患者可出现血尿或红细胞增多症[3]。该病治疗方式以手术切除为主,对于瘤体较小的后肾腺瘤,可选择保留肾单位的肿瘤切除术,单纯的后肾腺瘤多预后良好,术后无复发和转移征象[6-9]。Xie等[10]的报道中,因为在后肾腺瘤中发现了肉瘤成分,因而称之为后肾腺肉瘤,该肿瘤恶性程度高,预后极差,免疫组织化学指标显示其患者肿瘤的上皮成分中AE1/AE3、CD57、EMA、CK7、CD117均为阳性,间质成分中Vim、CD10为阳性,但是WT1在间质成分中则显示为弱阳性。Picken等[2]报道的患者免疫组织化学则显示其上皮成分中除AE1/AE3为阳性外其他上皮标志物表达均阴性,而Vim、CD34、CD117间质成分则表达为阳性。本例患者骨病灶标本镜下组织形态呈明显间叶源性细胞其Vim、SMA,CD34均呈现强阳性或中等阳性表达,结合免疫组织化学结果,符合原发病灶中的肉瘤成分转移而来的判断。
后肾腺肉瘤目前认为是后肾肿瘤的恶性间质变异,病例较少,既往文献提示肿瘤恶性程度较高,多在术后短期内出现内脏转移导致死亡,而术后出现骨转移则更无治疗先例,因此缺乏治疗经验。本例患者为体检时发现右肾占位,术前无明显临床症状,行根治性肾切除术。患者在术后1年时发生骨转移,治疗经验及方法较少,首先尝试应用非特异性软组织肉瘤一线化疗方案多柔比星联合异环磷酰胺,疗效满意,但患儿耐受性较差,骨髓抑制等化疗不良反应明显,化疗仅维持三周期。甲磺酸阿帕替尼是国产小分子抗血管生成靶向药物,作用于VEGFR-2等多个靶点,目前已在多种软组织肉瘤中应用,获得良好疗效,患者平均无进展生存期(progression free survival, PFS)4.25~8.84月[10-12]。但文献报道尚缺乏儿童应用的有效性和安全性证据,本例患儿应用甲磺酸阿帕替尼PFS 8月,控制效果满意,恶心呕吐等不良反应均为Ⅱ度以内,无手足综合征发生,血压维持稳定,无蛋白尿,肝肾功能等血液化验指标正常,耐受性良好。
双磷酸盐用于恶性肿瘤骨转移的治疗得到了广泛的认可,其机制主要在于抑制破骨细胞作用而间接抑制肿瘤骨转移灶的破坏,不仅如此双磷酸盐可激活γδT细胞以增强患者免疫应答最终抑制转移灶中肿瘤细胞生长;此外转移灶中的肿瘤相关巨噬细胞(TAM)也可由于双磷酸盐的作用,由M2型转变为M1型杀伤肿瘤细胞[13]。但目前儿童临床应用唑来膦酸较为慎重,应用安全剂量缺少经验。既往文献报道在儿童中应用唑来膦酸中位剂量0.025 mg/kg[14]。本病例中患儿在甲磺酸阿帕替尼治疗8月后出现病情进展,尝试加用1 mg(0.0625 mg/kg)唑来膦酸4月,右股骨病变得到控制,股骨干周围水肿带消失,肝肾功能复查未见异常,疗效及安全性均良好,如长期使用,疗效尚有待进一步观察。本例患儿经化疗-靶向治疗-靶向治疗联合双磷酸盐治疗,至目前已获得15月的较长期疾病控制,为后肾腺肉瘤骨转移的治疗积累了宝贵经验。
作者贡献:
冯 奇:论文撰写
王东来:论文指导
郭 鹏:图片制作
刘月平:病例随访
冯建刚:论文审阅
| [1] |
Su T, Yan F, Zhu P. Metanephric adenosarcoma: a rare case with immunohistochemistry and molecular analysis[J]. Diagn Pathol, 2014, 9: 179. DOI:10.1186/s13000-014-0179-7 |
| [2] |
Picken MM, Curry JL, Lindgren V, et al. Metanephric adenosarcoma in a young adult: morphologic, immunophenotypic, ultrastructural, and fluorescence in situ hybridization analyses: a case report and review of the literature[J]. Am J Surg Pathol, 2001, 25(11): 1451-1457. DOI:10.1097/00000478-200111000-00016 |
| [3] |
Kinney SN, Eble JN, Hes O, et al. Metanephric adenoma: the utility of immunohistochemical and cytogenetic analyses in differential diagnosis, including solid variant papillary renal cell carcinoma and epithelial-predominant nephroblastoma[J]. Mod Pathol, 2015, 28(9): 1236-1248. DOI:10.1038/modpathol.2015.81 |
| [4] |
Brisigotti M, Cozzutto C, Fabbretti G, et al. Metanephric adenoma[J]. Histol Histopathol, 1992, 7(4): 689-692. |
| [5] |
Renshaw AA, Freyer DR, Hammers YA. Metastatic metanephric adenoma in a child[J]. Am J Surg Pathol, 2000, 24(4): 570-574. DOI:10.1097/00000478-200004000-00012 |
| [6] |
Li G, Tang Y, Zhang R, et al. Adult metanephric adenoma presumed to be all benign? A clinical perspective[J]. BMC Cancer, 2015, 15: 310. DOI:10.1186/s12885-015-1211-3 |
| [7] |
Spaner SJ, Yu Y, Cook AJ, et al. Pediatric metanephric adenoma: case report and review of the literature[J]. Int Urol Nephrol, 2014, 46(4): 677-680. DOI:10.1007/s11255-013-0575-z |
| [8] |
Wang P, Tian Y, Xiao Y, et al. A metanephric adenoma of the kidney associated with polycythemia: A case report[J]. Oncol Lett, 2016, 11(1): 352-354. DOI:10.3892/ol.2015.3868 |
| [9] |
Lai Y, Chen D, Xu X, et al. Metanephric adenoma: A report of two cases and review of the literature[J]. Mol Clin Oncol, 2013, 1(6): 1087-1089. DOI:10.3892/mco.2013.184 |
| [10] |
Xie L, Guo W, Wang Y, et al. Apatinib for advanced sarcoma: results from multiple institutions' off-label use in China[J]. BMC Cancer, 2018, 18(1): 396. DOI:10.1186/s12885-018-4303-z |
| [11] |
Li F, Liao Z, Zhao J, et al. Efficacy and safety of Apatinib in stage Ⅳ sarcomas: experience of a major sarcoma center in China[J]. Oncotarget, 2017, 8(38): 64471-64480. |
| [12] |
Li F, Liao Z, Zhang C, et al. Apatinib as targeted therapy for sarcoma[J]. Oncotarget, 2018, 9(36): 24548-24560. |
| [13] |
Sameshima N, Marutsuka K, Tsukino H, et al. So-called' adenosarcoma' of the kidney a novel adult renal tumor with a cystic appearance[J]. Pathol Int, 2011, 61(5): 313-318. DOI:10.1111/j.1440-1827.2011.02653.x |
| [14] |
George S, Weber DR, Kaplan P, et al. Short-Term Safety of Zoledronic Acid in Young Patients With Bone Disorders: An Extensive Institutional Experience[J]. J Clin Endocrinol Metab, 2015, 100(11): 4163-4171. DOI:10.1210/jc.2015-2680 |
 2019, Vol. 46
2019, Vol. 46


