文章信息
- PKM2表达和巨噬细胞中CD163升高协同促进骨肉瘤进展
- PKM2 Expression and Elevated CD163 in Macrophage Synergistically Promote Osteosarcoma Progression
- 肿瘤防治研究, 2019, 46(12): 1101-1106
- Cancer Research on Prevention and Treatment, 2019, 46(12): 1101-1106
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0453
- 收稿日期: 2019-04-08
- 修回日期: 2019-09-24
骨肉瘤常见于儿童和青少年长骨的干骺端[1],国内发病率约为3/100万,占恶性肿瘤的0.2%,是青少年骨肿瘤中主要的死亡因素[2]。治疗上虽然已经取得很大进展,但患者的预后及生活质量仍令人失望[3]。
近年来,骨肉瘤基因组学和蛋白组学研究得到了快速发展[4],但临床获益十分有限,进而转向肿瘤微环境研究[5-6]。据报道微环境通过多种途径促进肿瘤进展[7-9]。如巨噬细胞作为微环境中最丰富的白细胞,被认为与各种人类恶性肿瘤的血管生成、远处转移[10]以及化疗耐药[11]有关。M1型巨噬细胞高表达IL-12、IL-23和CD68,具有抗肿瘤作用。M2型巨噬细胞分泌高水平的IL-10、CD163和CD204,通常具有促瘤作用。
有研究证明骨肉瘤微环境中存在M2型巨噬细胞[10, 12],但尚未系统地探讨M2型巨噬细胞的转化。有学者提出酸性微环境在M2型巨噬细胞转化中至关重要,缺氧产生的酸性微环境可能引发巨噬细胞中的HIF-1α活化及精氨酸酶-1和IL-10的过表达[13]。
研究发现M2型丙酮酸激酶(pyruvate kinase M2, PKM2)升高导致骨肉瘤预后不良[14]。由于PKM2能促进乳酸分泌,而乳酸对酸性微环境具有广泛的促进作用,本实验研究了M2型巨噬细胞浸润及PKM2在骨肉瘤中表达的预后意义。
1 资料与方法 1.1 临床资料收集2010—2014年南华大学附属第二医院病理科88例原发性骨肉瘤石蜡包埋标本。回顾性分析年龄、性别、发病部位、肿瘤大小、组织学分级、ALP、LDH、远处转移、局部疼痛和Eneeking分期等临床参数。根据Eneeking分期系统对肿瘤进行分期,并根据世界卫生组织(WHO)分类标准进行组织学分级。获得患者书面知情同意及南华大学附属第二医院伦理委员会的批准。
1.2 材料组织微阵列的构建由上海生物芯片公司制作;PKM2兔多克隆抗体为美国CST公司产品;辣根过氧化物酶(HRP)及Gene Tech GTVision Ⅲ检测试剂盒为中国上海基因科技公司产品;Human CD163试剂盒为美国R & D公司产品。
1.3 实验方法 1.3.1 组织芯片及标本处理对患者的石蜡包埋标本进行组织微阵列构建,该微阵列的构建是与上海生物芯片合作建造。来自原发肿瘤的苏木精和伊红(HE)染色切片用于定义代表性肿瘤区域和邻近的正常组织;代表性肿瘤区域定义为包含超过75%癌细胞而没有坏死的肿瘤区域,随机选择与肿瘤区域相距至少5.0 cm的相邻正常组织作为对照。使用组织微阵列仪(USA)从组织块的限定区域冲压圆柱体(直径1.5 mm)并插入受体石蜡块中,将这些切片转移到载玻片上。
1.3.2 免疫组织化学染色将组织微阵列载玻片用二甲苯脱石蜡,然后用乙醇浸泡水化。在含有0.01 mol/L柠檬酸钠缓冲液(pH6.0)的压力锅中进行热介导的抗原修复,修复液没过切片组织,再将上述容器放入加有适量自来水的高压锅内,加盖加热2 min后熄火并冷却至室温。磷酸盐缓冲液(PBS)冲洗后,3%过氧化氢孵育5 min阻断多余的过氧化物酶活性。滴加兔抗人多克隆抗体PKM2抗体(1:100)于切片上置湿盒4℃下培养过夜,样品与辣根过氧化物酶在室温下孵育40 min。在PBS中洗涤3~5 min后,用3, 3'-二氨基联苯胺(DAB)溶液检测PKM2。
1.3.3 镜下观察及评估M2巨噬细胞定义为卵圆形或圆形细胞核,具有膜或细胞质CD163染色。低倍(×100)下扫描染色的切片以确定巨噬细胞浸润最丰富的区域。高倍镜(×400)下对5个区域的巨噬细胞进行计数。根据细胞计数将浸润巨噬细胞密度分为4类:(0)缺失(< 20/mm2);(1)弱浸润(20~40/mm2);(2)中度浸润(40~60/mm2);(3)高度浸润(60/mm2)。在统计分析中,分为阴性(0~1)或阳性(2~3)浸润。由对临床信息不知情的两名病理科医师进行评估。
1.4 统计学方法使用SPSS21.0统计软件进行统计学分析。Pearson χ2检验研究临床病理学参数和CD163表达之间的关系,采用Spearman秩检验评价PKM2与CD163的相关性,Kaplan-Meier分析预后价值,Cox回归模型进行参数与患者预后的相关性分析。多因素分析进一步检验单因素分析中与总体生存率相关的因素。P < 0.05为差异有统计学意义。
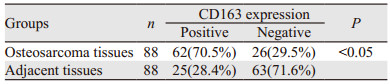
2 结果 2.1 M2巨噬细胞在骨肉瘤组织中高度浸润为了证实M2巨噬细胞在骨肉瘤中的生物学意义,首先检测了CD163的表达来观察其是否存在于骨肉瘤中,CD163染色范围从阴性到阳性,见图 1A、1B。70.5%的患者M2巨噬细胞浸润阳性,提示M2巨噬细胞在骨肉瘤中高度浸润。此外,骨肉瘤组织中M2巨噬细胞的浸润较癌旁组织更为丰富(P < 0.05),见表 1、图 1C。
|
| A: representative images of CD163 expression in osteosarcoma; B: PKM2 expression in osteosarcoma and paired noncancerous tissues; C: overall survival curves based on CD163 expression in osteosarcoma. 图 1 CD163的表达与骨肉瘤预后的关系 Figure 1 Relation between CD163 expression and prognosis of osteosarcoma patients |
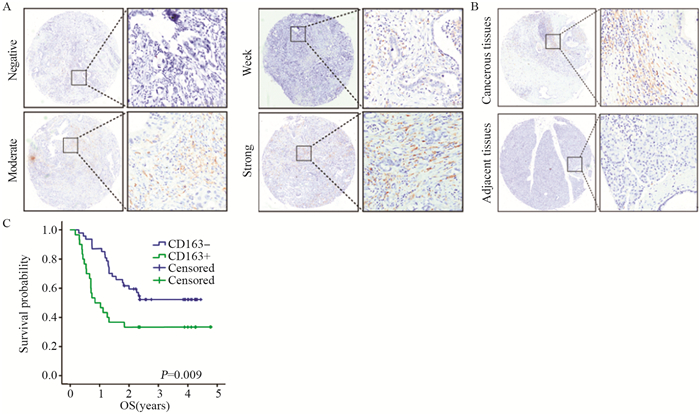
基质中M2巨噬细胞与Eneeking分期呈正相关(P=0.003),与年龄、性别、肿瘤部位等参数无关,见表 2。
|
M2巨噬细胞浸润阳性的患者存活率明显低于阴性患者(P=0.009),见图 1C。基质中M2巨噬细胞浸润的升高是患者的独立不良预后因素(P=0.010, HR=2.02, 95%CI: 1.16~3.49),见表 3。

|
在显微镜下观察PKM2和CD163的连续切片染色情况,发现PKM2表达升高的患者伴有高M2巨噬细胞浸润,见图 2A。Spearman测定表明癌细胞的PKM2表达与骨肉瘤中的M2巨噬细胞浸润正相关(P < 0.001, r=0.390),见图 2B。进一步研究PKM2和CD163在骨肉瘤中的组合模式,发现它们的过表达都给患者带来了极不良的预后(P < 0.05),见图 2C~D。Cox回归分析表明骨肉瘤中PKM2表达升高,巨噬细胞CD163表达是骨肉瘤的独立不良预后因子(P=0.001, HR=2.71, 95%CI: 1.53~4.80),见表 3。
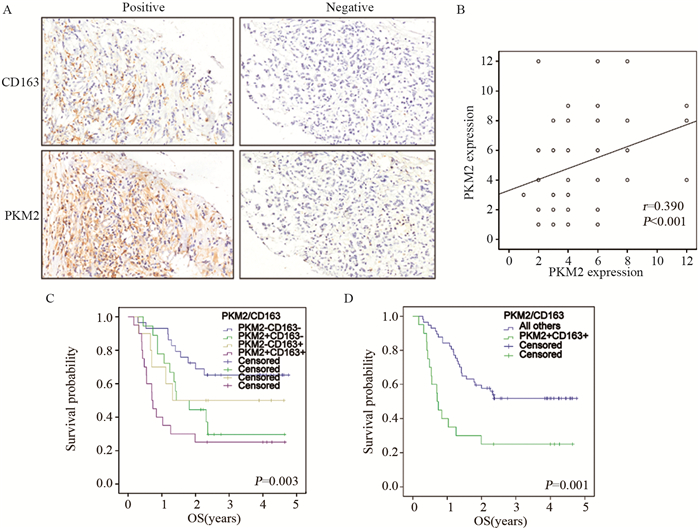
|
| A: representative images of PKM2 and CD163 expression in osteosarcoma patient; B: correlation between PKM2 and CD163 expression; C: overall survival curves based on PKM2 and CD163 expression in osteosarcoma; D: survival curves of osteosarcoma patients with simultaneous expression of PKM2 and CD163. 图 2 PKM2和CD163过表达为骨肉瘤患者预后不良因素 Figure 2 Overexpression of PKM2 and CD163 was poor prognostic factor for osteosarcoma patients |
近期,越来越多研究开始探索有氧糖酵解在恶性肿瘤中的作用,前者与后者的发生及发展密切相关。有研究表明,肿瘤细胞需要多种生物分子才能增殖与迁移,而肿瘤细胞中更高水平的有氧糖酵解途径可以为其提供这些物质[15-16]。作为参与有氧糖酵解的关键酶,PKM2在恶性肿瘤患者中表达明显升高,骨肉瘤亦不例外,且PKM2高表达与肿瘤中的不利表型相关[17-19]。Morfouace等[20]的一项研究表明,PKM2升高可通过上调Oct4的表达,从而抑制胶质瘤干细胞进而降低胶质瘤发生。此外,还有报道称PKM2表达升高可通过增强上皮-间质转化促进肿瘤进展[21]。但关于PKM2促进骨肉瘤进展的机制尚需进一步探讨,本研究发现PKM2与M2巨噬细胞呈正相关,这表明PKM2可能通过促进免疫抑制表型巨噬细胞浸润作用从而促进骨肉瘤进展。
M2巨噬细胞可能与肿瘤形成密切相关[10, 17]。本研究发现M2巨噬细胞高度浸润组生存结果较差,CD163不只是M2巨噬细胞的特异性表面标志物,因此尚需研究M2巨噬细胞的其他标志物以进一步完善该实验结果。
M2巨噬细胞亦被认为有促进骨肉瘤进展的作用,因此抑制M2巨噬细胞可能具有很大的临床意义。总之,针对恶性肿瘤中M2巨噬细胞的潜在治疗策略包括抑制单核细胞聚集,抑制单核细胞极化和消除完全成熟的M2巨噬细胞[11]。本研究结果提示,针对PKM2或联合M2巨噬细胞的靶向治疗可能为骨肉瘤的替代治疗方法。
本研究探讨了M2巨噬细胞的生物学意义及其在骨肉瘤中转化的潜在机制,发现M2巨噬细胞在骨肉瘤中高度浸润,可能为患者预后不良的相关因素,同时发现,在骨肉瘤中PKM2表达与M2巨噬细胞浸润呈正相关,其中M2细胞高度浸润及PKM2高表达组预后最差。基于本研究结果,推测PKM2升高可促进乳酸分泌,从而激活巨噬细胞的p38/MAPK信号通路,导致M2巨噬细胞极化,最终促进骨肉瘤的进展。
上述数据提示PKM2和CD163在骨肉瘤中存在交叉表达。对文献的全面综述表明M2巨噬细胞极化部分独立于酸性微环境,考虑到乳酸是酸性条件的重要贡献者,并且PKM2是乳酸生成的关键酶,因此我们拟提出将骨肉瘤中的PKM2和M2巨噬细胞联系起来的模型,见图 3,其包括PKM2表达升高和癌细胞的乳酸表达,p38/MAPK巨噬细胞的激活以及M2极化。
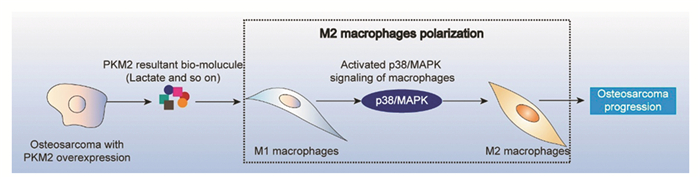
|
| 图 3 在骨肉瘤中联合M2巨噬细胞与PKM2的模型 Figure 3 Proposed model of M2 macrophages combined with PKM2 in osteosarcoma |
作者贡献
谭文甫:文章撰写
杨俊涛:构思设计
夏雪:数据分析
向仁堃:数据获取
王晓旭:文章修改
| [1] |
He H, Ni J, Huang J. Molecular mechanisms of chemoresistance in osteosarcoma (Review)[J]. Oncol Lett, 2014, 7(5): 1352-1362. DOI:10.3892/ol.2014.1935 |
| [2] |
Zhang K, Zhang Y, Zhu H, et al. High expression of MACC1 predicts poor prognosis in patients with osteosarcoma[J]. Tumor Biol, 2014, 35(2): 1343-1350. DOI:10.1007/s13277-013-1180-6 |
| [3] |
Kansara M, Teng MW, Smyth MJ, et al. Translational biology of osteosarcoma[J]. Nat Rev Cancer, 2014, 14(11): 722-735. DOI:10.1038/nrc3838 |
| [4] |
Wang G, Zhang Z, Yang M, et al. Comparative proteomics analysis of human osteosarcoma by 2D DIGE with MALDI-TOF/TOF MS[J]. J Bone Oncol, 2016, 5(4): 147-152. DOI:10.1016/j.jbo.2016.05.002 |
| [5] |
Ferrari S, Perut F, Fagioli F, et al. Proton pump inhibitor chemosensitization in human osteosarcoma: from the bench to the patients' bed[J]. J Transl Med, 2013, 11: 268. DOI:10.1186/1479-5876-11-268 |
| [6] |
Tu B, Peng ZX, Fan QM, et al. Osteosarcoma cells promote the production of pro-tumor cytokines in mesenchymal stem cells by inhibiting their osteogenic differentiation through the TGF-β/Smad2/3 pathway[J]. Exp Cell Res, 2014, 320(1): 164-173. DOI:10.1016/j.yexcr.2013.10.013 |
| [7] |
Alfranca A, Martinez-Cruzado L, Tornin J, et al. Bone microenvironment signals in osteosarcoma development[J]. Cell Mol Life Sci, 2015, 72(16): 3097-3113. DOI:10.1007/s00018-015-1918-y |
| [8] |
Ouellet V, Siegel PM. CCN3 modulates bone turnover and is a novel regulator of skeletal metastasis[J]. J Cell Commun Signal, 2012, 6(2): 73-85. DOI:10.1007/s12079-012-0161-7 |
| [9] |
Rubio R, Abarrategi A, Garcia-Castro J, et al. Bone environment is essential for osteosarcoma development from transformed mesenchymal stem cells[J]. Stem Cells, 2014, 32(5): 1136-1148. DOI:10.1002/stem.1647 |
| [10] |
Endo-Munoz L, Evdokiou A, Saunders NA. The role of osteoclasts and tumour-associated macrophages in osteosarcoma metastasis[J]. Biochim Biophys Acta, 2012, 1826(2): 434-442. |
| [11] |
Hu H, Jiao F, Han T, et al. Functional significance of macrophages in pancreatic cancer biology[J]. Tumour Biol, 2015, 36(12): 9119-9126. DOI:10.1007/s13277-015-4127-2 |
| [12] |
Pahl JH, Kwappenberg KM, Varypataki EM, et al. Macrophages inhibit human osteosarcoma cell growth after activation with the bacterial cell wall derivative liposomal muramyl tripeptide in combination with interferon-gamma[J]. J Exp Clin Cancer Res, 2014, 33: 27. DOI:10.1186/1756-9966-33-27 |
| [13] |
Colegio OR, Chu NQ, Szabo AL, et al. Functional polarization of tumour-associated macrophages by tumour-derived lactic acid[J]. Nature, 2014, 513(7519): 559-563. DOI:10.1038/nature13490 |
| [14] |
Liu ZX, Hong L, Fang SQ, et al. Overexpression of pyruvate kinase M2 predicts a poor prognosis for patients with osteosarcoma[J]. Tumour Biol, 2016, 37(11): 14923-14928. DOI:10.1007/s13277-016-5401-7 |
| [15] |
Asgari Y, Zabihinpour Z, Salehzadeh-Yazdi A, et al. Alterations in cancer cell metabolism: the Warburg effect and metabolic adaptation[J]. Genomics, 2015, 105(5-6): 275-281. DOI:10.1016/j.ygeno.2015.03.001 |
| [16] |
Gillies RJ, Gatenby RA. Metabolism and its sequelae in cancer evolution and therapy[J]. Cancer J, 2015, 21(2): 88-96. DOI:10.1097/PPO.0000000000000102 |
| [17] |
Zhang X, He C, He C, et al. Nuclear PKM2 expression predicts poor prognosis in patients with esophageal squamous cell carcinoma[J]. Pathol Res Pract, 2013, 209(8): 510-515. DOI:10.1016/j.prp.2013.06.005 |
| [18] |
Li J, Yang Z, Zou Q, et al. PKM2 and ACVR 1C are prognostic markers for poor prognosis of gallbladder cancer[J]. Clin Transl Oncol, 2014, 16(2): 200-207. DOI:10.1007/s12094-013-1063-8 |
| [19] |
Wong N, Ojo D, Yan J, et al. PKM2 contributes to cancer metabolism[J]. Cancer Lett, 2015, 356(2 Pt A): 184-191. |
| [20] |
Morfouace M, Lalier L, Oliver L, et al. Control of glioma cell death and differentiation by PKM2-Oct4 interaction[J]. Cell Death Dis, 2014, 5: e1036. DOI:10.1038/cddis.2013.561 |
| [21] |
Hamabe A, Konno M, Tanuma N, et al. Role of pyruvate kinase M2 in transcriptional regulation leading to epithelial-mesenchymal transition[J]. Proc Natl Acad Sci U S A, 2014, 111(43): 15526-15531. DOI:10.1073/pnas.1407717111 |
 2019, Vol. 46
2019, Vol. 46