文章信息
- 应用18F-FDG PET/CT评估不同CD5表达的弥漫大B细胞淋巴瘤化疗疗效及价值
- Value of 18F-FDG PET/CT in Evaluating Chemotherapeutic Effect of Diffuse Large B Cell Lymphoma Patients with Different CD5 Expression
- 肿瘤防治研究, 2019, 46(10): 926-931
- Cancer Research on Prevention and Treatment, 2019, 46(10): 926-931
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0444
- 收稿日期: 2019-04-04
- 修回日期: 2019-07-10
弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)是非霍奇金淋巴瘤(non-hodgkin lymphoma, NHL)中最常见的类型,是一组具有明显异质性的淋巴系统恶性肿瘤[1]。DLBCL是成人淋巴瘤中最常见的一种类型,国际预后指数(international prognostic index, IPI)评分已广泛用于DLBCL的预后评估,但是在利妥昔单抗时代,IPI预后价值显著降低[2]。早年在日本的一项多中心回顾性研究发现,CD5(+)者约占DLBCL的10%左右,且预后不良,故2008年WHO淋巴造血系统肿瘤分类中推荐将原发CD5(+)的DLBCL作为一个独立免疫学类型。18F-FDG PET/CT显像是目前淋巴瘤诊断和分期最有效的影像学方法[3],但对于淋巴瘤18F-FDG PET/CT半定量指标最大标准化摄取值(SUVmax)和DLBCL预后方面的关系仍存在争议。本研究回顾性分析55例初治的DLBCL患者的临床资料,应用18F-FDG PET/CT Deauville 5分法[4]标准评估治疗效果,从而分析不同CD5表达对DLBCL患者化疗疗效的影响。
1 资料与方法 1.1 临床资料入组标准:选取2014年1月1日—2015年12月31日在本院初治患者60例。所有患者经过穿刺或切取活检,病理诊断参照2008年血液淋巴瘤诊断标准,确诊为DLBCL,并有免疫组织化学报告; 分期标准采用Ann Arbor临床分期系统。所有患者化疗前行18F-FDG PET/CT显像,初始化疗方案为R-CHOP(利妥昔单抗+环磷酰胺+多柔比星+长春新碱+泼尼松); 化疗3~4程期间及化疗结束后6~8周分别行PET/CT显像检查评估疗效; 全疗程化疗结束后6~24月,行PET/CT显像监测复发和随访,每例患者显像次数≥3次,55例患者共行218次扫描。排除标准:(1)淋巴瘤病灶已切除,PET/CT未发现阳性病灶; (2)同时并发其他恶性肿瘤; (3)临床资料不完整。入组60例患者中2例术后显像未探查到淋巴瘤病灶、1例同时并发肺癌、2例失访,均予以剔除,剩余55例患者临床及随访资料完备,进行回顾性分析,其中男27例、女28例,年龄27~77岁,中位年龄56.8岁。
1.2 PET/CT图像采集18F-FDG由广东原子高科同位素医药有限公司提供,放化纯度 > 95%。所有受检者禁食6 h以上,空腹血糖≤10.0 mmol/L,化疗后显像患者空腹血糖≤8.0 mmol/L,按5.18 MBq/kg计算剂量并静脉注射,平静休息60~90 min,显像前排尿,取仰卧位,扫描范围从颅顶至股骨上段。PET/CT设备为Philips Gemini Ⅱ,配备2排螺旋CT,PET系统视野中心空间分辨率为4.8 mm,CT扫描条件120 kV,200 Ma,0.75秒/转,层厚7.5 mm,螺距1.0。PET图像以全身3D采集,9~10个床位,3分钟/床位,轴向视野180 mm,相邻床位间重叠50%。PET数据采用三维行处理最大似然算法(3D-RAMLA)重建,并用CT数据进行非均匀衰减校正。
1.3 PET/CT图像分析所有PET/CT图像均由两名有诊断经验的核医学医师共同阅片。应用感兴趣区(ROI)技术测量SUVmax,如果PET/CT显像阳性,选取摄取程度最高部位的SUVmax; 如果PET/CT阴性,选择治疗前FDG高代谢部位测量SUVmax。采用Deauville 5分法(5-PS)标准评估疗效,病灶摄取FDG程度和纵隔血池、肝本底比较,1分为无摄取,2分为摄取程度低于纵隔,3分为介于纵隔和肝本底之间,4分为高于肝本底(小于3倍),5分为明显高于肝本底(大于3倍)或出现新病灶。参考Lugano分类[5],将化疗3~4周期和化疗结束后随访阶段的PET/CT结果分为3个等级:(1)5分法评分为1~3分,PET/CT示完全代谢反应(complete metabolic response, CMR),考虑为完全缓解; (2)5分法评分为4~5分,与基线比较,FDG摄取程度下降,PET/CT示部分代谢反应(partial metabolic response, PMR),考虑为部分缓解或病变残留; (3)5分法评分为4~5分,与基线比较,FDG摄取程度无明显变化甚至上升,PET/CT示无代谢反应(no metabolic response, NMR)或疾病代谢进展(progressive metabolic disease, PMD),考虑为治疗无效或疾病进展。依据5分法评分,评估结果为CMR,则提示为疗效好或治愈; 评估结果为PMR或NMR甚至PMD,则提示为疗效差或复发。
1.4 随访应用18F-FDG PET/CT显像随访,随访时间从首次PET/CT或病理确诊时间开始。按照中国DLBCL诊断和治疗指南(2013版),治疗结束后第一年,每三月随访一次PET/CT,治疗结束后第二年,每半年随访一次PET/CT。随访截止日期为2018年4月31日,随访时间29月,中位随访时间13.4月。2例失访,已剔除,6例死亡,提前结束随访。
1.5 统计学方法采用SPSS21.0统计软件分析SUVmax用中位数和均数±标准差(x±s)表示,检验水准α=0.05。55例患者分成CD5(+)组、CD5(-)组,应用Pearson卡方检验,比较不同CD5表达在各临床病理因素中的差异; 应用Pearson卡方检验评价CD5(+)和CD5(-)在化疗效果的差异; 应用Logistic回归分析观察各临床病理因素是否为影响化疗疗效的独立因素,P < 0.05为差异有统计学意义。
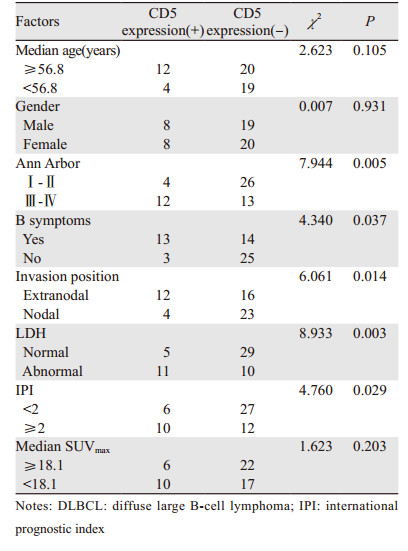
2 结果 2.1 CD5表达和临床病理因素的关系CD5(+)组患者16例、CD5(-)组患者39例,两组间年龄、性别、SUVmax比较差异无统计学意义(χ2=2.623、0.007、1.623,P=0.105、0.931、0.203);在Ann Arbor分期、有无B症状、侵犯部位、LDH、IPI评分差异有统计学意义,见表 1。
|
DLBCL患者化疗结束至随访结束,PET/CT显像评估疗效好的一组治疗前SUVmax为22.1±8.4,疗效差的一组治疗前SUVmax为18.6±10.3。CD5(+)组9例患者治疗后评估为NMR或PMD、2例患者评估为PMR,视为疗效差,5例评估为CMR。CD5(-)组中3例患者评估为NMR或PMD、10例评估为PMR,视为疗效差,26例评估为CMR,视为疗效好。DLBLC患者CD5(-)表达组化疗效果好于CD5(+)表达组(χ2=5.786, P=0.018),预后明显好于CD5(+),差异有统计学意义,见表 2,典型图像见图 1、2。Logistic回归分析显示,年龄、性别、SUVmax都不是影响化疗疗效的独立因素(χ2=3.850、1.442、1.809,P=0.050、0.230、0.179),而Ann Arbor分期、有无B症状、侵犯部位、LDH、IPI评分则是影响化疗疗效的独立因素,见表 3。
|
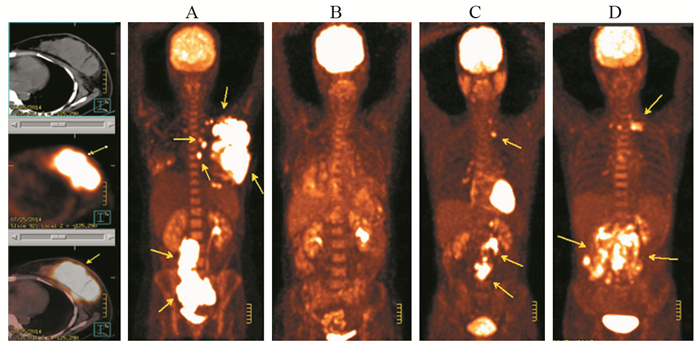
| Female, 45y, DLBCL, CD5(-), Ann Arbor staging Ⅰ, no B symptoms, no extranodal invasion; A: Before chemotherapy, yellow arrows showed DLBCL lesion in nasopharynx, SUVmax 20.6; B: After four courses of chemotherapy, lesion in nasopharynx obviously shrank, metabolism of FDG reduced; C, D: There were no recurrence or new lesions 12 and 24 months after chemotherapy 图 1 DLBCL患者化疗后疾病代谢进展典型病例PET/CT图 Figure 1 PET/CT image of progressive metabolic disease(PMD) in typical DLBCL patient after chemotherapy |
|
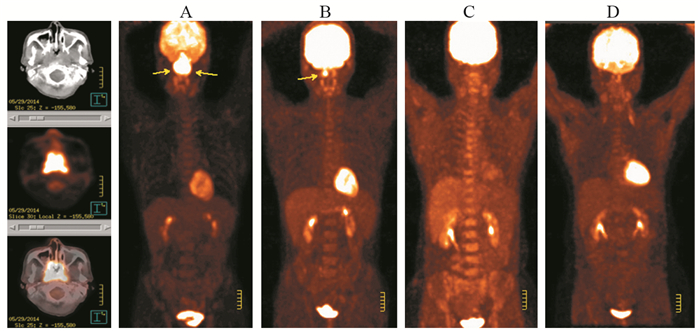
| Male, 65y, DLBCL, CD5(+), Ann Arbor staging Ⅳ, fever, night sweats, weight loss, extranodal invasion; A: Before chemotherapy, yellow arrows showed DLBCL lesions in left breast, clavicle area, armpit, chest wall, left lung hilum, retroperitoneum, paraneovascular. SUVmax 33.9 of the abdominal lesion; B: After four courses of chemotherapy, some lesions disappeared or shrank; C, D: There were recurrence or new lesions 12 and 16 months after chemotherapy. Yellow arrows showed DLBCL lesions in two sides of clavicle area, upper mediastinum and paraneovascular. Some were new lesions. 图 2 DLBCL患者化疗后完全代谢反应典型病例PET/CT图 Figure 2 PET/CT image of complete metabolic response(CMR) in typical DLBCL patient after chemotherapy |

|
DLBCL患者常伴有局部或全身症状,大部分患者在疾病确诊时处于临床Ⅲ期或Ⅳ期[6],病情常表现为迅速进展型。病灶局限的早期患者,通过联合治疗可达到治愈,但进展期患者疗效则显著降低,因此DLBCL患者早期正确的诊断和分期对于提高治愈率尤为重要。
MyLam等[7]回顾性分析了430例DLBCL患者化疗后2~16周内行PET/CT复查,结果显示,治疗后PET/CT结果阳性的患者2年PFS率及OS率均明显低于治疗后PET/CT结果阴性或不确定的患者,治疗后PET/CT的结果可预测患者的预后及生存情况,且阳性结果提示患者预后不良。Xie等[8]认为SUVmax和无疾病进展生存期(progression free survival, PFS)呈负相关。应志涛等[9]认为DLBCL患者接受规范的一线治疗后PET/CT阴性及轻度代谢患者的预后相对较好,而治疗后PET/CT阳性患者预后相对较差。目前,SUVmax作为反映FDG代谢程度的一种半定量方法,受显像时间、剂量和血糖水平等多重因素影响,且DLBCL患者大部分有多个病灶。本研究结果显示,SUVmax值高低不是影响化疗效果的独立因素。分析原因,可能是靶病灶的选择尚无指南或共识一类的标准。活检部位或手术切除的病灶并非全部由PET/CT引导完成,肿瘤负荷最大或最明显的病灶可能已被清除,也可能是活检的病灶并非PET/CT摄取最显著的病灶,病理和靶病灶SUVmax并非来自同一病灶,影响了彼此的关联性。有研究证实了最大标准摄取值减少率(ΔSUVmax)的应用价值,朱璐婷等[10]认为ΔSUVmax可以作为DLBCL患者预后的独立影响因素,但ΔSUVmax最佳界值点各文献报道不一,成像协议、投照条件及阅片医师一致性仍然可能对该值存在影响。尽管SUVmax在本研究中对DLBCL预后的指导价值有限,但Deauville 5分法在DLBCL全疗程疗效评估的广泛使用已经获得了一致认可,在霍奇金淋巴瘤(Hodgkin' s disease, HD)、DLBCL和滤泡性淋巴瘤患者中,不同观察者应用Deauville标准评估后均具有很好的一致性[11]。2014年恶性淋巴瘤影像工作小组国际会议专家共识推荐Deauville标准作为DLBCL疗效评判标准。秦文琼等[12]认为国际协作项目标准(IHPC)和Deauville标准均可用于疗效评价和预后评估,Deauville标准在一定程度上优于IHPC。美国国立综合癌症网络(NCCN)指南(2016年第2版)指出对于DLBCL基本同意推荐进行中期PET/CT,Deauville标准是淋巴瘤治疗结束后疗效评估的重要工具,尤其是HD和DLBCL患者,可以鉴别残存肿块为纤维化或仍有存活肿瘤组织[13]。Fuertes等[14]利用5-PS法分析中期PET/CT结果,< 3分的患者5年PFS和OS分别为79%和92%,≥4分的患者5年PFS和OS均为50%。目前DLBCL患者治疗结束后再分期的最佳时机仍不明确,国内专家组推荐化疗结束后等待6~8周、放疗结束后等待8~12周,再行PET/CT检查[3]。由于使用Deauville 5分法是基于病灶、肝脏、纵隔的SUVmax,因此PET/CT显像需要统一基线条件,从而得到更准确的疗效评估。本研究还发现SUVmax值变化和不同CD5表达间无关,可能和病例数偏少、靶病灶选择等因素有关,在今后的研究中将会继续寻找其中的规律。
CD5抗原由90%正常成熟T淋巴细胞和10%~20%外周B淋巴细胞表达,是一种跨膜糖蛋白。IPI评分是最早用于判断侵袭性淋巴瘤预后的临床工具,包括年龄、行为状态、Ann Arbor分期、侵犯部位、LDH,本研究发现CD5(+)的DLBCL患者大多数分期较晚、存在B症状,且多数侵犯结外脏器或组织,IPI评分≥2分,这和宋腾等[15]报道一致。CD5(+)DLBCL患者以老年人和女性高发,但本研究中57岁以上CD5(+)者13例(13/55),57岁以下者CD5(+)3例(3/55),年龄和性别差异无统计学意义,和文献报道结果不同,分析原因可能是样本例数偏少所致。Tzankov等[16]报道CD5(+)DLBCL患者预后明显差于CD5(-)患者,我国的文献也报道CD5(+)DLBCL患者的5年生存率和无疾病进展生存率分别为33.1%和14.6%,均显著低于CD5(-)的患者[17]。本研究通过对55例患者化疗疗效的评估发现,CD5(+)的DLBCL患者化疗后CMR者5例(5/55),明显少于CD5(-)患者(26/55),差异有统计学意义。基于本次研究结果,判断CD5(+)DLBCL患者预后更差,这和上述国内外的研究结果一致。
利妥昔单抗的出现改善了DLBCL患者的生存率,Hyo等[18]研究认为,利妥昔单抗能将CD5(-)DLBCL患者的2年总体生存率(OS)由70%明显提高至84%,但对CD5(+)DLBCL患者,利妥昔单抗并未能明显提高OS。Miyazaki等[19]研究CD5(+)的DLBCL患者接受单纯化疗和接受利妥昔单抗联合化疗,其完全缓解率(CR)分别为66%和80%,OS分别为54%和70%,差异均有统计学意义。但利妥昔单抗不能降低中枢神经系统(CNS)侵犯的复发率,因此CD5(+)的DLBCL患者需要更加有效的针对CNS的预防或治疗方法。本研究中55例患者出现5例CNS侵犯,病例数较少,因此未作有关方面深入的研究。
有关CD5(+)的DLBCL发病机制,研究人员利用动物模型证实T细胞或B细胞中CD5的高表达能使识别后的T或B细胞受体介导的激活阈值升高,从而使这些细胞逃避自身免疫。但是CD5(+)淋巴细胞的扩增可能是有害的,在肿瘤性T细胞中,CD5的表达使淋巴细胞耐受,从而不能识别和消除恶性细胞。CD5(+)细胞还可能通过分泌白介素-10(IL-10)等因子,避免自身免疫的出现,分泌IL-10的B细胞也能够阻止抗肿瘤的免疫反应[20]。
综上所述,CD5(+)作为DLBCL的一种亚型,其对DLBCL患者预后的影响已较为明确,利妥昔单抗的出现为CD5(+)的DLBCL患者延长了生存时间,但其他面临的问题仍然还在解决中。临床诊治淋巴瘤时,用PET/CT评估DLBCL患者化疗疗效的优势不言而喻,但靶病灶的选择是SUVmax发挥作用的掣肘因素,因此在以后的研究中,如何制定选择靶病灶的标准,一定程度上也会影响DLBCL患者的预后评估。
作者贡献
杨 明:收集病例资料、进行统计分析及论文撰写
冯彦林:论文方向指导
冼伟均、鲁胜男:收集病例资料
王颖、李雯:协助统计分析
黄克敏:按照课题要求完成显像及质量控制
| [1] | Sehn LH, Gascoyne RD. Diffuse large B-cell lymphoma: optimizing outcome in the context of clinical and biologic heterogeneity[J]. Blood, 2015, 125(1): 22–32. DOI:10.1182/blood-2014-05-577189 |
| [2] | Friedberg JW. Relapsed/refractory diffuse large B-cell lymphoma[J]. Hematology Am Soc Hematol Educ Program, 2011, 2011: 498–505. DOI:10.1182/asheducation-2011.1.498 |
| [3] | 黄钢, 赵晋华. 淋巴瘤18F-FDG PET/CT显像临床应用指南[J]. 中华核医学与分子影像杂志, 2016, 36(5): 458–460. [ Huang G, Zhao JH. Clinical practice guideline of 18F-FDG PET/CT in lymphoma (2016 edition)[J]. Zhonghua He Yi Xue Yu Fen Zi Ying Xiang Za Zhi, 2016, 36(5): 458–460. DOI:10.3760/cma.j.issn.2095-2848.2016.05.017 ] |
| [4] | Baratto L, Davidzon GA, Moghbel M, et al. Comparison Between Different PET and CT-Based Imaging Interpretation Criteria at Interim Imaging in Patients With Diffuse Large B-Cell Lymphoma[J]. Clin Nucl Med, 2018, 43(1): 1–8. |
| [5] | Cheson BD, Fisher RI, Barrington SF, et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification[J]. J Clin Oncol, 2014, 32(27): 3059–3068. DOI:10.1200/JCO.2013.54.8800 |
| [6] | Herrmann K, Buck AK, Schuster T, et al. Predictive value of initial 18F-FLT uptake in patients with aggressive non-Hodgkin lymphoma receiving R-CHOP treatment[J]. J Nucl Med, 2011, 52(5): 690–696. DOI:10.2967/jnumed.110.084566 |
| [7] | MyLam KJ, El-Galaly TC, Hutchings M, et al. Prognostic impact of clinician-based interpretation of 18F-fluorodeoxyglucose positron emission tomography/computed tomography reports obtained in patients with newly diagnosed diffuse large B-cell lymphoma[J]. Leuk Lymphoma, 2014, 55(7): 1563–1569. DOI:10.3109/10428194.2013.850165 |
| [8] | Xie M, Wu K, Liu Y, et al. Predictive value of F-18 FDG PET/CT quantization parameters in diffuse large B cell lymphoma: a meta analysis with 702 participants[J]. Med Oncol, 2015, 32(1): 446. DOI:10.1007/s12032-014-0446-1 |
| [9] | 应志涛, 王雪鹃, 宋玉琴, 等. 弥漫大B细胞淋巴瘤患者规范治疗后行18F-FDG PET/CT检查的预后意义[J]. 中华血液学杂志, 2012, 33(10): 810–813. [ Ying ZT, Wang XJ, Song YQ, et al. Prognostic value of 18F-FDG PET/CT after first-line treatment in patients with diffuse large B cell lymphoma[J]. Zhonghua Xue Ye Xue Za Zhi, 2012, 33(10): 810–813. DOI:10.3760/cma.j.issn.0253-2727.2012.10.005 ] |
| [10] | 朱璐婷, 岑溪南, 欧晋平, 等. 中期18F-FDG PET/CT显像不同评价方法对弥漫大B细胞淋巴瘤患者预后判断价值[J]. 中国实验血液学杂志, 2017, 25(2): 431–437. [ Zhu LT, Cen XN, Ou JP, et al. Values of Different Evaluation Criteria of Interim 18F-FDG PET/CT Scan for Prediction of Prognosis in Patients with DLBCL[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2017, 25(2): 431–437. ] |
| [11] | Barrington SF, Mikhaeel NG, Kostakoglu L, et al. Role of imaging in the staging and response assessment of lymphoma: consensus of the International Conference on Malignant Lymphomas Imaging Working Group[J]. J Clin Oncol, 2014, 32(27): 3048–3058. DOI:10.1200/JCO.2013.53.5229 |
| [12] | 秦文琼, 陈秋松, 蔡莉, 等. IHPC和Deauville标准对淋巴瘤疗效评价及预后评估价值探讨[J]. 中华肿瘤防治杂志, 2018, 25(5): 663–667. [ Qin WQ, Chen QS, Cai L, et al. Value of IHPC and Deauville criteria in the evaluation of response assement and prognosis in the HL and NHL patients[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2018, 25(5): 663–667. ] |
| [13] | National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Non-Hodgkin'sLymphomas(v.2.2016)[R/OL]. https://www.nccn.org/pmfessionals/physician-gls/f-guide-lines.asp. |
| [14] | Fuertes S, Setoain X, Lopez-Guillermo A, et al. Interim FDG PET/CT as a prognostic factor in diffuse large B-cell lymphoma[J]. Eur J Nucl Med Mol Imaging, 2013, 40(4): 496–504. DOI:10.1007/s00259-012-2320-8 |
| [15] | 宋腾, 梁绍平, 李静敏, 等. 123例原发韦氏环弥漫大B细胞淋巴瘤临床特征与预后分析[J]. 肿瘤防治研究, 2016, 43(6): 382–386. [ Song T, Liang SP, Li JM, et al. Clinical characteristics and Prognesis of 123 Patients with Diffuse Large B-cell Lymphoma of Waldeyer' s Ring[J]. Zhong Liu Fang Zhi Yan Jiu, 2016, 43(6): 382–386. ] |
| [16] | Tzankov A, Leu N, Muenst S, et al. Multiparameter analysis of homogeneously R-CHOP-treated diffuse large B cell lymphomas identifies CD5 and FOXP1 as relevant prognostic biomarkers: Report of the prospective SAKK 38/07 study[J]. J Hematol Oncol, 2015, 8: 70. DOI:10.1186/s13045-015-0168-7 |
| [17] | 郑彦, 马小波, 姜晶, 等. CD5表达是弥漫性大B细胞淋巴瘤的不利预后因素[J]. 中华病理学杂志, 2012, 41(3): 156–160. [ Zheng Y, Ma XB, Jiang J, et al. CD5 expression is an adverse prognostic factor in diffuse large B-cell lymphoma[J]. Zhonghua Bing Li Xue Za Zhi, 2012, 41(3): 156–160. DOI:10.3760/cma.j.issn.0529-5807.2012.03.003 ] |
| [18] | Hyo R, Tomita N, Takeuchi K, et al. The therapeutic effect of rituximab on CD5-positive and CD5-negative diffuse large B-cell lymphoma[J]. Hematol Oncol, 2010, 28(1): 27–32. |
| [19] | Miyazaki Yamaguchi M, Suzuki R, et al. CD5-positive diffuse large B-cell lymphoma:A retrospective study in 337 patients treated by chemotherapy with or without rituximab[J]. Ann Oncol, 2011, 22(7): 1601–1607. DOI:10.1093/annonc/mdq627 |
| [20] | Dalloul A. CD5: a safeguard against antoimmunity and a shield for cancer cells[J]. Autoimmun Rev, 2009, 8(4): 349–353. DOI:10.1016/j.autrev.2008.11.007 |
 2019, Vol. 46
2019, Vol. 46