文章信息
- 自噬相关蛋白5通过p53/p21通路调控结肠癌细胞衰老
- Autophagy Related Protein 5 Regulates Colon Cancer Cell Senescence Through p53/p21 Pathway
- 肿瘤防治研究, 2019, 46(12): 1068-1072
- Cancer Research on Prevention and Treatment, 2019, 46(12): 1068-1072
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0416
- 收稿日期: 2019-06-25
- 修回日期: 2019-08-05
自噬相关蛋白5(autophagy related protein5, ATG5)是一种重要的自噬小体形成相关蛋白,主要起类E1样激活酶作用[1-2]。大量的文献报道,除了发挥调控自噬的作用外,ATG5在病毒免疫、肿瘤凋亡和肿瘤增殖中也发挥了重要的作用[3-5],有研究提示ATG5有望成为临床肿瘤治疗的新靶点[6]。然而ATG5与肿瘤细胞衰老的关系鲜有报道。
肿瘤最重要的生物学特点体现在肿瘤细胞倍增时间缩短,分裂能力增强,而造成这一特性的原因目前尚不清楚,因此临床针对肿瘤靶向治疗取得的效果亦有限,深入探讨肿瘤发生发展的具体分子机制显得尤为重要。肿瘤衰老目前被认为是一种抑制肿瘤增殖与分裂的重要方式,研究目前已认为其机制与p53/p21、p16/RB、细胞周期蛋白等信号通路密切相关[7-8]。针对肿瘤衰老机制深入的研究有望为肿瘤干预带来新措施和新思路。因此本文将重点阐明ATG5与肿瘤衰老的关系,探讨以ATG5为分子靶点作为治疗肿瘤的可行性。
1 材料与方法 1.1 细胞与试剂人结肠癌HT29细胞由华中科技大学附属同济医院分子生物中心保种培养传代。β-半苷乳糖检测试剂盒以及CCK8检测试剂盒(cell counting kit-8)购于江苏碧云天生物公司,多柔比星(DOX,10 mmol/L)购于上海Med Chem Express(MCE)公司。转染试剂Lipo2000和Opti-MEM培养基购自美国Invitrogen公司,针对ATG5特异性siRNA和对照无序小干扰RNA购于广州锐博生物公司。ATG5、GAPDH、P53和P21抗体均购自美国Santa Cruz生物科技公司,高糖培养基购于武汉启动子生物公司。
1.2 细胞培养结肠癌HT29细胞培养在含有5%CO2的37℃恒温箱中,建立诱导结肠癌衰老模型时,使用1 μmol/L多柔比星于HT29细胞中孵育24 h。细胞传代时,使用0.25%胰蛋白酶消化细胞2 min,加入高糖培养基中和胰蛋白酶,将细胞轻柔吹打成单细胞悬液。
1.3 细胞转染将结肠癌HT29细胞铺于6孔板中加入2 ml完全培养基培养。待细胞贴壁,融合度达60%时进行转染。分别将siRNA和Lipo2000溶于250 μl Opti-MEM培养基中,静置5 min后将siRNA和Lipo2000轻柔混合再次静置20 min。期间,弃6孔板中细胞培养基,加入1.5 ml完全培养基。20 min后,将siRNA和Lipo2000混悬液轻柔加入六孔板中,继续放入培养箱培养。
1.4 细胞衰老β-半乳糖苷酶染色将细胞铺于6孔板中进行相应实验干预,通过多柔比星诱导细胞衰老或利用siRNA低表达ATG5后,弃细胞培养基,加入1 ml β-半乳糖苷酶染色固定液,室温放置15~30 min。吸出固定液后用PBS洗涤细胞2~3次。每孔加入1 ml染色工作液后,将6孔板封口胶封闭置于不含CO2的37℃烘箱中孵育12 min。次日将6孔板取出,显微镜下观察细胞着色情况并拍照。
1.5 CCK8法检测细胞增殖细胞转染24 h后,将各组细胞铺于96孔板,每孔约3 000个细胞,每组设置3个复孔。待细胞贴壁后,分别于0、24、48、72 h在每孔中加入10 μl CCK8,孵育2 h后,使用酶标仪检测细胞在450 nm波长处吸光度,绘制各组细胞生长曲线。
1.6 Western blot检测蛋白表达将细胞铺于6孔板中,通过多柔比星诱导细胞衰老或利用siRNA低表达ATG5后,将细胞置于冰上,细胞裂解液裂解30 min,刮取细胞置于1.5 ml EP管中,高速低温离心(4℃,12 000 r/min)15 min,取上清液测蛋白浓度,计算样品浓度及蛋白上样量。加样以SDS-PAGE胶电泳分离蛋白,湿转至PVDF膜,5%脱脂牛奶封闭。分别孵育一抗和二抗后,在Western blot曝光机下利用ECL发光显色。
1.7 PI染色细胞周期实验将细胞铺于6孔板中,通过多柔比星诱导细胞衰老或利用siRNA低表达ATG5后,胰酶消化收集细胞,低速离心(常温,1 200 r/min),每管加入预冷的80%乙醇固定细胞。过夜,低速离心后,PBS洗涤细胞沉淀一次,加入200 μl binding buffer,同时分别加入5 μl PI和5 μl RNase,吹打均匀后室温避光静置30 min,流式细胞仪检测各组细胞的细胞周期分布变化。
1.8 统计学方法用SPSS21.0统计软件进行统计学分析,检验方法采用t检验。每组实验均进行了三次独立重复实验。P < 0.05为差异有统计学意义。
2 结果 2.1 ATG5蛋白在多柔比星诱导的结肠癌衰老模型中的表达为检测ATG5是否参与了结肠癌衰老的过程,在HT29细胞中加入1 μmol/L多柔比星培养48 h,细胞衰老现象显著增加,见图 1A。相对于对照组,诱导组细胞增殖活性明显下降,见图 1B。同时诱导组细胞发生G2/M期阻滞,见图 1C。证实多柔比星诱导结肠癌细胞衰老模型建立成功。另外收集细胞进行Western blot检测ATG5蛋白表达量,发现相对于对照组,诱导组中ATG5蛋白的表达量显著降低,提示ATG5蛋白可能参与了结肠癌细胞衰老过程,见图 1D。
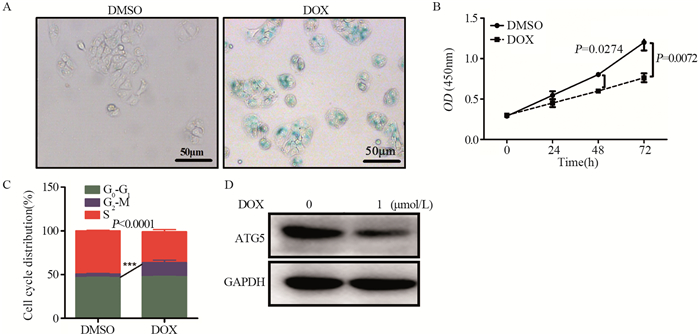
|
| A: DOX induced the senescence of HT29 colon cancer cells; B: Dox-induced cell senescence inhibited the proliferation of HT29 colon cancer cells. (The experiment was repeated three times in each group); C: cell cycle was blaked after DOX induced senescence of HT29 colon cancer cells; D: DOX inhibited the expression of ATG5 protein. (Each experiment was repeated three times). 图 1 ATG5在结肠癌衰老细胞中低表达 Figure 1 ATG5 expression was downregulated in colon cancer cell senescence |
在HT29细胞中瞬时转染针对ATG5的siRNA(两条靶向ATG5的不同siRNA序列:SiATG5#1和SiATG5#2)和对照siRNA(SiNC),24 h后,通过β-半乳糖苷酶染色检测发现,siRNA对照组发生衰老细胞数平均值为3±1,而SiATG5组发生衰老细胞数平均值为11±2,见图 2A~B,提示低表达ATG5可促进HT29细胞衰老。由于ATG5是自噬调控蛋白,因此为了排除自噬在ATG5调控结肠癌细胞衰老中的作用,在低表达ATG5的同时加入自噬诱导剂Rapa(1 μmol/L)诱导自噬,24 h后SiNC对照组细胞发生衰老细胞数平均值为3±1,而SiATG5组发生衰老细胞数平均值为12±2,低表达ATG5+Rapa组发生衰老细胞平均值为12±1,见图 2C~D,提示ATG5对结肠癌细胞衰老的促进作用并非依赖于自噬。
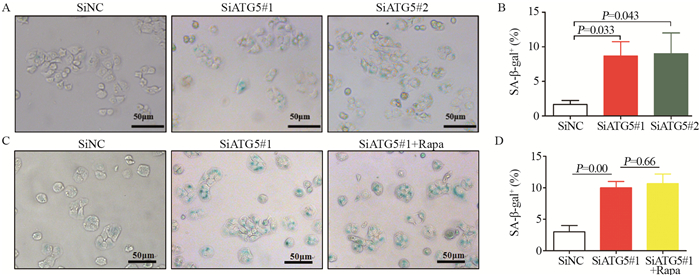
|
| A: low expression of ATG5 promoted the senescence of colon cancer HT29 cells. (SiATG5#1 and SiATG5#2 were two targeted sequences. Each experiment was repeated three times); B: quantitative analysis of the inhibition of ATG5 promote the proportion of colon cancer HT29 cells; C: low expression of ATG5 promoted the senescence of colon cancer HT29 cells, independent of autophagy; D: quantitative analysis showed low expression of ATG5 promoted the senescence of colon cancer HT29 cells independent of autophagy. 图 2 低表达ATG5促进结肠癌细胞衰老 Figure 2 Low expression of ATG5 promoted senescence of colon cancer cells |
在HT29细胞中瞬时转染针对ATG5的siRNA和对照siRNA,预转染24 h后,将细胞消化接种于96孔板。CCK8法检测细胞增殖能力,结果发现在转染48 h后相对于对照SiNC,SiATG5#1、SiATG5#2组细胞增殖能力明显较弱(P < 0.05),见图 3A,提示ATG5通过调控细胞衰老来抑制HT29细胞的增殖。另外,在低表达ATG5的同时加入自噬诱导剂1 μmol Rapa诱导自噬,发现SiATG5#1组细胞和低表达ATG5+Rapa组之间细胞增殖活性无明显差异,见图 3B。证实ATG5通过诱导衰老抑制结肠癌细胞HT29增殖非依赖于自噬。

|
| A: low expression of ATG5 inhibited the proliferation activity of colon cancer HT29 cells; B: low expression of ATG5 inhibited proliferation activity of colon cancer HT29 cells, independent of autophagy. 图 3 低表达ATG5抑制结肠癌细胞增殖 Figure 3 Low expression of ATG5 inhibited proliferation of colon cancer cells |
蛋白免疫印迹方法发现,SiATG5#1、SiATG5#2组中P53和P21蛋白表达较对照组明显增高,见图 4。上述结果提示了ATG5很有可能通过P53/P21信号通路调控结肠癌细胞衰老进而影响肿瘤的增殖。
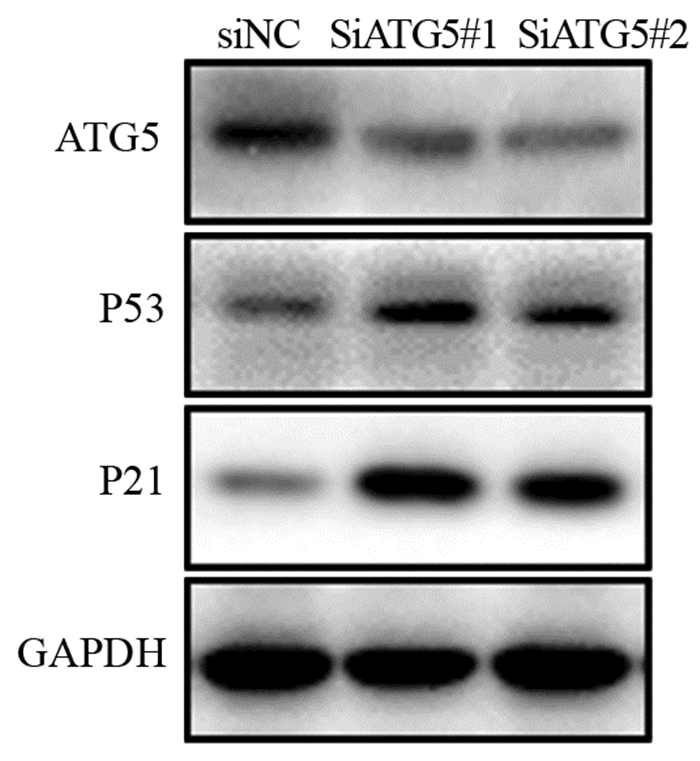
|
| 图 4 低表达ATG5可促进P53和P21蛋白的表达 Figure 4 Low expression of ATG5 promoted expression of P53 and P21 proteins |
结肠癌是目前世界上发病率和致死率均较高的恶性肿瘤之一[9-10]。虽然临床手术技术的提高和靶向药物的研发使得部分结直肠癌患者的预后得到改善,但总体预后仍不理想[11]。细胞的衰老行为在肿瘤发生发展中发挥着阻滞的作用,阻遏肿瘤的增殖能抑制肿瘤生长[12]。目前已知PI3K/AKT、TGFβ/SMADs、RAS、p53/p21等多种信号通路[8]的异常激活参与了肿瘤的衰老过程。
ATG5作为自噬基因在自噬小体形成和自噬流过程中扮演了重要的角色并调控着肿瘤的多种生物学行为[13]。例如有学者报道下调ATG5通过抑制自噬促进乳腺癌的侵袭转移[14]。多数研究均只关注ATG5通过调控自噬影响肿瘤的生物学行为,然而ATG5除了调控自噬作用外,是否有独立于自噬的作用,目前尚无报道。同时ATG5在肿瘤衰老中的作用未见报道,肿瘤衰老过程中有大量的蛋白参与调控,相关蛋白的表达随着衰老进程的变化而变化。本研究中首先发现了在肿瘤细胞衰老的过程中,ATG5蛋白表达水平明显下降,提示ATG5可能参与了肿瘤衰老的过程。为了探讨ATG5是否能够调控肿瘤衰老,进一步通过特异性SiRNA构建了低表达ATG5的结肠癌细胞模型。通过β-半乳糖苷酶染色首次发现ATG5低表达确实可促进结肠癌细胞的衰老,CCK8实验结果进一步揭示ATG5低表达可抑制结肠癌细胞增殖。这一结果提示ATG5很有可能通过调控结直肠癌细胞的衰老来影响肿瘤的增殖。以往的研究证实p21作为细胞周期抑制因子在肿瘤衰老中发挥了重要作用,而p53作为转录因子在转录水平激活p21的表达,进而引起细胞衰老,抑制肿瘤的增殖[15]。为了探索ATG5调控肿瘤衰老的分子机制,本研究通过Western blot实验证实了低表达ATG5可以直接影响P53/P21信号通路的表达。同时进一步证实自噬水平升高后低表达ATG5仍可促进结肠癌细胞的衰老,这提示了自噬基因ATG5在结肠癌中发挥了非自噬作用,即:通过p53/p21信号通路调控结肠癌细胞衰老进而影响肿瘤的增殖。而在甲状腺癌中有学者证实ATG5通过促进自噬抑制肿瘤的增殖[16],提示在不同肿瘤中ATG5调控肿瘤增殖的具体方式各有不同,同时提醒我们ATG5调控肿瘤进展很有可能是通过影响衰老和自噬两种水平方式来实现的。下一步课题组将集中探讨ATG5在结肠癌中调控p53/p21的具体分子机制,以期望针对ATG5开发可用于临床的特异性靶向药物。
作者贡献
胡福清:实验实施,分析和解释数据,撰写论文
陈雅祺、吴齐:采集数据,统计分析
胡俊波、王桂华:指导实验的实施
刘鹭:设计实验,修改论文
| [1] |
Klionsky DJ, Abdelmohsen K, Abe A, et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition)[J]. Autophagy, 2016, 12(1): 67-68. |
| [2] |
You Z, Xu Y, Wan W, et al. Tp53inp2 contributes to autophagosome formation by promoting LC3-ATG7 interaction[J]. Autophagy, 2019, 15(8): 1309-1321. DOI:10.1080/15548627.2019.1580510 |
| [3] |
Jounai N, Takeshita F, Kobiyama K, et al. The Atg5 Atg12 conjugate associates with innate antiviral immune responses[J]. PNAS, 2007, 104(35): 14050-14055. DOI:10.1073/pnas.0704014104 |
| [4] |
Ndoye A, Budina-Kolomets A, Kugel CH3rd, et al. Atg5 mediates a positive feedback loop between wnt signaling and autophagy in melanoma[J]. Cancer Res, 2017, 77(21): 5873-5885. DOI:10.1158/0008-5472.CAN-17-0907 |
| [5] |
O'Sullivan TE, Geary CD, Weizman OE, et al. Atg5 is essential for the development and survival of innate lymphocytes[J]. Cell Rep, 2016, 15(9): 1910-1919. DOI:10.1016/j.celrep.2016.04.082 |
| [6] |
Xiong X, Wu M, Zhang H, et al. Atg5 sirna inhibits autophagy and enhances norcantharidin-induced apoptosis in hepatocellular carcinoma[J]. Int J Oncol, 2015, 47(4): 1321-1328. DOI:10.3892/ijo.2015.3103 |
| [7] |
Campisi J. Aging, cellular senescence, and cancer[J]. Annu Rev Physiol, 2013, 75: 685-705. DOI:10.1146/annurev-physiol-030212-183653 |
| [8] |
Rayess H, Wang MB, Srivatsan ES. Cellular senescence and tumor suppressor gene p16[J]. Int J Cancer, 2012, 130(8): 1715-1725. DOI:10.1002/ijc.27316 |
| [9] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. DOI:10.3322/caac.21551 |
| [10] |
Burki TK. Colorectal adenoma risk in childhood cancer survivors[J]. Lancet Oncol, 2018, 19(4): e189. DOI:10.1016/S1470-2045(18)30197-9 |
| [11] |
Ilson DH. Adjuvant therapy in colon cancer: Less is more[J]. Lancet Oncol, 2018, 19(4): 442-443. DOI:10.1016/S1470-2045(18)30127-X |
| [12] |
Rufini A, Tucci P, Celardo I, et al. Senescence and aging: The critical roles of p53[J]. Oncogene, 2013, 32(43): 5129-5143. DOI:10.1038/onc.2012.640 |
| [13] |
Zhao Y, Sun X, Nie X, et al. COX5B regulates MAVS-mediated antiviral signaling through interaction with ATG5 and repressing ROS production[J]. PLoS Pathog, 2012, 8(12): e1003086. DOI:10.1371/journal.ppat.1003086 |
| [14] |
Han Q, Deng Y. Downregulation of atg5-dependent macroautophagy by chaperone-mediated autophagy promotes breast cancer cell metastasis[J]. Sci Rep, 2017, 7(1): 4759. DOI:10.1038/s41598-017-04994-x |
| [15] |
Manu KA, Cao PHA, Chai TF, et al. P21cip1/waf1 coordinate autophagy, proliferation and apoptosis in response to metabolic stress[J]. Cancers, 2019, 11(8): pii: E1112. DOI:10.3390/cancers11081112 |
| [16] |
Qin Y, Sun W, Zhang H, et al. Lncrna gas8-as1 inhibits cell proliferation through atg5-mediated autophagy in papillary thyroid cancer[J]. Endocrine, 2018, 59(3): 555-564. DOI:10.1007/s12020-017-1520-1 |
 2019, Vol. 46
2019, Vol. 46


